黄芪多糖对糖尿病动脉粥样硬化大鼠糖脂代谢的影响及血管内皮保护机制
禹博威 潘晓琼 陈君第霞 胡臻
1.温州医科大学 浙江,温州 325000 2.温州医科大学附属第二医院
2型糖尿病是糖尿病的常见类型,以长期高血糖状态和胰岛素抵抗为主要临床表现,可引发视网膜病变及神经损伤、糖尿病肾病、心血管病变等并发症[1-2]。在糖尿病诸多大血管并发症中,以动脉粥样硬化(atherosclerosis,AS)最为常见,其发生发展可导致冠心病、脑梗死等一系列心血管疾病,是引起患者死亡的主要危险因素[3]。血管内皮功能异常是导致AS相关心血管病变的重要因素,早期可表现为血管内膜脂蛋白和单核细胞的渗透积聚,单核细胞在内膜下先分化为巨噬细胞,巨噬细胞吞噬积聚的脂蛋白后转变成泡沫细胞,活化的内皮细胞和巨噬细胞产生多种细胞因子,引起纤维组织增生,逐步形成纤维斑块,斑块导致的血管堵塞和斑块破裂引起的血栓都会引发的动脉粥样硬化性栓塞[4],所以防治内皮功能异常是治疗AS的关键点。
中药黄芪是豆科植物黄芪的干燥根茎,其主要活性提取物黄芪多糖(Astragalus polysaccharides,APS)及黄芪甲苷等具有一系列药理作用,包括促进免疫反应、抗炎、保护血管、抗氧化、改善胰岛素抵抗和抗肿瘤等[5-9],已被广泛用于心血管疾病的治疗。研究显示,APS能够促进一氧化氮(nitric oxide,NO)的产生,改善NO相关的血管内皮依赖性舒张功能障碍[10]。NO是血管内皮细胞合成分泌的血管内皮舒张因子,除了维持血管内皮舒张功能外,还具有抑制白细胞和血小板聚集和黏附、诱导血小板解聚、促进血管内皮细胞生长等作用[11-12]。内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)是NO生成和消除的关键酶。有研究表明,磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)能够通过激活eNOS,提高NO水平,以维持血管内皮功能[13-14]。NOX活性升高,ROS产生增多,则会抑制eNOS活性,引起NO释放减少[15]。另外有报道证实,APS能够通过AMPK通路促进葡萄糖摄取,改善胰岛素抵抗并减轻炎症反应[7,16]。但APS促进NO生成是否与AMPK途径有关尚不明确,因此本研究以高脂饮食联合链脲佐菌素(streptozotocin,STZ) 腹腔注射+维生素D3(vitamin D3,VitD3)灌胃+免疫损伤法建立糖尿病AS大鼠模型,探讨APS对AS大鼠NO调节信号通路的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物 无特定病原体(specific pathogen free,SPF) 级SD雄性大鼠50只,4周龄,体质量80~120g,由温州医科大学实验动物中心提供[实验动物生产许可证号码:SCXK(浙)2015-0001],饲养于温州医科大学实验动物中心[实验动物使用许可证号码:SYXK(浙)2016-0006]。
1.1.2 主要试剂 70% APS购于上海士锋生物科技有限公司(批号:89250-26-0);弗氏完全佐剂、卵清蛋白均购于美国Sigma公司(批号:F5881、A5503);98% VitD3购于上海源叶生物科技有限公司(批号:S28148);STZ、苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒均购于北京索莱宝科技有限公司(批号:S8050、G1121);大鼠胰岛素(insulin,INS)酶联免疫吸附检测(enzyme linked immunosorbent assay,ELISA)试剂盒购于上海博蕴生物科技有限公司(BF-E30620);Trizol、反转录试剂盒、荧光定量试剂盒均购于美国Invitrogen公司(批号:15596026、4374967、1176102K);血糖仪及血糖试纸均购于瑞士罗氏公司(批号:10151134、26000931)。
1.1.3 主要仪器 AU5800全自动生化分析仪购于美国Beckman Coulter公司;DM2500荧光正置显微镜、EG1150石蜡包埋机、RM2235石蜡切片机均为德国徕卡公司产品;TPJ-A型摊片机、TPJ-A型烘片机均购于常州中威电子仪器有限公司;DW-86L626超低温冰箱为中国海尔公司产品;超速低温离心机购于美国Thermo Forma公司;Light Cycler480型实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)仪为瑞士罗氏公司产品。
1.2 方法
1.2.1 糖尿病AS模型建立 50只大鼠适应性饲养1周后,选取30只造模,剩余20只不作处理。造模大鼠予高脂饲料饲养4周,配方为78.8%基础饮食、10%蛋黄粉、10%猪油、1%胆固醇、0.2%猪胆汁盐,使之产生胰岛素抵抗;其余大鼠饲喂普通饲料。STZ以pH值为4.5的0.1mol·L-1柠檬酸缓冲液溶解,配制成浓度为1%的STZ溶液。注射前大鼠禁食不禁饮12h,造模大鼠以35mg·kg-1的剂量一次性腹腔注射STZ,未造模大鼠注射等量0.9%氯化钠注射液。VitD3以无水乙醇溶解,配制成浓度为30mg·mL-1的溶液,再与食用油按1∶4的比例混合配成混合溶液,在造模大鼠注射STZ 1周后,以VitD3 15mg·kg-1的剂量灌胃1次,未造模大鼠给予乙醇食用油混合溶液灌胃。次日,将弗氏完全佐剂与卵清蛋白混合成抗原乳液,在造模大鼠背部按照3mg·kg-1的剂量皮下注射1次,间隔3周后以2.5mg·kg-1的剂量腹腔注射,加强免疫诱导,1次/周,连续注射3周;未造模大鼠只注射等量0.9%氯化钠注射液。STZ注射1周后,在大鼠尾尖取血,连续2次,以快速血糖仪测空腹6h后血糖,空腹血糖(fasting blood glucose,FBG)≥11.1mmol·L-1者为糖尿病模型造模成功[17]。
1.2.2 分组和给药 30只造模大鼠中,实验期间死亡10只,将余下20只造模大鼠,分为模型组和治疗组;另将20只未造模大鼠分为空白对照组和APS对照组,每组10只。查阅文献发现多数研究者采用700mg/(kg·d)的APS进行灌胃治疗,均有比较明显的延缓糖尿病进展的作用[18-20]。前期预实验发现,高浓度(大于700mg·kg-1)灌胃过程中容易出现药物返流,引发肺炎和窒息,难以保证大鼠生存率。综合考虑后,最终以700mg·kg-1作为灌胃治疗的剂量。APS对照组与治疗组以700mg·kg-1APS灌胃治疗;空白对照组与模型组以等量0.9%氯化钠注射液灌胃,连续给药8周。
1.2.3 检测指标
1.2.3.1 大鼠一般情况 观察并记录各组大鼠的精神状态、活动情况、毛色情况、饮食饮水量以及二便情况。
1.2.3.2 样本采集 末次给药后,大鼠以10%水合氯醛3.5mL·kg-1腹腔注射麻醉,心脏取血3~5mL置于冰上备用。打开胸腔后分离胸主动脉,部分样本-80℃冻存;部分样本以4%多聚甲醛溶液固定备用。
1.2.3.3 血生化指标检测 将冷凝后的大鼠血液,3000r/min离心15min后取血清-20℃保存,以全自动生化分析仪检测血清FBG、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平。以ELISA法检测空腹胰岛素(fasting serum insulin,FINS)水平,操作严格按照试剂盒说明书进行。根据FBG和FINS计算胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR),HOMA-IR=FINS×FBG/22.5。
1.2.3.4 胸主动脉病理形态学观察 将经多聚甲醛溶液固定24h的胸主动脉组织取出,洗涤后梯度乙醇脱水,二甲苯透明,石蜡包埋,5μm切片,按照HE染色试剂盒说明书脱蜡、染色、封片,光镜下观察。
1.2.3.5 Real-time qPCR检测胸主动脉组织eNOS、烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)、AMPK mRNA的表达 取150mg样本组织,充分研磨后,以Trizol试剂抽提总RNA。参照反转录试剂盒和荧光定量试剂盒说明书,反转录合成cDNA后,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,进行PCR反应,引物设计和合成在Invitrogen公司完成,序列见表1。反应体系共25μL,由 5 ×PCR Buffer 5.0μL、250mmol·L-1Mg2+0.3μL、10mmol·L-1脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)0.75μL、10μmol·L-1上 下游引物各0.5μL、25×SYBRGreen Ⅰ 1.0μL、10-3×Calibration 1.0μL、5U·μL-1HS-Ex-Taq酶0.25μL、ddH2O 14.7μL、cDNA 1.0μL组成。 反应条件见表2,产物4℃保存。

表1 引物序列Tab.1 Primer sequences

表2 反应条件Tab.2 Reaction conditions
1.3 统计学分析 采用SPSS 23.0统计软件进行统计学分析。服从正态分布的计量数据,以±s表示,多组间比较采用单因素方差分析。若满足方差齐性,两组间多重比较采用Bonferroni法;若方差不齐,采用Tamhane T2法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 未造模大鼠一般情况良好;造模大鼠活动减少,精神欠佳,毛发干枯易脱落,缺少光泽,出现2型糖尿病典型的多食、多饮、多尿症状,体重减少;治疗组大鼠上述症状有所好转。
2.2 各组大鼠血清FBG、FINS水平和HOMA-IR比较 与空白对照组比较,模型组和治疗组血清FBG、FINS水平和HOMA-IR均升高(P<0.05,P<0.01);APS对照组FBG、FINS水平和HOMA-IR差异无统计学意义(P>0.05)。与模型组比较,治疗组血清FBG、FINS水平和HOMA-IR降低(P<0.05)。 见表3。
表3 各组大鼠FBG、FINS及HOMA-IR比较(±s)Tab.3 Comparison of FBG,FINS and HOMA-IR in each group(±s)

表3 各组大鼠FBG、FINS及HOMA-IR比较(±s)Tab.3 Comparison of FBG,FINS and HOMA-IR in each group(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05Note:Compared with blank control group,*P<0.05,**P<0.01;compared with model group,#P<0.05
组别 n FBG(mmol·L-1) FINS(mU·mL-1) HOMA-IR空白对照组 10 5.82±0.97 12.91±1.40 3.31±0.46 APS 对照组 10 5.38±1.05 12.87±1.12 3.05±0.43模型组 10 26.60±3.10* 22.62±2.53* 26.93±5.58**治疗组 10 21.80±3.30*# 19.05±2.76*# 18.57±4.38**#
2.3 各组大鼠TC、TG、LDL-C、HDL-C水平比较 与空白对照组比较,模型组和治疗组TC、TG、LDL-C水平升高(P<0.01),HDL-C水平降低(P<0.01);APS对照组TC、TG、LDL-C、HDL-C水平差异无统计学意义(P>0.05)。 与模型组比较,治疗组TC、TG、LDL-C水平下降(P<0.05),HDL-C水平差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠TC、TG、LDL-C、HDL-C水平比较(±s,mmol·L-1)Tab.4 Comparison of levels of TC,TG,LDL-C and HDL-C in each group(±s,mmol·L-1)
表4 各组大鼠TC、TG、LDL-C、HDL-C水平比较(±s,mmol·L-1)Tab.4 Comparison of levels of TC,TG,LDL-C and HDL-C in each group(±s,mmol·L-1)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05Note:Compared with blank control group,**P<0.01;compared with model group,#P<0.05
组别 n TC TG HDL-C LDL-C空白对照组 10 1.99±0.55 0.48±0.11 1.10±0.10 0.25±0.08 APS 对照组 10 1.84±0.59 0.48±0.17 1.15±0.11 0.27±0.09模型组 10 5.68±0.61** 1.05±0.21** 0.64±0.16** 0.58±0.14**治疗组 10 4.77±1.05**# 0.84±0.15**# 0.77±0.09** 0.43±0.12**#
2.4 各组大鼠胸主动脉病理形态学比较 空白对照组和APS对照组胸主动脉组织管腔结构完整,内皮光滑,无明显增生,平滑肌细胞排列规则,无钙化和泡沫细胞生成。模型组主动脉内膜不规则增厚,向管腔内凸起形成斑块,并伴有泡沫细胞、炎性细胞浸润,中膜钙化,平滑肌细胞排列紊乱。治疗组内膜仍有大量泡沫细胞沉积,内膜局部增厚形成粥样斑块,细胞增生广泛明显,排列不规则,但病变程度较模型组轻。见图1。
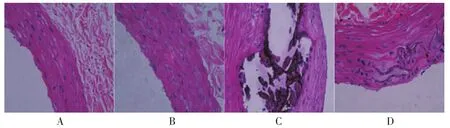
图1 各组大鼠胸主动脉病理形态学比较(HE染色,400×)Fig.1 Comparison of pathomorphology of thoracic aorta in each group(HE staining,400×)
2.5 各组大鼠胸主动脉组织eNOS、NOX4、AMPK mRNA表达水平比较 治疗8周后,与空白对照组比较,模型组和治疗组胸主动脉组织中eNOS mRNA和AMPK mRNA表达水平下降,NOX4 mRNA表达水平升高,差异有统计学意义(P<0.01);APS对照组eNOS、NOX4、AMPK mRNA表达水平差异无统计学意义(P>0.05)。与模型组比较,治疗组eNOS mRNA和AMPK mRNA表达水平升高,NOX4 mRNA表达下降,差异有统计学意义(P<0.05)。 见图2。

图2 各组大鼠胸主动脉组织中eNOS、NOX4、AMPK mRNA表达比较Fig.2 Comparison of the mRNA expression of eNOS,NOX4 and AMPK of thoracic aorta tissue in each group
3 讨论
目前认为,AS是一种血管炎性疾病,其特征在于脂质积累、炎性细胞积聚、血管平滑肌细胞在内膜层迁移和增殖导致的血管腔狭窄,以及脂质过氧化、内皮功能障碍、活化的巨噬细胞释放的炎症介质等因素激活血小板,使其黏附、聚集[21],其中血管内皮细胞的活化和功能障碍是形成AS的关键步骤[22]。研究证实,内皮eNOS功能受损引起的NO生成减少是内皮功能障碍的一个重要标志[23]。
NOX介导的ROS生成是引起血管功能障碍的重要因素[24]。NOX4作为NOX家族的一种亚型,主要在内皮细胞上表达,其主要作用是诱导ROS产生,而ROS的产生会影响eNOS活性,引起NO释放减少。AMPK是一种广泛表达于血管内皮细胞的能量传感器,通过AMPK/蛋白激酶B(protein kinase B,PKB/AKT)/eNOS信号通路提高NO水平,以维持血管内皮细胞功能[25-26]。
黄芪是历史悠久的传统药材,具有补气升阳、固表止汗、托毒排脓、敛疮生肌等作用,临床上常用黄芪治疗气虚乏力、脱肛、子宫脱垂、痈疽、慢性肾炎、糖尿病等病症。APS是从黄芪中提取的主要活性成分之一,研究发现APS可以通过激活AMPK,从而改善糖尿病大鼠的高血糖状态、肝糖原合成和骨骼肌葡萄糖转运[27]。
本研究采用高脂饮食联合STZ腹腔注射+VitD3灌胃+免疫损伤法建立糖尿病AS模型,观察APS对糖脂代谢、胰岛素抵抗和AMPK、eNOS及NOX4 mRNA表达的影响,从而进一步验证APS能否通过AMPK信号通路,调节eNOS与NOX4的活性,从而影响NO生成。
本研究结果显示,经APS干预的治疗组大鼠血糖、血脂水平下降、胰岛素抵抗情况改善,AMPK、eNOS mRNA表达上升,NOX4 mRNA表达下降,HE染色显示大鼠胸主动脉的病变程度较模型组明显改善。这些均提示APS可以改善糖尿病AS大鼠的高血糖和高血脂状态,促进胰岛功能恢复,增加胰岛素敏感性以减轻胰岛素抵抗;同时能够激活AMPK信号通路,升高eNOS活性,抑制NOX4活性。升高eNOS活性、抑制NOX4活性可以确保内皮细胞生成足够的NO,从而减轻NO依赖的血管内皮功能损害,起到延缓AS发展的作用。本研究还设置了APS对照组,与空白对照组比较发现,两组大鼠血糖、血脂差异无统计学意义,而且NOX4、eNOS、AMPK mRNA的表达水平差异无统计学意义。由此笔者推测,APS可能对健康大鼠无明显影响,仅对患病大鼠AMPK相关信号通路有着比较明显的作用。
综上所述,本研究提示APS能有效改善大鼠的糖尿病和AS状态,调节血糖血脂水平,保护血管内皮功能,抑制粥样斑块形成,这可能与激活AMPK相关信号通路、活化eNOS、抑制NOX4表达有关,但APS对健康大鼠无明显影响。

