涎腺腺样囊性癌40例临床病理特征及预后分析
邱明珠,徐宝卿,汤晓晖,郑智勇,谢艳梅,余英豪,曲利娟
涎腺腺样囊性癌(salivary adenoid cystic carcinoma, SACC)是头颈部少见的肿瘤,但却是口腔颌面部常见的恶性肿瘤之一。组织形态学上,SACC主要依靠其无包膜、浸润性生长、双向分化、筛管状结构、腔内分泌物及易出现神经侵犯等特征与其他类似的涎腺肿瘤鉴别。SACC除以上病理特征外,还常出现肿瘤周围收缩裂隙(peritumoral retraction cleft, PRC),这种病理学特点在涎腺肿瘤中尚未见报道。近年来PRC在其他肿瘤中报道较多[1-3],如前列腺癌、皮肤基底细胞癌及乳腺癌等,目前多数研究认为PRC是一些肿瘤的病理形态标志,并与预后不良相关。SACC局部侵袭性强,易沿神经扩散,又因邻近重要组织结构等特点,通常无法根治性切除,文献报道SACC术后5年生存率为68%~78%,10年生存率为40%~47%[4-5]。SACC预后因素是近年的研究热点,Sarah等[4]研究认为,年龄≥65岁与高组织学分级是SACC的独立危险因素;孙玉满等[6-7]研究发现,SACC肿瘤组织中EGFR、Cdc2及Survivin等高表达与其预后相关。本实验旨在总结SACC的临床病理学特征,并分析其与预后的关系。
1 材料与方法
1.1 材料收集2008~2019年福建医科大学附属龙岩第一医院诊治的40例SACC,临床资料均完整,包括患者性别、年龄、部位、肿物大小、手术时间及治疗方式等;病理资料包括有无包膜、周围组织侵犯情况、组织学分级、PRC及其所占比例,有无坏死、脉管内癌栓、神经侵犯、淋巴结转移及免疫组化切片等。
1.2 方法手术切除标本均经10%中性福尔马林固定,石蜡包埋,3 μm厚连续切片,HE染色,免疫组化染色采用EnVision两步法,一抗包括Ki-67、CK19、CD117、p63、SMA、S-100、LEF-1、β-catenin及D2-40等,均购自福州迈新公司,均设阴、阳性对照。另外,选取2016~2019年诊治的14例SACC,FISH法检测MYB-NFIB融合基因,MYB/NFIB融合基因t(6;9)探针购自广州安必平公司。
1.3 诊断标准切片均由两名高年资病理医师独立复核诊断,根据WHO(2017)涎腺肿瘤分类的诊断标准以及相关文献,剔除5例具有筛状结构的涎腺基底细胞腺瘤(cribriform type of salivary basal cell adenoma, cSBCA)(原误诊病例)[8],其余40例SACC复核诊断成立纳入本组实验。参照Szanto等制定的标准,将SACC组织学分级分为3级。1级:肿瘤呈筛孔状和管状结构,无实体型成分;2级:单纯筛孔状型,或混有<30%的实体型区域;3级:实体型成分≥30%。
1.4 判读标准
1.4.1免疫组化 免疫组化阳性定义为胞质、胞膜或胞核呈黄色或棕色颗粒。采用阳性细胞数占肿瘤细胞总数的百分比作为评分结果:阳性细胞数≤1%为0分,2%~25%为1分,26%~75%为2分,>75%为3分;同时评估阳性细胞染色的强弱:无阳性细胞为0分,黄色为1分,棕黄色为2分,棕褐色为3分;两项得分结果的乘积即为免疫组化总评分。评分<1分为阴性,≥1分为阳性,其中1~3分为弱阳性,4~6分为中等阳性,7~9分为强阳性。
1.4.2FISH 荧光显微镜下观察细胞核内出现黄色信号(红、绿色融合)即为基因融合信号。每例观察100个细胞核,出现黄色融合信号的细胞核数占观察细胞核总数的15%以上为融合基因阳性。
1.5 随访通过门诊、电话等方式进行追踪随访,记录患者术后症状、复发或转移等情况。手术日期以生存期为起点,随访时间按月记录,以2020年1月13日为截至日期,死亡为随访终点。
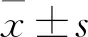
2 结果
2.1 临床特点40例SACC中男性21例,女性19例,年龄28~82岁,平均(53.4±13.6)岁。62.50%的肿瘤发生于小涎腺,小涎腺中腭部12例,鼻咽部11例,颊黏膜2例;大涎腺中腮腺8例、舌下腺5例、颌下腺2例。肿物最大径0.8~4.5 cm,平均2.4 cm。影像学多考虑为良性病变。
2.2 病理检查眼观:40例SACC切面呈灰褐色,质地中等,界欠清。镜检:SACC无包膜,部分区浸润周围宿主组织;肿瘤细胞呈双向分化,腺上皮和变异的肌上皮细胞构成真、假腺腔;真性管腔内层由腺上皮构成,细胞核圆形或卵圆形,外层为胞质稀少或透明的多角形肌上皮细胞,可构成微囊/筛状结构,腔内可见红染玻璃样物(图1);假性腺腔由肌上皮细胞围绕,腔内常见嗜碱性黏液样物(图2);不同的结构模式常混杂存在,而肿瘤细胞相对一致,间质常见硬化或玻璃样变。组织学分级:1级13例,2级17例和3级10例。13例(32.5%)镜下见肿瘤性坏死,12例(30.0%)见神经侵犯,个别病例可见脉管内癌栓(7.5%)及淋巴结转移(5.0%)。另外,36例(90%)SACC镜下可见PRC(图3、4),出现PRC的比例中位数为40%,四分位间距(30%,60%)。

①②③④⑤⑥
2.3 免疫表型Ki-67增殖指数中位数为15%,四分位间距(10%,25%),几乎所有的SACC腺上皮细胞CK19及CD117阳性;肌上皮细胞p63及SMA阳性,灶区S-100蛋白阳性。大部分病例(97.5%)间质细胞S-100蛋白阴性。β-catenin及LEF-1标记所有SACC肿瘤细胞核均阴性,而β-catenin胞膜及胞质可阳性。另外,D2-40标记显示PRC并非脉管内瘤栓(图5)。
2.4 分子遗传学FISH检测14例SACC中8例(57.1%)为MYB-NFIB融合基因阳性(图6)。
2.5 生存分析40例SACC中1例失访,其余39例随访3~114个月,其中肺转移9例(其中3例同时伴肝转移)、骨转移1例、脑转移1例及淋巴结转移2例;至随访截止时间20例因瘤死亡,5例带瘤生存(出现复发或转移),14例无瘤生存。39例SACC术后生存的中位时间为78个月,95%CI=70.85~85.15,5年生存率为77.8%,8年生存率为26.4%,10年生存率为0(图7)。其术后无瘤生存中位时间为51个月,95%CI=29.82~72.18,术后2、5、8年无瘤生存率分别为78.5%、40.8%及0(图8)。另外,术后口干与手术切口流液的发生率分别为7.69%与2.56%。

图8 Kaplan-Meier法分析涎腺腺样囊性癌患者术后无瘤生存率
2.6 预后分析单因素Cox生存分析显示,神经侵犯、PRC、Ki-67增殖指数>15%以及未根治性切除与生存期有相关性(P<0.05),患者性别、年龄、肿瘤大小、发生部位、组织学分级、坏死、脉管内癌栓、淋巴结转移及是否行放疗与SACC的生存状况无相关性(P>0.05,表1)。多因素Cox生存分析显示,独立影响SACC术后生存的变量为:Ki-67增殖指数>15%(HR=3.943,P=0.037)、PRC(HR=2.469,P=0.040)与未根治性切除(HR=2.526,P=0.043,表2)。
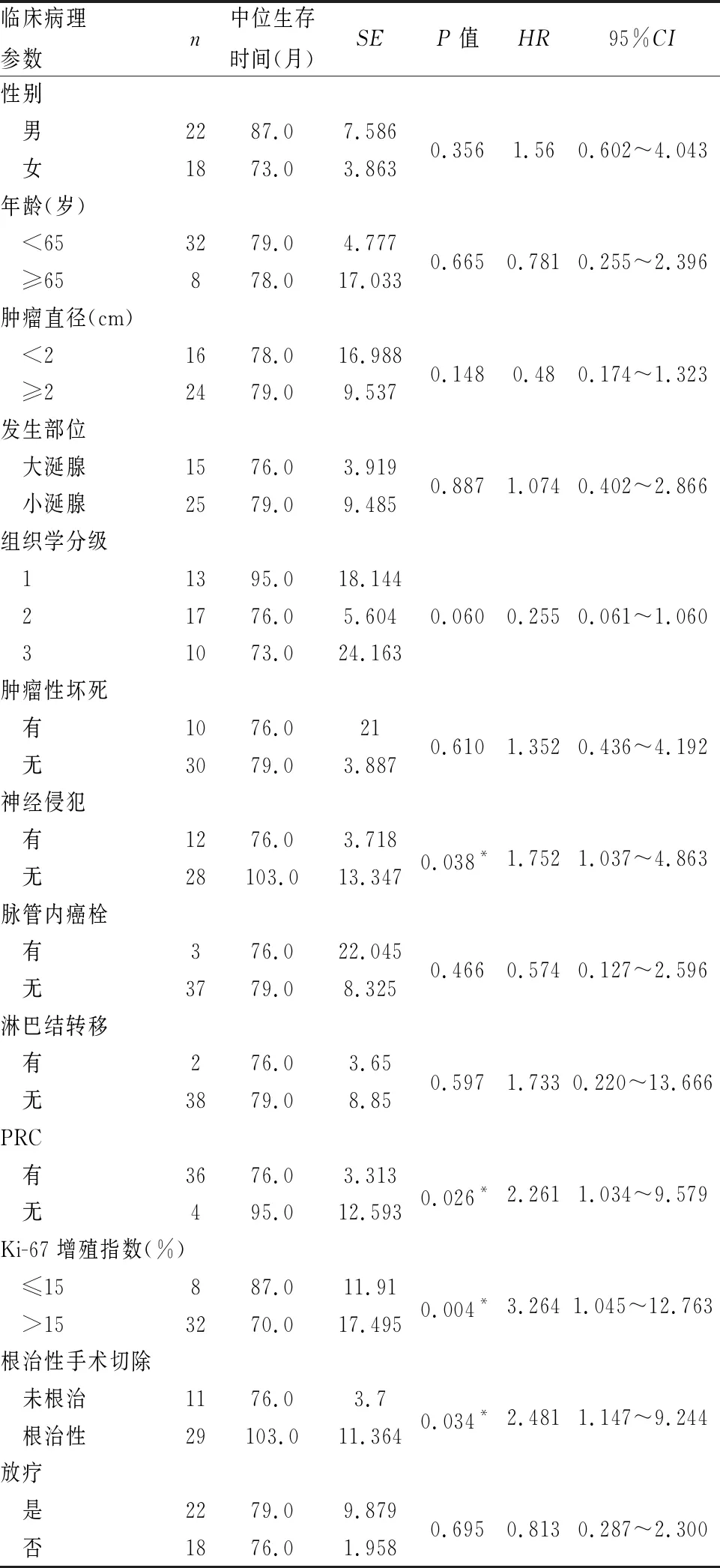
表1 涎腺腺样囊性癌患者单因素Cox生存分析

表2 涎腺腺样囊性癌患者术后多因素Cox生存分析
3 讨论
SACC居于口腔颌面部最常见恶性肿瘤中的第2位,最常发生于腭部及腮腺。该肿瘤发生的解剖部位、嗜神经及高血行性转移、低淋巴结转移等特性,决定了其高复发率与远期预后差等特点。
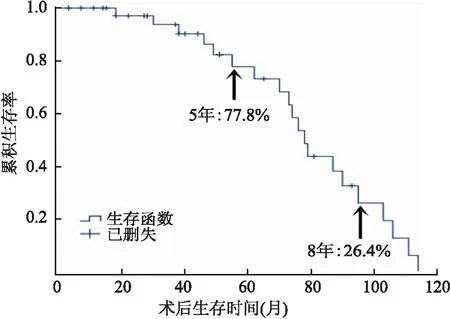
图7 Kaplan-Meier法分析涎腺腺样囊性癌患者术后生存率
3.1 病理学特征SACC无包膜,呈浸润性生长,具有双向分化特征,由腺上皮细胞和变异的肌上皮细胞组成,构成腺管状、微囊/筛状或实性结构,形成真、假腺腔,真性腺腔内衬腺上皮细胞,假性腺腔缘为肌上皮细胞,腔内可见红染玻璃样物或蓝染黏液物。不同模式的肿瘤细胞较一致,间质常硬化或玻璃样变。本组90%的SACC镜下可见PRC,而其他涎腺肿瘤包括基底细胞腺瘤(basal cell adenoma, BCA)、基底细胞腺癌(basal cell adenocarcinoma, BCAC)均未发现此现象,作者认为可将PRC作为SACC的病理诊断参数。关于PRC形成的机制,目前尚未明确。一些研究认为,PRC可能与肿瘤-间质相互作用有关;另一些研究认为,PRC的形成可能与层粘连蛋白(laminin, LN)的缺失以及肿瘤中MMP-2、MMP-9、IGF-1和FGF-2等升高有关。
免疫表型:CD117、CK19显示SACC腺上皮成分,p63及SMA标记其肌上皮成分,Ki-67、S-100、β-catenin及LEF-1等有助于鉴别诊断;另外,有文献报道[9-10]SACC中BCL-2、HIF-1α、EGFR、Cdc2及Survivin等的表达与预后相关。分子遗传学方面,多项研究支持SACC的发生与MYB-NFIB融合基因相关,多数SACC中存在MYB mRNA的过表达以及MYB蛋白的高表达[11]。
3.2 鉴别诊断与SACC病理形态学相似的肿瘤有:cSBCA、BCAC、上皮-肌上皮癌(epithelial-myoepithelial carcinoma, EMC)及多形性腺癌(polymorphous adenocarcinoma, PAC)等。SACC与cSBCA形态极为相似,易误诊,但SACC无包膜,cSBCA常见包膜并且大部分瘤巢的长轴与包膜呈平行关系,是其主要的形态学鉴别点[8]。BCAC与实性型SACC相似,但BCAC肿瘤细胞异型性较明显,核分裂象多见,实性型SACC常伴筛状或管状结构,腔内见分泌物,有助于鉴别。EMC与管状型SACC相似度高,均具有双向分化特征,但EMC肌上皮细胞常较大、胞质透亮,且瘤巢周围有基膜环绕,有助于与SACC的鉴别。PAC组织结构多形性,也可出现肿瘤性腺上皮及肌上皮,与SACC相似,但PAC可形成小叶状结构、乳头状囊腺结构及单一细胞条索的同心圆样排列,有助于与SACC鉴别。
3.3 治疗目前研究认为,SACC几乎不可治愈,治疗SACC的主要目标可能是长期带瘤生存。手术完整切除是治疗SACC的首选方案。Ishida等[12]认为,局限转移灶的切除及重复手术切除也可延长生存期。目前,是否行根治性淋巴结清扫存在争议,多数研究认为,接受淋巴结清扫术的患者并无明显的生存优势,而对生存质量有一定的影响,因此临床上大多数病例未采用,本组仅5例采用淋巴结清扫术。有学者认为术后辅助放疗能够降低肿瘤复发率和转移率,提高生存率。多数研究表明,化疗并非常规方案,但对于远处转移、复发或不宜手术的晚期患者,放疗结合适当的化疗对于肿瘤的控制有一定效果。
随着对SACC遗传学研究的深入,靶向治疗备受关注。伊马替尼有个别治疗成功案例,西妥昔单抗及来伐替尼有助于对肿瘤的控制[13],晚期也可以选择针对前列腺特异性膜抗原(prostate specific membrane antigen, PSMA)的靶向治疗[14]。全基因组测序聚类分析的染色体畸变以及差异表达基因(differentially expressed genes, DEGs)的发现,成为寻找SACC治疗靶点的重点[15-16]。关于SACC肿瘤细胞增殖、迁移和侵袭能力等研究[17],对治疗新靶点的选择提供了方向,而CDK抑制剂与一线化疗药物联合应用可能是治疗SACC有前途的策略。SACC肿瘤微环境及肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)参与的抗肿瘤免疫成为新的治疗方向[18],以及Fas/Fas配体可考虑用于治疗干预[19]。
3.4 预后本组SACC患者多在术后3~5年发生复发或转移,5年生存率与文献报道基本一致,10年生存率低于其他报道,原因可能是本组半数病例术后未行放、化疗,且本组样本量较小,对结果可能有的影响;另外,既往报道中半数以上的cSBCA被误诊为SACC[20],其他关于SACC生存分析的病例也可能存在误诊,使其生存率偏高。本组多因素Cox生存分析显示,Ki-67增殖指数>15%、PRC与未根治性切除为SACC独立危险因素;组织学分级、年龄≥65岁等与SACC的生存状况无相关性,结果可能与纳入本实验的样本量小有关。一些研究认为,肿瘤组织EGFR、Cdc2及Survivin等阳性是SACC独立的危险因素[6-7,9-10],而溶酶体相关4次跨膜蛋白B(lysosome-associated protein transmembrane-4 beta, LAPTM4B)-35蛋白高表达与临床分期晚及组织分级高相关。Sarah等[4]研究认为,年龄及体重指数(body mass index, BMI)与无进展生存率(event-free survival, EFS)相关。另外一些研究认为,激肽释放酶相关肽酶(kallikrein-related peptidases, KLKs)的下调为SACC提供预后信息[21];p53突变及共济失调毛细血管扩张突变(ataxia telangectasia mutated, ATM)蛋白的低表达提示SACC不良预后[22]。
总之,SACC的确诊需要多病理参数综合判断,PRC见于90%的SACC,可将其作为病理诊断参数。多因素Cox生存分析显示,Ki-67增殖指数>15%、PRC与未根治性切除为SACC的独立危险因素,为预后提供信息。

