一种沉降式液基系统制片中加热而不影响细胞形态的方法
宋以菊,任 翡,吴佳文,杨文韬,曾 欢,陈 颖,平 波
液基细胞制片技术(liquid-based cytology technology, LBC)指细胞学标本收集至细胞保存液内,经过处理减少标本中影响诊断的成分(黏液、血液、炎性渗出物等)后制成薄层细胞片,染色,由细胞病理学医师通过对分布于较小区域内细胞的识别最后作出细胞学诊断。因其操作简单,制片背景干净,细胞均匀平铺,染色质量稳定,阅片强度降低等优势被广泛应用于子宫颈细胞学及胸腹水、痰、尿、肺泡灌洗液等非妇科细胞学领域[1-4]。沉降式是LBC的主要代表之一,在沉降式LBC制片系统制片的上机过程中,细胞样本的抽吸、转移和染色等过程中均有可能形成气溶胶[5-6],若其中含有致病病原微生物,则易造成环境污染,并可能感染工作人员。加热是一种常见的灭活病原微生物的方法,例如通过呼吸系统传播的SARS-CoV、MERS-CoV、SARS-CoV-2等冠状病毒,对热敏感,56 ℃ 30 min可有效灭活。然而LBC制片过程中是否可增加加热环节,并避免加热对细胞形态造成的改变,尚未见文献报道。本科室尝试了将标本经细胞保存液固定,加入Tris缓冲液后置于60 ℃下加热30 min再行沉降式LBC制片的方法,并检验此加热方法对细胞形态和染色有无影响。
1 材料与方法
1.1 标本来源收集2020年3~5月复旦大学附属肿瘤医院病理科细胞室诊断后剩余的非妇科标本(胸腹水和甲状腺细针穿刺)和子宫颈脱落细胞标本。
1.2 实验试剂及仪器沉降式LBC制片系统,程控离心机,漩涡振荡器。LBC细胞保存液,苏木精,细胞沉降管,移液吸头,12 mL离心管和专用载玻片等。Tris缓冲液(pH 8.0)、伊红、无水乙醇、二甲苯、中性树胶、50 mL离心管、盖玻片等。
1.3 沉降式LBC制片系统自动制片前标本处理(图1)。
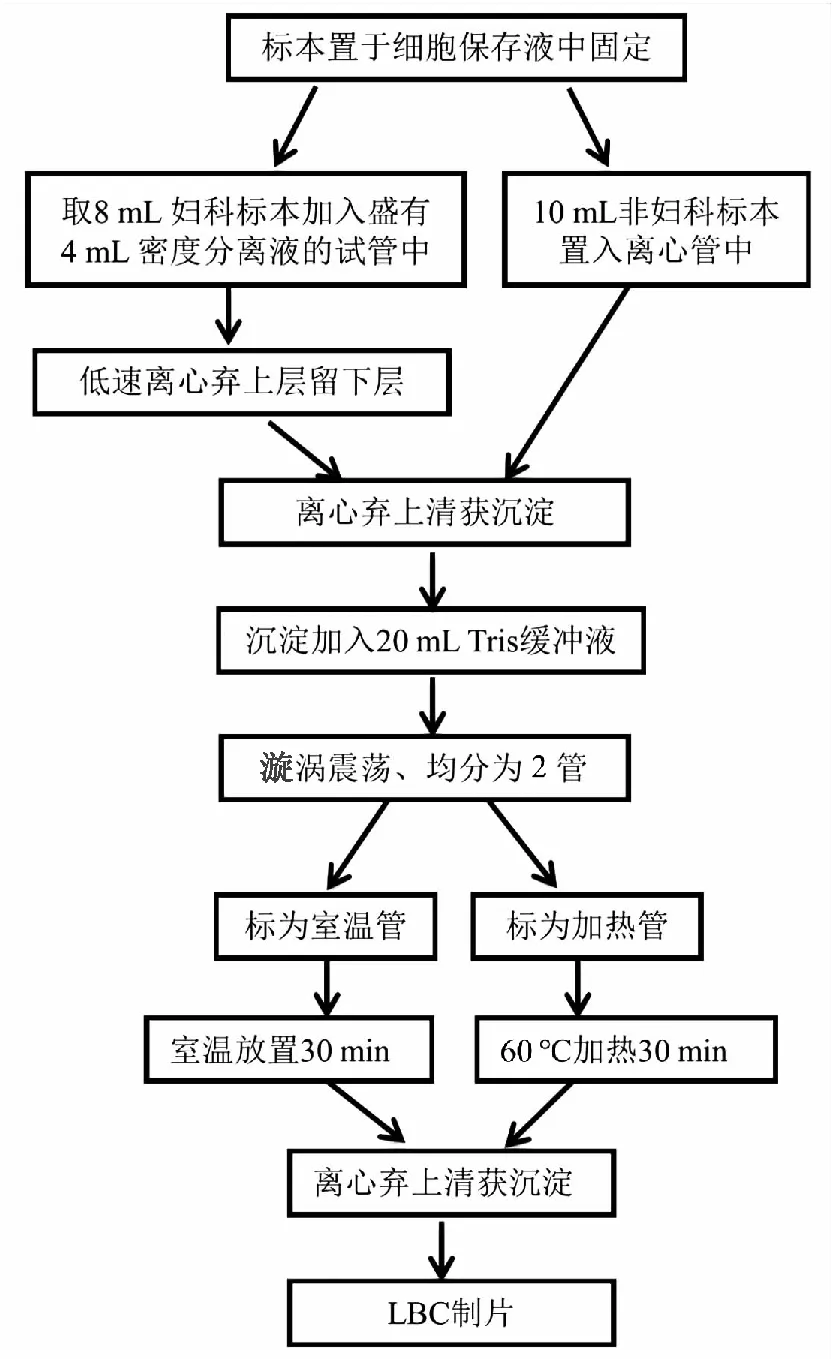
图1 LBC制片流程图
1.3.1加热前标本处理 非妇科标本:在生物安全柜中,将胸腹水45 mL置于50 mL离心管中,2 000 r/min离心10 min,将上清倒入安全柜中放有含氯消毒片的废液桶中。向离心管中加入10 mL LBC细胞保存液,漩涡震荡后静置于生物安全柜中。甲状腺细针穿刺标本送至细胞室时已通过针头洗涤转移至细胞保存液中。标本在细胞保存液中至少30 min,2 000 r/min离心10 min,弃上清留沉淀。沉淀中加入20 mL Tris缓冲液,漩涡震荡重悬,均分为2份,每份10 mL于50 mL离心管中,分别标记为加热管和室温管。
子宫颈脱落细胞标本:从细胞保存瓶中转移8 mL标本至含有4 mL标本密度分离液的12 mL离心管中,1 200 r/min离心2.5 min吸去离心管上层的血液和黏液等,将下层转移至50 mL离心管,2 000 r/min离心10 min,弃上清留沉淀。沉淀中加入20 mL Tris缓冲液,漩涡震荡重悬,均分为2份,每份10 mL于50 mL离心管中,分别标记为加热管和室温管。
1.3.2加热处理 将加热试管转移至60 ℃烘箱中加热30 min,漩涡震荡重悬后,转移至12 mL离心管,2 000 r/min离心10 min,弃上清取沉淀。
1.3.3室温对照处理 室温管置于生物安全柜内,室温放置30 min,漩涡震荡重悬后,转移至12 mL离心管,2 000 r/min离心10 min,弃上清取沉淀。
1.4 沉降式LBC制片系统自动制片取沉淀行沉降式LBC制片系统自动制片,非妇科标本行HE染色,子宫颈标本行巴氏染色,染色完毕后,无水乙醇清洗2次,二甲苯透明,自动封片机封片。
1.5 制片质量评价由两名高年资医师及两名高年资技术员镜下共同观察,共同评价液基细胞学涂片的色彩(细胞核与细胞质颜色对比及光学透明度)、细胞形状、细胞质及细胞核变化。观察细胞类型:间皮细胞、组织细胞、淋巴细胞、中性粒细胞、腺癌细胞、甲状腺乳头状癌细胞以及正常子宫颈细胞。
2 结果
将加热组与对照组的染色效果及细胞形态进行对比,发现加热组与对照组制片的染色效果和细胞形态无区别。镜下观察非妇科标本,HE染色红蓝分明,细胞核与细胞质对比明显,透明度好。两组细胞边界特征均能清楚显现,如间皮细胞均可见“围裙”样表现及“开窗”现象(图2A、B)。对于细胞质丰富的细胞可见清晰的胞质细节,如组织细胞胞质内可见空泡(图2C、D)。细胞核细节展示清晰,如淋巴细胞的核膜可见小凹陷,中性粒细胞核分叶明显(图2E、F),腺癌细胞核异型明显,染色质粗糙,可找及清晰的核分裂象(图2G、H),甲状腺乳头状癌细胞显示细胞核膜不规则,核沟及核内包涵体均清晰可见(图2I、J)。因此,加热组在HE染色中无论是细胞形态、细胞质细节和细胞核细节均与对照组无差异。
妇科标本行巴氏染色,对照组和加热组的鳞状上皮和腺上皮细胞形态无明显差异,细胞平展,中间层细胞胞质呈浅蓝色,细胞核呈深蓝色,染色质细腻(图2K、L),表层细胞胞质呈粉红色,细胞核固缩,细胞核呈紫色(图2M、N),颈管腺细胞边界清晰,细胞核细腻可见小核仁(图2O、P)。因此,加热组对巴氏染色的妇科标本在颜色的分色、细胞核的细节、细胞边界等特征均无改变,不会对诊断造成影响。
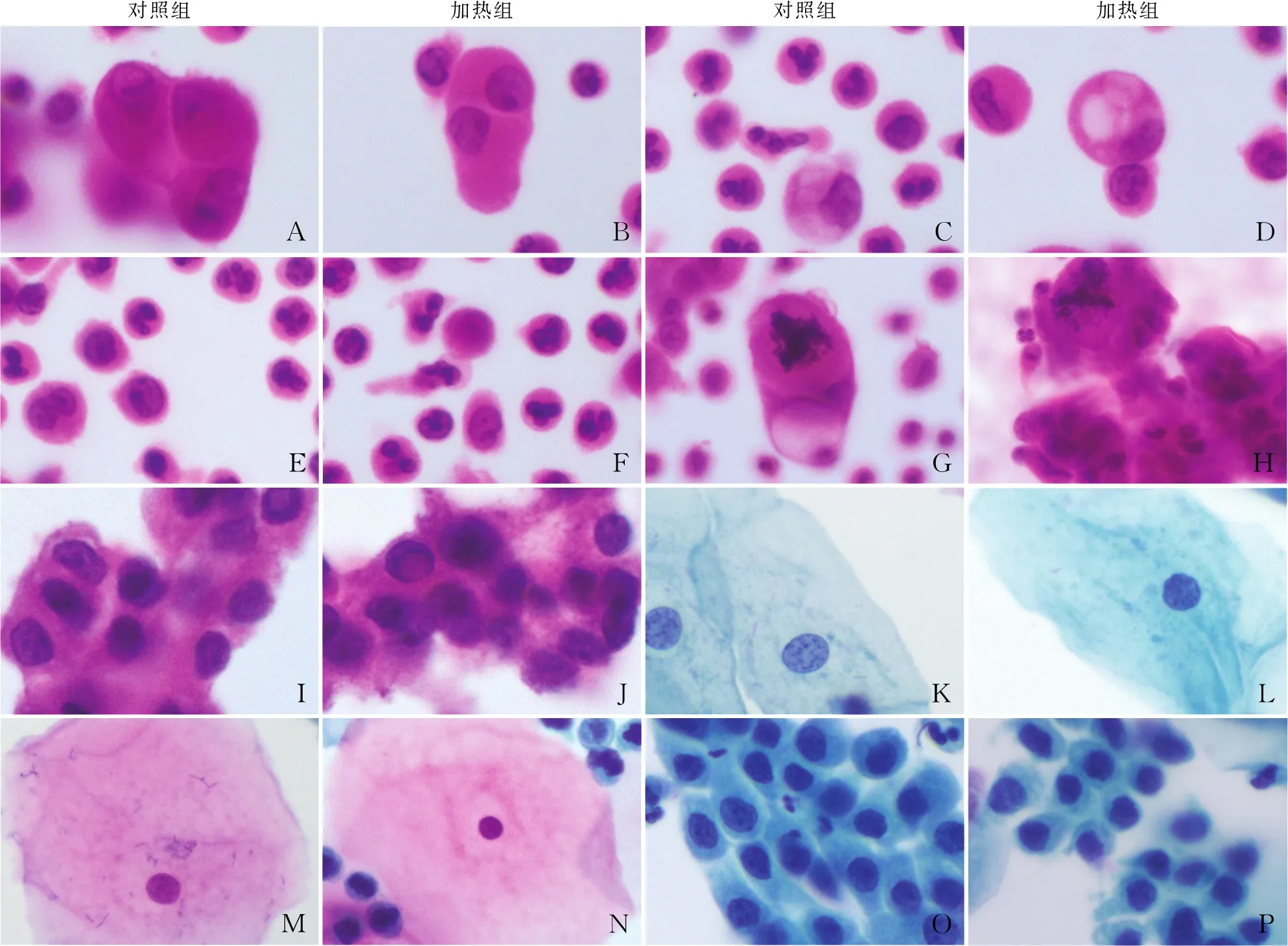
对照组加热组对照组加热组ABCDEFGHIJKLMNOP
3 讨论
在LBC说明书内,厂商通常会明确写出经检测细胞保存液可灭活的病原微生物,如常见的大肠杆菌、绿脓杆菌、金黄色葡萄球菌、白色念珠菌、结核杆菌和黑曲霉等,对于未经检测的其它致病因子无法保证全部灭活,故操作说明要求操作者将标本视为有生物危害性,在整个操作过程中做好严格的防护措施。沉降式LBC制片设备尺寸较大,常常受环境限制,难以放入生物安全柜等密闭空间进行操作,因此寻找一种在上机前,既可以预防样本中可能存在的传染因子传染又不影响制片质量的方法非常重要。
上机前可能进行加热的环节包括将含有标本的细胞保存液加热及缓冲液加热。沉降式LBC细胞保存液可以对细胞学标本起固定作用,经固定后的细胞形态具有一定的稳定性,不易改变。细胞保存液中含有醇类成分,且通常说明书建议使用温度不得超过30 ℃,因此不能将细胞保存液进行加热。Tris缓冲液为一种弱碱性缓冲液,在沉降式LBC制片系统制片过程中起到上机前标本的清洗和染色过程中为细胞核染色提供弱碱性环境的作用。温度会对Tris缓冲液的pH值有一定影响,在上机前清洗这一步加热,后续离心后弃上清,加入新的缓冲液混匀转移样本,这段时间足以让样本恢复至室温,故不会影响后续的染色过程。本组实验通过比较加热组与对照组的制片发现,加入Tris缓冲液后60 ℃加热30 min,对细胞形态和染色无影响。
在沉降式LBC制片系统制片过程中,本实验方法仅对加热后样本中的热敏感性病毒起灭活作用,但是在此之前的细胞学操作包括转移分装样本,离心、漩涡震荡、倾倒上清、加细胞固定液等过程也都有可能形成气溶胶,仍要采取严格的防护措施,如在生物安全柜内操作,佩戴N95口罩、护目镜,戴防护面具,穿防护服等[5-6]。

