线粒体脑肌病伴高乳酸血症和卒中样发作综合征的分子生物学特征
吴世陶 刘 方 石伟伟 张 敏 李建章 刘恒方△
1)郑州大学第五附属医院,河南 郑州 450052 2)郑州大学第二附属医院,河南 郑州 450003
线粒体脑肌病伴高乳酸血症和卒中样发作(mi⁃tochondrial encephalomyopathy with lactic acidosis and stroke-like episodes,MELAS)是由于线粒体DNA(mtDNA)或核DNA(nDNA)突变、导致线粒体的结构和功能异常、细胞供能不足引起的一组临床综合征[1]。MELAS综合征发病年龄早、临床表现复杂、诊断困难,肌肉病理对其诊断具有重要价值,但其为有创性检查,且儿童患者配合不佳,有一定的局限性。现在已经进入精准医学时代,基因检测是诊断MELAS综合征的金标准,且是一种无创、准确的方法[2]。ME⁃LAS综合征约95%为mtDNA突变,5%为nDNA突变,国外研究发现与MELAS综合征相关的mtDNA突变有40多种,约80%为3243 A>G突变,其他突变位点有3271 T>C、1642 G>A、3252 A>G、3260 A>G、3291 T>C、8344 A>G、8993 T>G、9176 T>C和13513 G>A等[3-5]。目前,国外研究方向主要为寻找新的突变位点、分析基因突变的发病机制、研发新药及基因治疗等[6-7],这是一项长期工程、需要积累大量的MELAS综合征患者。相比之下,国内对MELAS综合征基因突变位点、流行病学、突变类型与表型的异质性等研究相对较少。本研究分析42例MELAS综合征患者及亲属的基因测序结果,分析MELAS综合征的热点突变、新发突变及不同组织的突变率等分子生物学特征。
1 资料与方法
1.1一般资料收集2011-01—2020-01郑州大学第五附属医院和郑州大学第一附属医院经肌肉病理和基因测序同时确诊的42例MELAS综合征患者及亲属的临床表现、影像学、肌肉病理和基因测序等资料,其中男22例,女20例,年龄4~42岁,病程2个月~11 a。本研究获得郑州大学第五附属医院伦理委员会的批准,且患者或家属签署知情同意书。
1.2肌肉病理患者或监护人签署知情同意书,局麻下获得骨骼肌标本,根据病情取材部位为肱二头肌或腓肠肌。新鲜标本分两部分,一部分行肌肉组织病理染色,另一部分行电镜检查。新鲜肌肉标本经液氮冷却的异戊烷迅速冷冻,80℃保存,染色时制成8μm冷冻切片,进行苏木精-伊红(HE)、改良Gomori(MGT)、琥珀酸脱氢酶(SDH)、还原型辅酶Ⅰ四氮唑还原酶(NADH)、细胞色素C氧化酶(COX)、过碘酸雪夫氏(PAS)和油红O(ORO)染色,显微镜200倍下进行病理分析。
1.3基因测序对42例MELAS综合征患者及亲属的外周血和新鲜尿液同时进行基因测序,送至武汉康圣环球医学检验所有限公司进行PCR扩增、电泳后产生清晰可见、大小符合预期的条带,首先采用Sanger法对3243 A>G、3252 A>G、3271 T>C和13513 G>A常见突变位点进行测序。如果常见突变位点阴性时,应用二代测序检测线粒体DNA全长,对于明确的致病突变,采用Sanger测序进行验证。
1.4统计学分析采用SPSS 23.0统计学软件进行分析,采用秩和检验比较血液和尿液中线粒体DNA的突变率。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1肌肉病理42例患者改良Gomori染色可见较多破碎红纤维,见图1。

图1 肌肉病理(×200)Figure 1 Muscle pathology(×200)
2.2基因测序42例MELAS综合征患者及亲属进行基因测序,42例患者均发现存在mtNDA突变。共发现30例患者存在3243 A>G突变,血液检出25例发生3243 A>G突变,突变率为22.15%~100%(35.82±11.26)%;尿液检出30例发生3243 A>G突变,突变率为38.46%~100%(63.57±20.85)%;发现3271 T>C突变3例,13513 G>A突变3例,1642 G>A、3093 C>G、3256 C>T、3302 A>G、3697 G>A和15242 G>A突变分别1例。20例患者的亲属存在相同的基因突变位点,其中17例患者的母亲、外婆、舅舅、兄弟姐妹或儿女存在相同的3243 A>G突变位点,3例患者的母亲分别存在相同的3271 T>C、3302 A>G、3697 G>A突变位点。患者1发生3243 A>G突变,外周血突变率为52.38%,尿液细胞突变率为100%;患者1的母亲发生3243 A>G突变,外周血突变率为9.11%,尿液细胞突变率为59.38%,母亲无临床症状,为携带者(图2)。患者15发生3093 C>G突变,外周血突变率为52.68%,尿液细胞突变率为100%(图3)。患者16发生13513 G>A突变,外周血突变率为77.61%;尿液细胞突变率为100%,为纯质性突变(图4);患者17出现3697 G>A突变,外周血和尿液细胞的突变率均为100%;母亲的尿液细胞存在相同的3697 G>A突变,突变率为21.15%,母亲没有临床症状,为携带者(图5);患者20发生3271 T>C突变,外周血突变率为69.84%;尿液细胞突变率为100%,为纯质性突变;患者20的母亲外周血未发生3271 T>C突变;尿液细胞发生3271 T>C突变,突变率为17.28%,有临床表现(图6);患者34发生15242 G>A突变,外周血突变率为42.75%;尿液细胞突变率为49.53%(图7)。所有患者的父亲均未发现基因突变。与外周血的线粒体DNA突变率相比,尿液细胞的突变率显著增高,差异有统计学意义(P<0.05)。

图2 患者1的基因测序结果Figure 2 The gene sequencing results of case 1
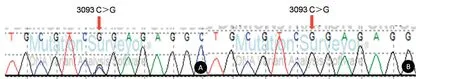
图3 患者15的基因测序结果Figure 3 The gene sequencing results of case 15

图4 患者16的基因测序结果Figure 4 The gene sequencing results of case 16
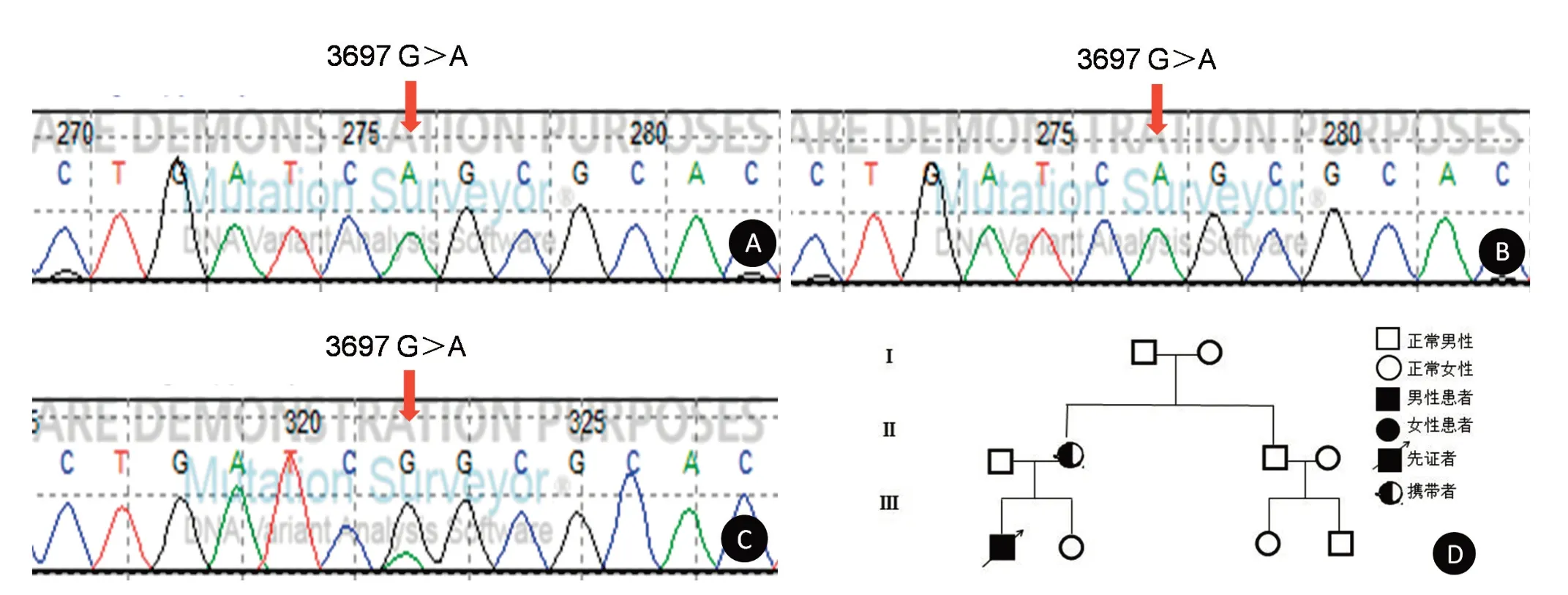
图5 患者17的基因测序结果Figure 5 The gene sequencing results of case 17
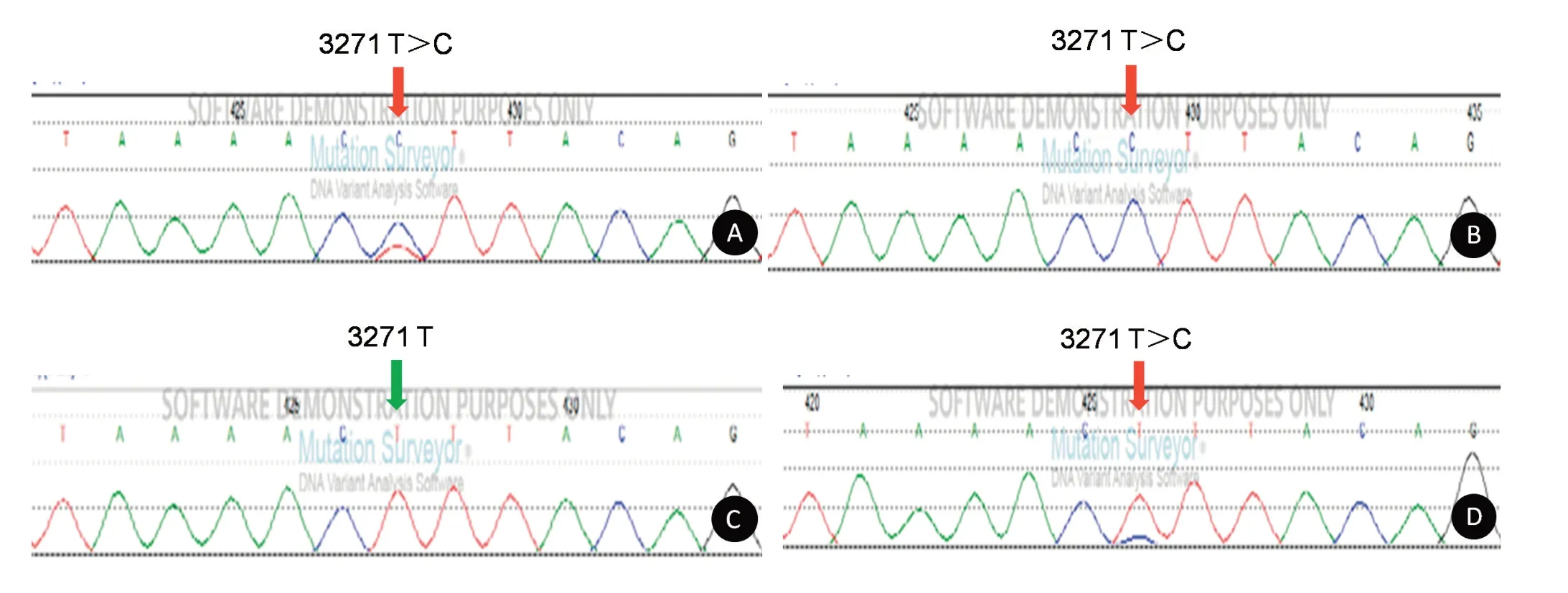
图6 患者20的基因测序结果Figure 6 The gene sequencing results of case 20

图7 患者34的基因测序结果Figure 7 The gene sequencing results of case 34
3 讨论
人类mtDNA全长16 569 bp,为双链闭式环状分子,其内环为轻链(L-strand),外环为重链(Hstrand),编码22个转运RNA(transfer RNA,tRNA)、2个核糖体RNA(ribosomal RNA,rRNA)(12S、16S)和13个蛋白质[8-9]。目前发现与MELAS综合征相关的mtDNA基因突变有40多个,分别位于MT CO3、MTNDl、MT-ND4、MT-ND5、MT-CYB和MT-NC6,还位于tRNA和rRNA区域的MT-TLl、MT-TL2、MT-TV、MT-TF、MT-RNR2、MT-TK、MT-TQ和MT-TH,其中文献报道最多的是MT-TLl基因[10-14]。人类的MTTLl基因全长为75 bp(np3230-np3304),编码tR⁃NALeu(UUR)基因,在线粒体内负责转运亮氨酸,tR⁃NALeu(UUR)基因含有78个碱基,能够识别UUA与UUG两个密码子[15-16]。目前报道有8个MT-TLl点突变与MELAS综合征相关,其中3243 A>G是最常见的突变位点[17]。EL-HATTAB等[18]报道约80%的MELAS综合征患者为3243 A>G突变。本研究中71.43%(30/42)的患者发生3243 A>G突变,稍低于上述报道,但与PICARD等[19]报道54.6%~72.3%的MELAS综合患者为3243 A>G突变基本一致。mtD⁃NA亮氨酸tRNA基因3243 A>G导致转录终止,影响了tRNA的甲基化、氨酰化及蛋白质合成,造成线粒体呼吸链酶复合物Ⅰ和Ⅳ的活性出现缺陷,氧化磷酸化障碍、能量供应不足,从而导致一系列的临床症状[20]。本组30例3243 A>G突变患者主要表现为卒中样发作、头痛、癫痫、智能减退、听力下降、精神异常、身材矮小、不耐受疲劳、视力下降和多毛等。
既往研究报道MELAS综合征患者约10%为3271 T>C突变,其他突变占10%[21]。本组仅3例3271 T>C,占7.14%(3/42),推测可能与人种有关,也可能与样本量较小有关。近年来国内外陆续报道了60余例13513 G>A突变导致的MELAS综合征[22-23]。本研究通过行mtDNA全长测序发现,7.14%的患者出现13513 G>A,是本组患者中第三大常见的突变位点,提示可以将13513 G>A作为MELAS综合征的热点突变进行筛查。13513 G>A位于还原型烟酰胺腺嘌呤二核苷酸脱氢酶(nicotinamide adenine dinucleo⁃tide,NADH)5基因上,是最常见的mt DNA ND5所编码的基因突变[24]。13513 G>A突变主要可引起ME⁃LAS综合征、Leigh综合征以及MELAS-Leigh叠加综合征,这些临床表型可能与年龄有一定的关系。13513 G>A突变引起的MELAS综合征常见于成年人,而其所致的Leigh综合征常见于婴幼儿,MELASLeigh叠加综合征较罕见。本研究中3例13513 G>A突变,发病年龄分别为26、19.5和23岁,与既往报道一致[25]。
本研究除发现国内外报道过的mtDNA 3243 A>G、13513 G>A、3302 A>G、1642 G>A、3271 T>C和3256 C>T突变位点以外[26],还发现了3093 C>G、3697 G>A和15242 G>A突变,这3个突变国外已经报道[27-29],而国内尚未见报道。患者15主要表现为头痛、癫痫、听力下降,发生3093 C>G突变,3093 C>G位于16S rRNA亚基,突变时将导致16S rRNA亚基的结构发生变化,造成线粒体氧化磷酸化障碍。患者17主要表现为卒中样发作、智能减退、视力下降,发生3697 G>A突变,其母亲存在相同的3697 G>A突变,但无临床表现。MT-NDl编码呼吸链复合物Ⅰ,该酶是线粒体内膜上完成电子传递过程的关键酶[30]。m3697位于MT-NDl区域,当正常的G碱基突变为A碱基时,导致第131位甘氨酸被错误地翻译成丝氨酸(p.Gly 131 Ser),改变了MT-ND1的空间结构,从而影响NADH脱氢酶的活性,造成ATP合成减少、细胞能量供应不足。患者34主要表现为智能减退、身材矮小、多毛、不耐受疲劳,发生15242 G>A突变,m15242位于mtDNA MT-CYB基因上,当正常的G碱基突变为A碱基时,第166位甘氨酸密码子(GGA)转换成终止密码子(AGA),导致转录终止,线粒体氧化磷酸化发生障碍。在线粒体内膜上,呼吸链复合物Ⅲ是氧化磷酸化电子传递过程中的第二个酶,其突变或缺失会影响催化电子从还原型辅酶Q到细胞色素C的转运,且将质子从线粒体内膜转移到膜外。呼吸链复合物Ⅲ含有11个亚单位,1个由mtDNA编码,10个由nDNA编码,而线粒体细胞色素b(mitochondria cytochrome b,MT-CYB)是呼吸链复合物Ⅲ中唯一由mtDNA编码的亚基,是一种高度保守的疏水蛋白,含有2个血红素基团和8或9个跨膜区,MT-CYB与核心蛋白Ⅰ、Ⅱ共同构成呼吸链复合物Ⅲ的中心成分[31]。因此,MT-CYB基因的突变或缺失将直接影响线粒体氧化磷酸化的过程。本组病例中3093 C>G、3697 G>A和15242 G>A突变所致的MELAS综合征是国内首次报道,国外关于这3个位点的突变也仅有少量报道,因此,这3个突变在国内人群中导致的MELAS综合征的临床症状与突变率的关系无法考证,需要更多的病例积累,具体的发病机制有待进一步研究。
本研究中30例患者发生3243 A>G突变,血液检出25例发生3243 A>G突变,突变率22.15%~100%(36.26±13.38)%;尿液检出30例发生3243 A>G突变,突变率38.46%~100%(59.49±22.67)%;与外周血的mtDNA突变率相比,尿液细胞的突变率显著增高(P<0.05)。目前,尿液细胞的mtDNA突变率明显高于外周的机制并不明确,有研究认为血外周血细胞对能量需求大、分裂速度快,可能会自然选择地淘汰mtDNA突变率高的细胞[32]。LAAT等[33]对8例3243 A>G突变患者从刚出生时的外周血细胞到确诊MELAS综合征(相隔8~20 a)时的外周血细胞的突变率进行纵向比较发现,外周血的mtDNA突变率进行性降低,平均每年减少1.42%。有学者认为存在于生命周期短的细胞、对细胞伤害较轻的mtDNA突变,不会对细胞生存产生压力,允许突变的mtDNA积累等[34]。尿液细胞的DNA主要来源于肾脏和输尿管的上皮细胞,虽然上皮细胞属于分裂旺盛的细胞,但上皮细胞耗氧量小,允许突变的mtDNA积累,因此外周血的mtDNA突变率明显低于尿液细胞。FIN⁃STERER等[35]等通过对比MELAS综合征患者血液、尿液、唾液、肌肉细胞和毛囊的mtDNA突变率发现,血液、尿液和唾液细胞的mtDNA突变率较低,肌肉细胞的突变率最高,而尿液细胞的突变率与肌肉细胞相差无几。但肌肉取材为有创性检查,且不适用于无症状亲属的筛查。由于尿液无创、容易获得、突变率高,可作为MELAS综合征患者及亲属基因测序首选的标本。
本研究共发现20例患者的母亲、外婆、舅舅、兄弟姐妹或儿女存在相同的突变位点,父亲均未发现突变位点,符合母系遗传。由于受精卵中线粒体的只来源于卵细胞,mtDNA只能从母亲传递给子女,然后由她的女儿传递给后代,mtDNA传递至儿子后即终止,父亲不能将线粒体基因传递给后代,所以ME⁃LAS综合征为母系遗传。17例患者的母亲或其他亲属的尿液细胞发生3243 A>G突变位点,突变率24.34%~89.26%(45.82±14.18)%,其中15例有临床表现,轻重不一,2例无临床表现。阈效应和异质性可能是患者亲属发生基因突变但无临床表现的原因。
MELAS综合征为母系遗传,3243 A>G是最常见的突变位点。临床怀疑MELAS综合征时,可先检测3243 A>G、3252 A>G、3271 T>C、8344 A>G和13513 G>A等热点突变,这样可确诊约90%的患者,当热点突变阴性时再行mtDNA全长基因测序,若仍为阴性,必要时可进行nDNA测序,这是一种经济、有效的方法。尿液细胞的mtDNA突变率高于外周血,可作为MELAS综合征患者及亲属基因测序首选的标本。本研究还发现3697 G>A、1642 G>A和15242 G>A突变为国内首次报道,丰富了国内ELAS综合征线粒体基因突变的特点。MELAS综合征的发病机制是十分复杂的,受mtDNA和nDNA两套遗传体系共同调控,目前国外的研究重心逐渐从单个mtDNA突变位点转移到多个突变位点的复合突变研究,由mtDNA组到nDNA组突变的研究。随着分子生物学技术的广泛应用和新技术的不断发展,许多新的突变位点、复合突变和nDNA组突变将会被发现,将有助于阐明MELAS综合征的发病机制。对MELAS综合征认识的深入,也为该病的诊治和遗传咨询提供依据。

