血浆p16、ANXA-1抗体在非小细胞肺癌患者的表达变化及其作为诊断标志物的探讨
赵 欢 张 萱 韩志峰 马小莉(青岛大学附属青岛市立医院内分泌科,青岛266071)
哺乳动物细胞周期的顺利进行得益于细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性蛋白激酶(cyclin-dependent kinases,CDKs)及细胞周期蛋白依赖性蛋白激酶抑制蛋白(cyclin-dependent protein kinase inhibitors,CKIs)的协同作用及平衡调节,细胞周期中设有多个调控点以保障其顺利有序进行,其中,G1-S期是最为关键的调控点。正常生理情况下,细胞分化增殖过程中,CyclinD1与CDK4、CDK6相互作用形成复合物,促进Rb蛋白磷酸化失活及转录因子E2F1释放入核。进入细胞核的E2F1与靶基因启动子结合促进S期相关基因转录,细胞由G1期进入S期。p16蛋白是G1晚期的负性调控因子,通过与CyclinD1蛋白竞争性结合CDK4及CDK6抑制CDK4∕6介导的Rb蛋白磷酸化,导致细胞周期停滞于G1期[1-2]。CyclinDl∕p16∕Rb信号传导通路的任一环节异常都可能导致细胞周期紊乱,导致肿瘤发生。与多数正常组织微量表达或几乎不表达不同,多个文献报道了多种实体肿瘤内p16蛋白过度表达,且与肿瘤发生及其恶性生物学行为有关[3]。
膜联蛋白A1(Annexin A1,ANXA-1)是钙离子依赖性磷脂结合蛋白超家族成员,在调控炎症反应、细胞增殖和分化、凋亡细胞吞噬清除等过程中发挥重要作用[4]。研究发现,ANXA-1在COPD及NSCLC中 表 达 上 调[5]。ANXA-1可 通 过ANXA-1∕NF-κB∕miR-26a信号通路增强NSCLC细胞中核因子NF-κB活 化,促 进 肿 瘤 侵 袭 与 转 移[6]。敲 除ANXA-1基因可抑制NSCLC细胞增殖,迁移和侵袭[4]。表明ANXA-1可能在NSCLC发生、进展中发挥重要作用[7]。
肿瘤发生早期,异常表达的肿瘤抗原可被机体免疫系统识别,激活体液免疫应答,导致相应抗体产生,称为肿瘤相关自身抗体(tumor associated autoantibody,TAAb)[8-9]。部分TAAb在临床症状出现前即可在患者血液中检测到,为寻找潜在肿瘤早期诊断标志物提供依据。目前已在多种肿瘤细胞中检测到p16、ANXA-1自身抗体,如肝细胞癌、乳腺癌、食管癌、宫颈癌[10-13]。NSCLC患者血浆中也检测到p16、ANXA-1抗体,但p16、ANXA-1自身抗体能否作为肺癌诊断的肿瘤标志物尚未明确。本研究采用抗原表位预测工具设计、合成抗原多肽(p16a、p16b、ANXA-1),采用自行建立的优化ELISA法检测NSCLC患者血浆p16、ANXA-1抗体表达情况,分析其表达与临床病理特征的关系及其对NSCLC的诊断价值,以期为NSCLC诊断提供新思路。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取2014年11月至2018年8月于吉林大学中日联谊医院胸外科首次确诊的NSCLC患者209例,男性131例,女性78例,年龄33~79岁,平均年龄58岁。根据2009年国际抗癌联盟UICC肺癌TNM分期标准,Ⅰ期20例,Ⅱ期100例,Ⅲ期40例,Ⅳ期49例。所有患者未接受过抗肿瘤治疗(放化疗或手术治疗),且所有患者均经手术切除肺组织病理学检查确诊。排除有恶性肿瘤家族史或合并其他肿瘤及患有自身免疫性疾病者。同时,选取同期健康志愿者193例作为正常对照组,男性103例,女性90例,年龄33~79岁,平均年龄58岁。根据病例资料,统计NSCLC组人口学信息,如年龄、性别、吸烟状况,及临床分期、病理类型、分化程度、肿瘤大小、是否有淋巴结转移等病理学信息。本研究经青岛大学附属青岛市立医院伦理委员会批准,所有受试者知情同意。
1.1.2 主要试剂 抗原肽委托上海吉尔生化有限公司合成;96孔酶标板购自美国Thermo Fisher Scientific公司;1.0 mol∕L磷酸盐缓冲液、磷酸盐缓冲片、小牛血清白蛋白购自美国Sigma-Aldrich公司;过氧化物酶标记的羊抗人IgG抗体购自英国Abcam公司;显色剂、终止液购自美国Life Technologies公司。
1.2 方法
1.2.1 样本采集 清晨、空腹状态下采集静脉血5 ml,4℃、2 500 r∕min离心10 min,收集上层血浆进行检测,剩余血浆于-80℃保存。
1.2.2 抗原肽设计、合成 采用生物信息学数据库及表位预测软件(http:∕∕www.iedb.org)设计抗原肽:对目标蛋白p16、ANXA-1进行序列分析,评估其pH值、亲水性、柔性、抗原性、表面可及性等,根据每段序列与HLA-Ⅱ51个等位基因分子的结合力筛选目标分子结构中潜在的T细胞表位,预测每段序列潜在的B细胞表位,评分,对满足上述要求的抗原片段进行综合评估,并根据抗原设计的一般原则对抗原片段进行适当调整,如N段亲水性氨基酸的添加以增加片段亲水性等,最终设计并委托上海吉尔生化公司合成3条抗原肽,分别为p16a、p16b、ANXA-1,p16a、p16b来源于p16蛋白,其分子结构中包含不同B细胞表位,3条抗原肽序列信息见表1。

表1 抗原肽序列信息Tab.1 Sequences information of antigen peptides
1.2.3 ELISA法检测p16、ANXA-1抗体 将抗原肽稀释至工作浓度(20 μg∕ml),100 μl∕每孔,4℃孵育过夜,0.1%PBST洗板3次,200 μl∕孔加入半胱氨酸溶液(10 μg∕ml)室温避光封闭1 h,洗板2次后放入40℃烘箱干燥2.5 h,4℃放置1周,按照课题组前期方法进行抗体检测[14-15]。0.1%PBST洗板2次,0.5%小牛血清白蛋白(BSA)1:100稀释后每孔加入50 μl,室温孵育1.5 h,洗板3次,加入用0.5%BSA 1∶25 000稀释的过氧化物酶标记的IgG二抗50 μl,室温孵育1 h。50 μl∕孔加入显色剂,室温避光反应25 min,加入25 μl终止液终止反应,15 min内采用自动酶标仪检测450 nm标准波长和620 nm参考波长处吸光度(OD)。每板均设空白对照、阳性对照。所有样本设复孔,以2孔测定值的平均值表示该样本OD值。所有样本重复测定2次,以2次OD值的平均值进行数据分析。以特异性结合指数(SBR)表示血浆p16、ANXA-1抗体水平,SBR=(OD样本-OD阴性对照)∕(OD阳性对照-OD阴性对照)。
1.3 统计学处理 采用SPSS22.0软件进行统计学分析,采用Kolmogorov-Smirnov检验对计量资料进行正态性检验,NSCLC组及健康对照组血浆p16、ANXA-1抗体水平及不同TNM分期NSCLC患者抗体表达水平均呈正态分布,以±s表示,组间比较采用Student′st检验。不同TNM分期NSCLC组抗体表达水平两两比较采用LSD检验。NSCLC组及健康对照组性别、吸烟情况等比较采用χ2检验。采用Graphpad prism 5.0软件绘制受试者工作特征(receiver operating characteristic,ROC)曲线,并分析p16、ANXA-1抗体对NSCLC的诊断价值,计算最佳截断值、灵敏度及特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组及健康对照组临床资料比较NSCLC组包括腺癌124例,鳞癌85例(图1);如表2所示,TNM分期Ⅰ期20例,Ⅱ期100例,Ⅲ期40例,Ⅳ期49例。NSCLC组与健康对照组的性别、年龄、吸烟情况差异无统计学意义。

图1 NSCLC患者病理及免疫组化特征(HE染色,×40)Fig.1 Pathological and immunohistochemical features of NSCLC patients(HE staining,×40)
表2 NSCLC组及对照组临床资料比较[±s,例(%)]Tab.2 Comparison of clinical characteristics between NSCLC group and control group[±s,n(%)]
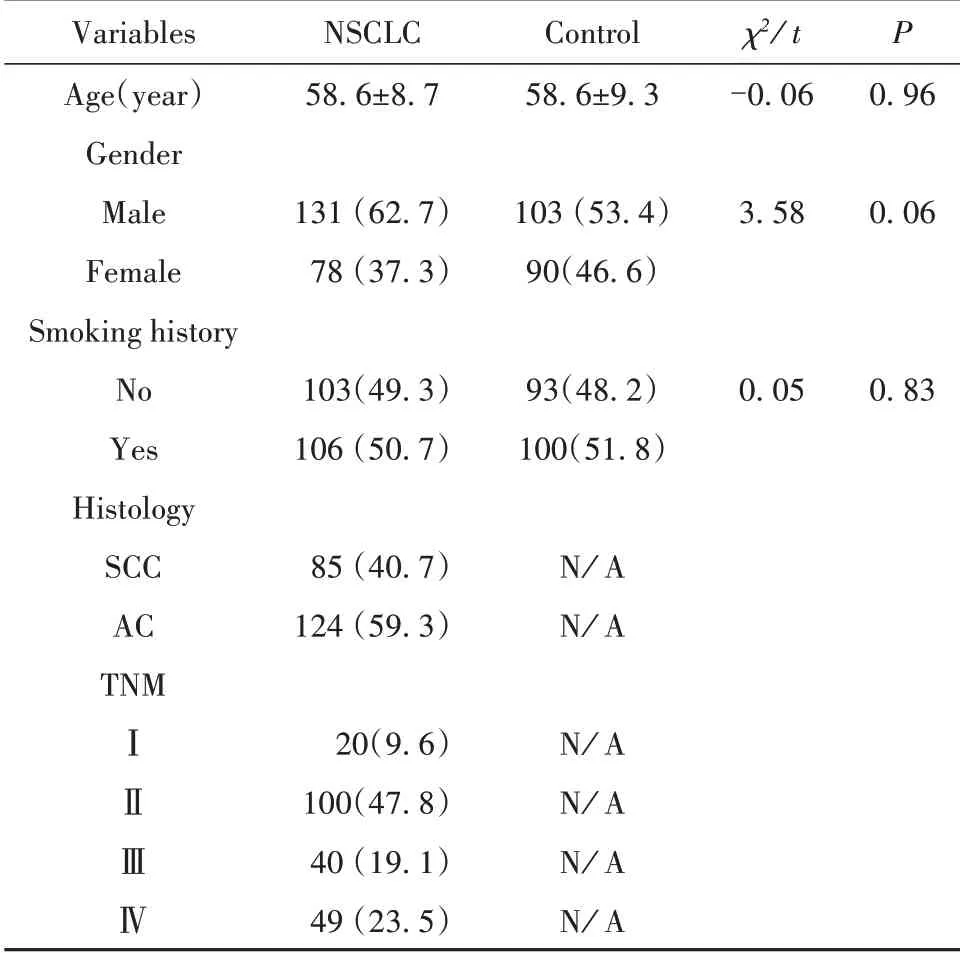
表2 NSCLC组及对照组临床资料比较[±s,例(%)]Tab.2 Comparison of clinical characteristics between NSCLC group and control group[±s,n(%)]
Note:SCC.Squamous cell carcinoma;AC.Adenocarcinoma.
Variables Age(year)Gender Male Female Smoking history No Yes Histology SCC AC TNMⅠⅡⅢⅣNSCLC 58.6±8.7 131(62.7)78(37.3)103(49.3)106(50.7)85(40.7)124(59.3)20(9.6)100(47.8)40(19.1)49(23.5)Control 58.6±9.3 103(53.4)90(46.6)93(48.2)100(51.8)N∕A N∕A N∕A N∕A N∕A N∕A χ2∕t-0.06 3.58 0.05 P 0.96 0.06 0.83
2.2 多组间血浆p16、ANXA-1抗体表达水平比较 如表3所示,NSCLC组血浆p16a抗体表达水平显著高于健康对照组(P<0.001),且NSCLC患者早期(Ⅰ期)即出现p16a抗体表达增加,随肺癌进展,其表达水平逐渐升高。NSCLC患者血浆ANXA-1抗体表达较健康对照组显著增加,且在Ⅱ~Ⅳ期患者中增加更为显著(P<0.05)。NSCLC组与健康对照组p16b抗体表达水平差异无统计学意义(P>0.05)。不同TNM分期患者血浆p16、ANXA-1抗体表达差异无统计学意义(P>0.05)。
表3 各组血浆p16、ANXA-1抗体表达水平比较(±s)Tab.3 Comparison of expression levels of auto-antibodies against p16 and ANXA-1 in different groups(±s)

表3 各组血浆p16、ANXA-1抗体表达水平比较(±s)Tab.3 Comparison of expression levels of auto-antibodies against p16 and ANXA-1 in different groups(±s)
Note:1)P<0.05,2)P<0.001 vs Control group.
Groups Control NSCLCⅠⅡⅢⅣn 193 209 20 100 40 49 p16a IgG 0.53±0.17 0.75±0.182)0.69±0.232)0.73±0.182)0.77±0.142)0.78±0.182)p16b IgG 0.87±0.26 0.89±0.31 0.85±0.41 0.86±0.23 0.93±0.30 0.93±0.41 ANXA-1 IgG 1.01±0.48 1.17±0.482)1.17±0.60 1.16±0.501)1.17±0.431)1.20±0.441)
2.3 NSCLC患者血浆p16、ANXA-1抗体表达与临床病理特征相关性分析 如表4所示,鳞癌患者血浆p16a抗体表达水平显著高于腺癌患者(P=0.02)。高分化患者血浆p16a抗体表达水平显著低于低分化患者(P=0.03)。伴有淋巴结转移的NSCLC患者血浆p16a、p16b抗体表达水平显著高于无淋巴结转移者(P=0.03,P=0.03)。p16a抗体表达与病理类型、分化程度、淋巴结转移相关,p16b抗体表达水平仅与淋巴结转移有关。NSCLC患者血浆ANXA-1抗体表达与年龄、性别、吸烟状况、病理类型、分化程度、肿瘤大小、淋巴结转移、TNM分期均无关(P>0.05)。
表4 NSCLC患者血浆p16、ANXA-1抗体表达与临床病理特征相关性(±s,n=209)Tab.4 Relationship between expression levels of auto-antibodies against p16 and ANXA-1 and clinicopathological parame⁃ters of NSCLC patients(±s,n=209)
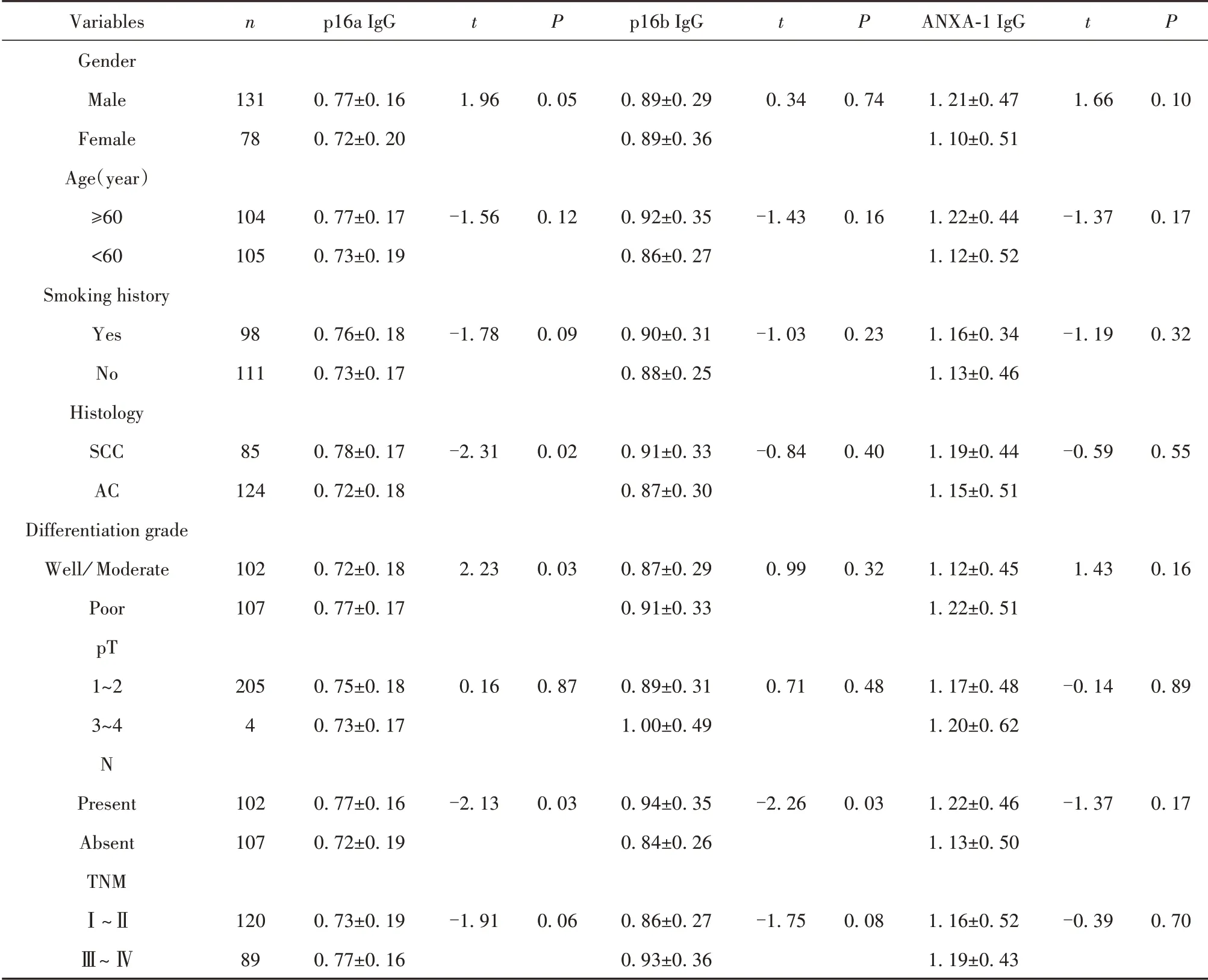
表4 NSCLC患者血浆p16、ANXA-1抗体表达与临床病理特征相关性(±s,n=209)Tab.4 Relationship between expression levels of auto-antibodies against p16 and ANXA-1 and clinicopathological parame⁃ters of NSCLC patients(±s,n=209)
Note:SCC.Squamous cell carcinoma;AC.Adenocarcinoma.
Variables Gender Male Female Age(year)≥60<60 Smoking history Yes No Histology SCC AC Differentiation grade Well∕Moderate Poor pT 1~2 3~4 N Present Absent TNMⅠ~ⅡⅢ~Ⅳn 131 78 104 105 98 111 85 124 102 107 205 4 102 107 120 89 p16a IgG 0.77±0.16 0.72±0.20 0.77±0.17 0.73±0.19 0.76±0.18 0.73±0.17 0.78±0.17 0.72±0.18 0.72±0.18 0.77±0.17 0.75±0.18 0.73±0.17 0.77±0.16 0.72±0.19 0.73±0.19 0.77±0.16 t 1.96-1.56-1.78-2.31 2.23 0.16-2.13-1.91 P 0.05 0.12 0.09 0.02 0.03 0.87 0.03 0.06 p16b IgG 0.89±0.29 0.89±0.36 0.92±0.35 0.86±0.27 0.90±0.31 0.88±0.25 0.91±0.33 0.87±0.30 0.87±0.29 0.91±0.33 0.89±0.31 1.00±0.49 0.94±0.35 0.84±0.26 0.86±0.27 0.93±0.36 t 0.34-1.43-1.03-0.84 0.99 0.71-2.26-1.75 P 0.74 0.16 0.23 0.40 0.32 0.48 0.03 0.08 ANXA-1 IgG 1.21±0.47 1.10±0.51 1.22±0.44 1.12±0.52 1.16±0.34 1.13±0.46 1.19±0.44 1.15±0.51 1.12±0.45 1.22±0.51 1.17±0.48 1.20±0.62 1.22±0.46 1.13±0.50 1.16±0.52 1.19±0.43 t 1.66-1.37-1.19-0.59 1.43-0.14-1.37-0.39 P 0.10 0.17 0.32 0.55 0.16 0.89 0.17 0.70
2.4 血浆p16抗体和ANXA-1抗体对NSCLC的诊断价值 采用ROC曲线评价血浆p16抗体和ANXA-1抗体对NSCLC的诊断价值,结果如图2、表5所示,p16a抗体AUC为0.816(95%CI:0.774~0.857),截断值为0.61,诊断灵敏度为78%,特异度为75%。p16a抗体对Ⅰ期患者诊断的AUC为0.701(95%CI:0.575~0.828),诊 断 灵 敏 度 为55%,特异度为81%,提示p16a抗体对早期NSCLC有辅助诊断价值。p16a抗体对Ⅱ~Ⅳ期的诊断效能稍高于Ⅰ期,AUC分别为0.805、0.869、0.843,诊断灵敏度分别为77%、90%、74%,特异度分别为75%、75%、83%。ANXA-1抗 体AUC为0.614(95%CI:0.559~0.669),截断值为1.04,诊断灵敏度为57%,特异度为67%。p16b抗体AUC为0.502(95%CI:0.446~0.559),对NSCLC的诊断效能较差。

图2 血浆p16、ANXA-1抗体诊断不同分期NSCLC的ROC曲线图Fig.2 ROC curve of diagnostic value of p16 and ANXA-1 antibodies for different stages of NSCLC
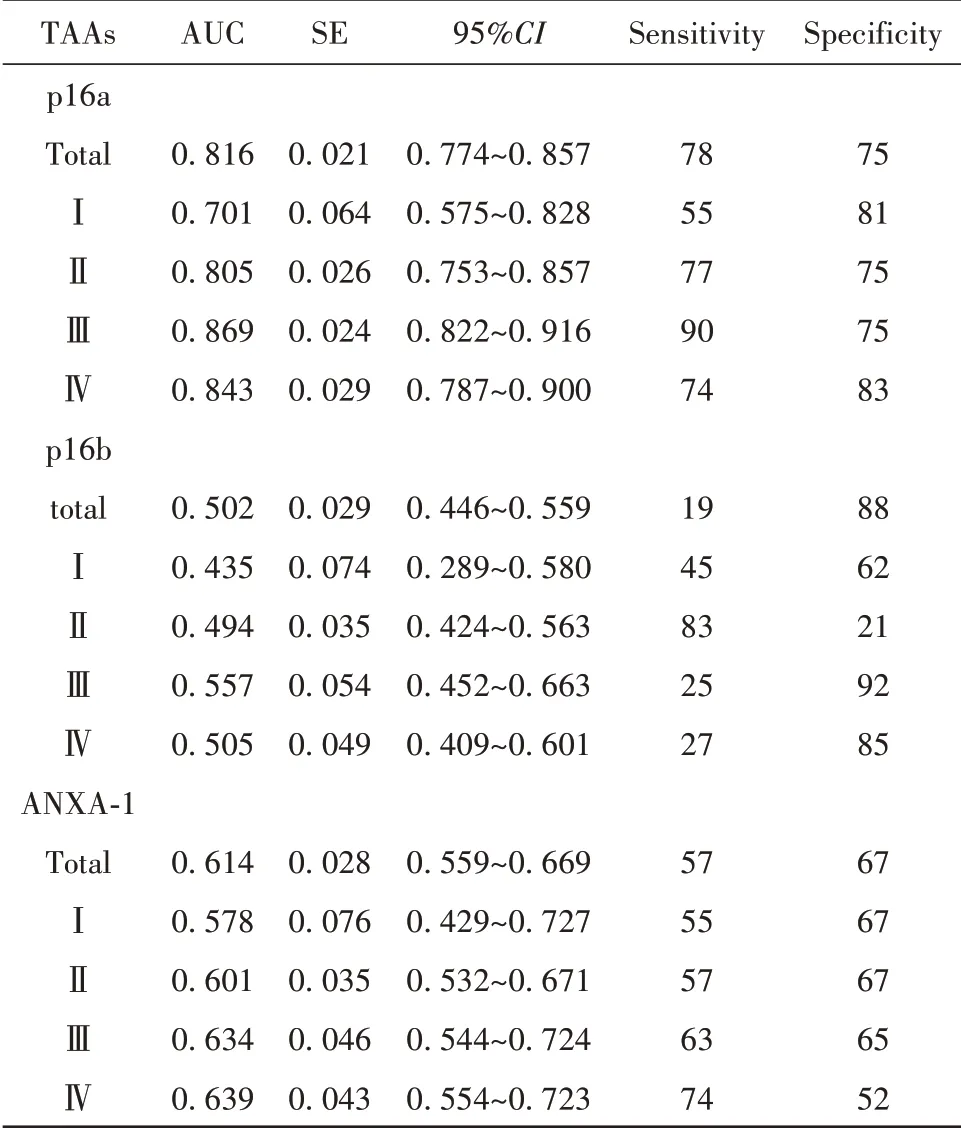
表5 p16、ANXA-1抗体对不同分期NSCLC诊断效能的ROC曲线分析(%)Tab.5 ROC curve analysis of diagnostic efficacy of circu⁃lating antibodies against p16 and ANXA-1 in dif⁃ferent stages of NSCLC(%)
3 讨论
作为机体抗肿瘤免疫应答产物,虽然肿瘤相关自身抗体产生的机制尚未阐明,但大量研究表明其可能与肿瘤发生、发展及预后密切相关。QIU等[16]通过检测肺癌诊断1年前患者血清中LAMR1自身抗体水平发现,其表达较对照组显著升高,且越接近疾病诊断时升高趋势越为明显。课题组前期研究发现,survivin抗体表达水平较高的NSCLC患者术后生存期较表达水平较低组显著延长,为从众多肿瘤相关自身抗体中寻找可用于NSCLC早期诊断或预后的生物标志物奠定了基础[15]。作为肿瘤标志物,自身抗体具有以下优点:结构稳定、不易被蛋白酶水解、可在血清稳定存在较长时间(半衰期7~30 d),并经过免疫放大效应,即使在肿瘤相关抗原(tumor-associated antigen,TAAs)浓度较低时仍可以高水平存在[17-18]。使自身抗体与其相应的TAAs相比在作为癌症早期诊断生物标志物上更有优势。
作为细胞生长、增殖的负性调节基因,p16在多种实体肿瘤中过表达,如卵巢癌、乳腺癌、前列腺癌和食管鳞状细胞癌等[19-22]。p16异常表达通常发生在肿瘤早期,为探索p16抗体作为肿瘤早期诊断标志物的价值提供了有力依据。研究发现,p16抗体对早期食管癌、宫颈癌有一定诊断价值[12,23],但p16抗体对NSCLC早期诊断价值的研究结论尚未统一。ANXA-1分子具有抗炎活性,可通过抑制免疫细胞聚集、迁移及活性削弱机体免疫监视功能,从而促进肿瘤发生、进展。研究报道ANXA-1在COPD及NSCLC中表达上调。因此,本研究推测ANXA-1抗体可预测NSCLC发生。检测NSCLC患者血浆p16、ANXA-1抗体表达情况发现,NSCLC患者血浆p16a、ANXA-1抗体表达水平显著高于健康对照组,且随肺癌进展,两者表达呈逐渐增高趋势,推测p16a、ANXA-1抗体可能参与NSCLC发生发展。NSCLC患者血浆p16a抗体过表达的机制尚未阐明,但大量证据表明p16a抗体过表达可能与p16Ink4a-Rb通路异常有关。Rb蛋白可负反馈调节p16基因表达,肿瘤发生通常伴随Rb蛋白表达缺失,导致p16基因过表达。p16基因过表达可能是机体抗肿瘤的方式,机体试图通过抑制肿瘤细胞增殖抑制肺癌进展,但效果较差[24]。p16a、ANXA-1抗体在NSCLC患者血浆的表达有明显差异,ANXA-1抗体在Ⅱ~Ⅳ期而非Ⅰ期患者中表达增加,提示ANXA-1可能主要在NSCLC中晚期而非早期发挥作用。ANXA-1对NSCLC预后的影响及分子机制目前鲜有报道,仍需大规模回顾性研究进一步阐明。p16a在Ⅰ期NSCLC患者中表达增加,提示p16a可能参与NSCLC发生,有望成为NSCLC早期诊断的生物标志物。采用ROC曲线分析p16、ANXA-1抗体对不同TNM分期诊断价值发现,p16a抗体诊断Ⅰ期NSCLC患者的AUC为0.701,敏感度为81%,提示其对早期肺癌有一定诊断价值;低分化、伴有淋巴结转移的NSCLC患者血浆p16a抗体表达水平显著高于高分化、无淋巴结转移患者,提示p16a抗体可能对NSCLC预后有一定预测价值,且p16a抗体对Ⅱ~Ⅳ期NSCLC的诊断效能优于Ⅰ期,因此,p16a有望成为NSCLC分期预测及预后评估的生物标志物。另外,p16a抗体的表达模式可能具有肿瘤特异性。JIN等[12]发现随食管癌进展,p16a抗体表达逐渐减弱,与p16a抗体在NSCLC中的表达趋势相反。由于p16在多种实体肿瘤中均存在表达异常,仍需进一步探索p16a抗体在其他实体肿瘤中的表达变化,以明确p16抗体对NSCLC的诊断是否具有特异性。本研究为病例对照研究,Ⅰ期患者样本量相对较小,故研究结论存在一定局限性;此外,p16a、ANXA-1抗体参与NSCLC发生发展的分子机制仍需进一步研究。
与重组蛋白相比,线性抗原肽具有非特异性结合少、表位特异性强等优势,且造价低廉、检测技术成熟、操作简便,适用于肺癌高危人群筛查。本研究根据p16分子中2个不同抗原表位分别设计了p16a和p16b 2个抗原肽,通过检测NSCLC患者血浆p16a、p16b抗体表达水平发现,两者在NSCLC血浆的表达趋势截然不同:p16a抗体在NSCLC组表达显著高于健康对照组,而p16b抗体表达与健康对照组统计学差异无统计学意义。不同抗原表位的免疫原性不同,与MHC分子结合后激活B细胞产生抗体的能力也不同[25]。p16a抗原肽所含的抗原表位是触发体液免疫应答、导致p16抗体产生的真正原因,为进一步开发更灵敏的抗体检测方法奠定了基础。
综上所述,p16、ANXA-1抗体在NSCLC中的表达变化提示其可能参与NSCLC发病机制。p16a抗体在NSCLC患者血浆过表达,且随肺癌进展表达逐渐增强,提示p16a抗体对NSCLC早期诊断、分期预测有一定价值。此外,p16a抗体表达与病理类型、肿瘤的低分化、淋巴结转移有关,提示p16a抗体或许与NSCLC预后有关,但仍需大规模回顾性研究进一步验证。