犬冠状病毒M和N蛋白单克隆抗体的制备及其生物学特性鉴定
甘军纪,吕海峰,汤 也,田晓彦,刘秀梵
(扬州大学 兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心/江苏省人兽共患病重点实验室,江苏 扬州 225009)
犬冠状病毒(canine coronavirus,CCV)是一种单股正链RNA病毒,通常引起犬轻度到严重的胃肠炎。尽管CCV感染通常局限于肠道,但近年来出现的泛嗜型 CCV变异株,能引起幼犬全身性和致死性感染[1]。犬胃肠炎可由多种病原体引起,包括病毒、细菌或寄生虫。最常见的病毒性肠炎病原体除了CCV,还有犬细小病毒(CPV)[2]、犬腺病毒2型(CAV-2)和犬瘟热病毒(CDV)等[3]。因此,快速的病毒学检测对控制犬病毒性肠炎疾病至关重要。
CCV基因组全长约30 kb,5′端有2个大开放阅读框(ORFs), 1a和1b,其编码病毒复制酶多聚蛋白。ORF1b的下游有几个小ORFs,通过亚基因组mRNA表达,编码几个结构蛋白和非结构蛋白。CCV结构蛋白有4种,分别为刺突蛋白(S,170~220 kDa),小膜蛋白(E或SM,9.2 kDa),膜蛋白(M,32 kDa)和核衣壳蛋白(N,43~50 kDa)[4-6]。S糖蛋白形成冠状病毒的特征性刺突,参与病毒粒子与宿主细胞受体结合以及介导病毒-细胞和细胞-细胞融合,主要诱导中和抗体,与病毒毒力相关[7-8]。小膜蛋白(E)是一种8~12 kDa的小多肽,在病毒粒子的包膜中发现含量很少,但是病毒出芽所必须的,与M蛋白一起,对病毒包膜的组装很重要。M蛋白是一种膜结构糖蛋白,在包膜蛋白中含量最高,是一种Ⅲ型糖蛋白,由短的氨基端外结构域、三跨膜结构域和长羧基端内结构域组成[9-10],是病毒组装和形成的关键成分,含有B细胞识别表位。冠状病毒核衣壳(N)是一种与基因组RNA所形成的复合物,在病毒粒子装配过程中与病毒膜蛋白相互作用的结构蛋白,对提高病毒转录和装配效率起着至关重要的作用,N 蛋白是CCV第二大结构蛋白[11]。虽然冠状病毒S蛋白在免疫中起主要作用,但M蛋白的氨基和羧基末端都能引起强烈的免疫反应,M蛋白可诱导抗体依赖-补体介导的病毒中和作用[12]。
在冠状病毒主要结构蛋白中,S蛋白变异较大,其S1区(氨基端)在不同属中表现出非常低的同源性,相比之下,S2区(羧基端)高度保守。M、N蛋白在同属冠状病毒中均有较好的保守性,但在各属间差异较大。主要结构蛋白保守性排序为 N>M>S,因此,在CCV 的诊断方面,研究 M和 N 蛋白的意义可能更大一些[11]。本研究通过杂交瘤技术获得CCV M、N蛋白单抗,并对其生物学特性进行分析鉴定,为CCV诊断试剂的开发奠定基础。
1 材料与方法
1.1 病毒CCV株(JS1706,JS1712株),由扬州大学农业部畜禽传染病学重点开放实验室分离、鉴定;CDV、CAV-2和CPV-2a/2b/2c毒种,由扬州大学农业部畜禽传染病学重点开放实验室分离、保存。相关病毒毒株来源、培养细胞和用途见表1。
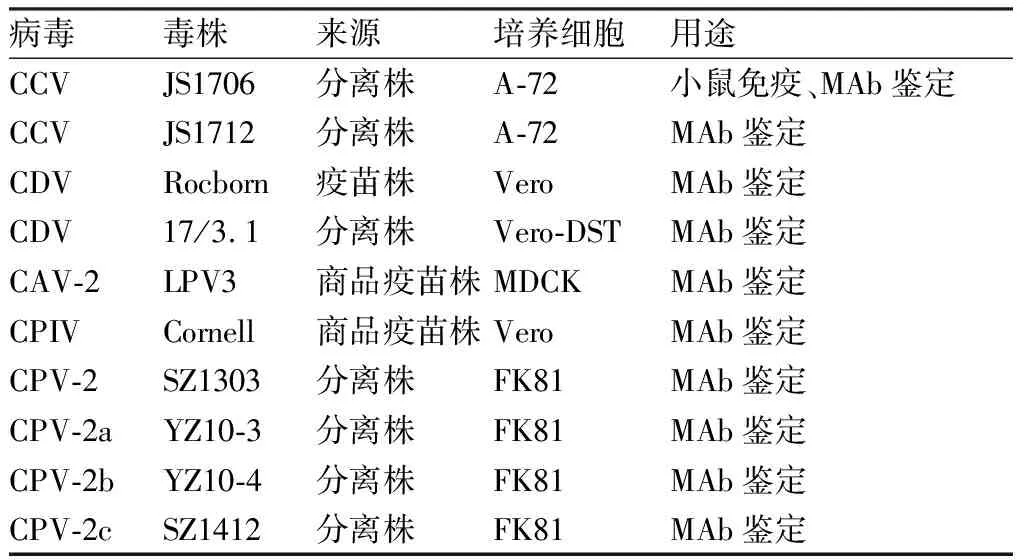
表1 病毒毒株、细胞与用途
1.2 细胞A-72细胞(ATCC,CRL-1542)、Vero细胞、MDCK细胞、FK81细胞、Vero-DST (DogSLAM)、 SP2/0细胞均由扬州大学农业部畜禽传染病学重点开放实验室保存、提供;SP2/0细胞用15%FBS-HT-DMEM培养基培养,其他细胞均用10%FBS-DMEM培养基培养,细胞在37℃、5%CO2培养箱中培养。
1.3 主要试剂DMEM培养基、胎牛血清(FBS)、0.25%胰酶-EDTA、HT(100×)、HAT(50×)购自Gibco公司;秋水仙碱、PEG6000,购自国药集团;弗氏完全佐剂、弗氏不完全佐剂,购自Sigma公司;FITC-羊抗鼠IgG、HRP-羊抗鼠IgG购自SouthernBiotech公司;PEG1500购自Roche公司;小鼠单抗亚类鉴定ELISA试剂盒购自Sino Biological公司;Endo H、 PNGase F,购自NEB公司;增强型ECLPlus化学发光试剂、ECL Plus超敏发光液、SDS,购自Solarbio公司;0.2 μm NC膜购自GE Healthcare lifescience公司;预染蛋白质Marker(16-270KD)购自碧云天公司;脱脂乳购自伊利公司;吐温-20,购自Sangon Biotech公司;其他化学试剂均为国产分析纯。
1.4 CCV抗原纯化按参考文献[5,13]方法,稍做改变。取CCV JS1706株病毒的A-72细胞培养物,4 000 r/min离心20 min,取上清液加入10% PEG6000,搅拌溶解后,4℃放置过夜。4 000 r/min,4℃离心30 min,弃掉上清,沉淀物加入NTE缓冲液 (0.1 mol/L NaCl,0.01 mol/L Tris-HCl,pH 7.4的1 mmol/L EDTA)重新悬浮至原体积1/10,再加到蔗糖垫(含30% 蔗糖-TNE缓冲液)上,140 000×g离心1.5 h,沉淀物加TNE缓冲液到原体积的1/50。测定纯化病毒的蛋白浓度,分装,-20℃ 保存备用。
1.5 杂交瘤细胞株建立与单抗隆抗体制备
1.5.1动物免疫 取纯化的CCV抗原(1.6 g/L),0.1%甲醛灭活24 h,作为免疫抗原。第1次免疫,抗原+弗氏完全佐剂1∶1混合乳化,腹腔注射免疫8周龄BALB/c小鼠,0.2 mL/只(160 μg)。间隔2周分别进行相同抗原第2,3次接种,使用弗氏不完全佐剂。第4次免疫,不使用佐剂,皮下注射纯化抗原0.1 mL。
1.5.2杂交瘤细胞株建立 BALB/c小鼠第4次免疫后3~4 d,按常规方法取免疫小鼠脾细胞与SP2/0进行细胞融合[14]。小鼠的脾细胞与 SP2/0骨髓瘤细胞比例约5∶1,融合剂PEG1500 (Roche,USA),选择培养基HAT,融合细胞分装96孔板,5%CO2培养箱37℃培养。融合后8~10 d,用CCV感染细胞96孔板进行IFA试验筛选阳性杂交瘤细胞。阳性杂交瘤细胞用HT培养基经有限稀释法进行3次克隆化,选择稳定分泌高特异抗CCV的单克隆抗体杂交瘤细胞株进行扩大培养,液氮中冻存。
1.5.3 单抗小鼠腹水的制备8~10周龄BALB/c小鼠,腹腔注射石蜡油0.5 mL/只,6~7 d后,腹腔注射杂交瘤细胞2×106/只,6~7 d小鼠腹部膨大时,用注射器针头采集腹水,4 000 r/min,离心10 min取上清(最上层脂质弃去),分装,-20℃保存备用。IFA、ELISA法测定抗体效价。
1.6 间接免疫荧光试验(IFA)A-72细胞,用10%FBS DMEM培养基方瓶(25 cm2Flask,Corning),37℃ 5% CO2培养箱培养。细胞形成致密单层后,0.25%胰酶-EDTA消化,分装96孔板,培养24 h,形成单层后,接种1%FBS DMEM培养基稀释的CCV,100 μL/孔(含100~300 TCID50),培养24 h,弃培养液,PBS洗涤1次,冷甲醇固定4 h以上,弃甲醇、空干,4℃保存、备用(3个月内使用)。取上述96孔细胞板,加杂交瘤(mAb)培养上清,37℃水浴箱孵育40 min;PBS洗涤3次,加1∶500稀释的FITC-羊抗鼠IgG,37℃水浴箱孵育40 min;PBS洗涤3次,空干,倒置荧光显微镜下观察。细胞内有特异免疫荧光的判定为IFA检测阳性。
1.8 单抗亚类鉴定按小鼠单抗亚类鉴定ELISA试剂盒(Sino Biological)说明书进行。
1.9 Western blot分析纯化的CCV蛋白,加5×的蛋白上样缓冲液,沸水煮10 min裂解,进行SDS-PAGE电泳;电转印到硝酸纤维膜(NC)上,用5%脱脂乳(PBST)室温封闭3 h,mAb 4℃过夜孵育;PBST洗涤3次,每次10 min;NC膜放入按1∶10 000 稀释的HRP羊抗鼠IgG,室温孵育1 h;PBST洗涤二抗作用后的NC膜2次,每次10 min;将NC膜用吸水纸吸干,把增强型ECL化学发光试剂盒均匀涂抹在NC膜上(1 min),避光曝光,成像系统(Tanon 5200)扫描、分析。
1.10 M、N蛋白去糖基化分析为了证明M、N蛋白是否糖基化,取纯化的CCV蛋白20 μg,分别用 endo H、 PNGase F 和endo H+ PNGase F (NEB公司,美国)37℃处理1 h进行去糖基化,具体操作按说明书。取 10 μL进行 SDS-PAGE(未处理的CCV蛋白作为对照), 转膜后分别用抗M蛋白单抗(2G3)、抗N蛋白单抗(2B8)按1.9进行 Western blot 分析。
1.11 杂交瘤细胞染色体组型分析杂交瘤细胞传代后48 h,加入终浓度为0.1 mg/L的秋水仙碱(秋水仙素),继续培养3 h,1 000 r/min离心去上清,加入5 mL 37℃预热的0.5% KCl低渗液,混匀,37℃水浴20 min,加入新配制的固定液(甲醇:冰醋酸=3∶1)1 mL, 3次固定后制片,姬姆萨染色,镜检、计数、拍照[15]。
1.12 单抗的特异性鉴定96孔板培养的A-72、Vero(Vero-DST)、MDCK、FK81细胞形成单层后,分别接种CCV(JS1706、JS1712)、CDV、犬副流感病毒(CPIV)、犬腺病毒(CAV-2)和CPV-2/2a/2b/2c, 100 μL/孔(含100~300 TCID50),37℃、5% CO2培养箱继续培养。CCV培养24 h,其他病毒培养72 h,弃培养液,PBS洗涤1次,冷甲醇固定4 h(或过夜),加mAb培养上清进行间接免疫荧光(IFA)检测,试验程序同1.6。
1.13 杂交瘤分泌抗体稳定性试验经3次克隆化的CCV阳性杂交瘤细胞,液氮冻存后,复苏、培养,连续传代培养至40代,IFA、ELISA试验检测1~40代细胞培养上清的单抗效价。
2 结果
2.1 CCV抗原纯化先后纯化3批次CCV抗原,病毒蛋白含量为1.6~3.3 g/L。
2.2 CCV阳性杂交瘤细胞株的建立先后进行6批次细胞融合试验,IFA检测共获得阳性杂交瘤细胞株13株。经传代、连续3次克隆化、液氮冻存,能稳定分泌CCV抗体的杂交瘤细胞株仅4株(分别来源于不同的融合批次),分别命名为2H11、2G3、3E2和2B8。
2.3 间接免疫荧光试验4株杂交瘤培养上清mAb,均与CCV感染细胞反应,呈现特异性细胞免疫荧光(图1)。
2.4 单抗亚类经mAb Ig亚类ELISA试剂盒鉴定,2H11为IgG3亚类,2G3、3E2和2B8均为IgG1亚类。
2.5 Western blot分析根据CCV JS1706 的M、N蛋白氨基酸序列(GenBank登录号: MN078152,MN163040)预测的M、N蛋白相对分子质量分别为29,43 kDa,M蛋白有3个潜在的N-糖基化位点[10],N蛋白有4个潜在的N-糖基化位点。Western blot结果表明,2H11和2G3单抗识别蛋白带与预测的CCV M蛋白相对分子质量基本相符; 3E2和2B8单抗识别蛋白带条带与预测的CCV N蛋白相对分子质量基本相符。M和N蛋白分别出现2个不同的条带可能与蛋白修饰有关。纯化CCV抗原免疫的小鼠血清(Serum)也能识别相应的蛋白条带(图2)。

1.2H11;2.2G3;3.3E2;4.2B8;M.预染蛋白质Marker
2.6 M、N蛋白去糖基化CCV蛋白经去糖基化酶Endo H、PNGase F和Endo H+PNGase F消化处理,M蛋白单抗(2G3)Western blot 分析结果见图3A,酶消化后的蛋白相对分子质量有明显变化,Endo H和PNGase F去糖基化效果类似,表明单抗识别M蛋白的相对分子质量差异(M、M1、M0)是由于M蛋白糖基化程度不同引起。N蛋白单抗(2B8)Western blot 分析结果见图3B,酶消化后的N蛋白相对分子质量没有发生明显变化,提示其可能非糖基化修饰。

A.M蛋白单抗(2G3)Western blot 分析;B.N蛋白单抗(2B8)Western blot 分析。M.预染蛋白Marker;1,5.未处理CCV蛋白;2,6.Endo H处理;3,7.PNGase F处理;4,8.Endo+ H PNGase F处理
2.7 杂交瘤细胞染色体组型分析正常小鼠脾细胞染色体数目为40条,SP2/0细胞染色体数目为62~68条,杂交瘤细胞染色体数目应接近于两种亲本细胞染色体数目的总和。M蛋白单抗杂交瘤细胞株2H11染色体数为(95.73±3.57),2G3染色体数为(98.45±8.15);N蛋白单抗杂交瘤细胞株3E2染色体数为(98.27±3.72)、2B8染色体数为(99.09±4.70),均属于杂交瘤染色体组型(图4)。
2.8 单抗特异性IFA试验结果见表2,4种CCV单抗隆抗体仅与CCV(JS1706、JS1712)反应,不与CDV、犬腺病毒(CAV-2)、CPV-2/2a/2b/2c和CPIV反应,具有高度的特异性。
2.9 杂交瘤分泌抗体的效价与稳定性杂交瘤细胞2H11、2G3培养上清的IFA效价为1∶1 000,ELISA效价均≥1∶105; 2B8、3E2的IFA效价为1∶100,ELISA效价分别≥1∶105,≥1∶103。在体外连续传40代(P0~P40),各代次培养上清的IFA、ELISA检测结果见表3,抗体滴度维持稳定,说明这4株杂交瘤细胞可在体外长期培养,并能稳定分泌抗体。

A.2H11染色体;B.2G3染色体;C.3E2染色体;D.2B8染色体

表2 CCV 单抗隆抗体IFA试验特异性
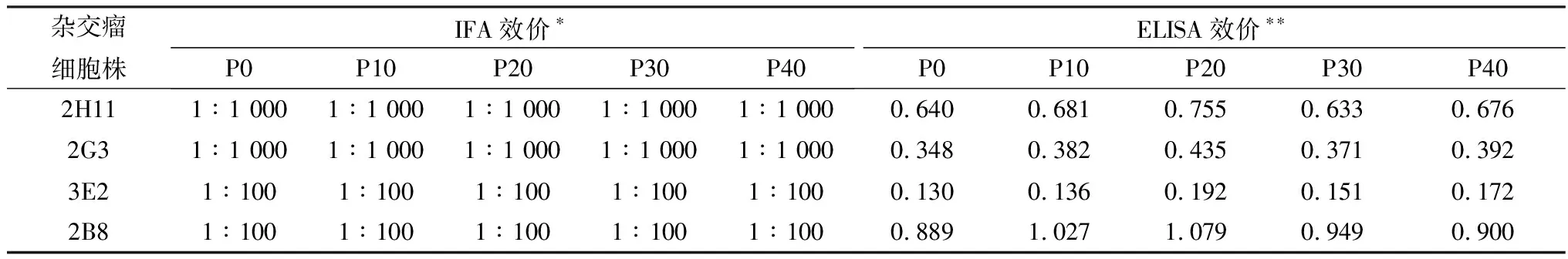
表3 连续传代的杂交瘤细胞株培养上清中分泌抗体的稳定性
3 讨论
冠状病毒M蛋白是最丰富的膜结构蛋白,在冠状病毒组装中起核心作用,与几乎所有其他病毒粒子成分相互作用[17]。N蛋白是冠状病毒感染细胞后产生的主要抗原,也是病毒的主要靶点之一。S蛋白似乎在装配中起被动作用,通过分泌途径的过程中,被M蛋白捕获并与病毒粒子结合。冠状病毒主要结构蛋白S∶N∶M物质量的比在不同的报告中略有差异[18],平均为1∶8∶12,尽管也有报道称M∶N达到3[19]。E蛋白丰度低且体积小[18]。另一方面,S蛋白变异较大,且同属冠状病毒的S蛋白有抗原相关性,因此S蛋白抗体在同属冠状病毒中存在交叉反应[20],而M、N蛋白相对保守。从CCV 的诊断方面考虑, 应重点关注M 和 N 蛋白的作用。
在大多数有囊膜病毒中,其囊膜蛋白含有糖基化修饰,这种修饰对其稳定性、免疫原性、免疫逃逸和生物学功能具有重要意义[21-22]。冠状病毒M蛋白通常是一类不同糖基化蛋白,包括未糖基化的前体,相对分子质量为20~38 kDa。CCV JS1706、JS1712株M蛋白预测的相对分子质量为29 kDa,有3个潜在的N-糖基化位点(Asn-X-Thr 或 Asn-X-Ser)[10]。如果按每个糖链对总相对分子质量贡献2.1 kDa计算,全部糖基化M蛋白大约35 kDa,这一数值略高于本试验结果(图3),可能是由于不是所有的潜在糖基化位点都发生糖基化[21]。理论上,用去糖基化酶Endo H消化,可水解高甘露糖N -链寡糖,去糖基化酶PNGase F消化,可以水解几乎所有类型的N-多糖链。本研究中, M蛋白经去糖基化酶处理后相对分子质量降低,说明糖侧链有效去除[23]。CCV JS1706、JS1712株N基因编码382个氨基酸,预测相对分子质量约43 kDa。虽然N蛋白分子上含有4个潜在N-糖基化一致序列,但普遍认为磷酸化是唯一已知的冠状病毒N蛋白的翻译后修饰。磷酸化的作用还不很清楚,但被认为会触发N蛋白的构象变化,并可能增强N蛋白对病毒RNA的亲和力。本研究中, N蛋白经去糖基化酶处理后的相对分子质量无明显变化,证明CCV N蛋白未发生糖基化,与VENNEMA等[24-25]的观察结果类似。一些研究也指出,在免疫印迹试验中存在1种或多种N蛋白条带 (相对分子质量相差2~5 kDa,有时被命名为N′、N″等),是由于N蛋白磷酸化的结果[16]。本研究中, CCV M、N蛋白特异单抗识别相应蛋白的相对分子质量差异应与M蛋白糖基化、N蛋白磷酸化相关。
单抗隆抗体因其高特异性、高效价、高纯度、低成本并可以大量生产的特点,在目前的疾病诊断与治疗中具有较大的优越性。本研究建立4株稳定分泌抗CCV单抗隆抗体的杂交瘤细胞株,其中2株单抗针对CCV M蛋白,另外2株单抗针对CCV N蛋白。4株单抗均具有高度特异性,效价高,与其他相关犬病毒无交叉反应,体外连续传代培养40代能稳定分泌抗体,可适用于规模化生产与应用。本研究成功建立了抗CCV M、N蛋白特异单克隆抗体杂交瘤细胞株,为CCV鉴定和相关诊断方法的建立奠定良好的基础。

