子宫内膜炎奶牛血酮与炎性细胞因子的相关性
张瑞雪, 张 博, 赵 辉, 赵 谜, 郭延生
(宁夏大学 农学院,宁夏 银川 750021)
子宫内膜炎是奶牛养殖业中最常见的产后疾病,易引起产奶量和繁殖力下降。引发奶牛子宫内膜炎最普遍因素是细菌感染[1-2],这些细菌包括金黄色葡萄球菌、链球菌、大肠杆菌和绿脓杆菌等。当大量细菌入侵奶牛子宫时,抗原刺激免疫细胞(B细胞、T细胞、单核细胞、自然杀伤细胞等)和非免疫细胞(表皮细胞、血管内皮细胞等)合成并分泌细胞因子,从而激活局部非特异性和特异性的细胞、体液免疫机制,清除子宫内感染的细菌等有害物质。但奶牛产后干物质采食量下降,能量输出增加,易导致能量负平衡,奶牛免疫力减弱,引起子宫内膜炎的发生。研究表明,奶牛临床或亚临床子宫内膜炎的发生与子宫组织中炎性细胞因子mRNA的表达有极大的关联[3-4],子宫内膜炎奶牛血清中大多数炎性细胞因子表达水平显著升高[5-6]。为更全面评价炎性细胞因子在奶牛子宫内膜炎炎症中的变化规律及其与能量负平衡之间相关性,本研究对产后子宫内膜炎奶牛血酮与血浆中炎性细胞因子的变化及其相关性进行研究,以期为子宫内膜炎的诊断和治疗提供更详细的资料。
1 材料与方法
1.1 主要试剂与仪器肿瘤坏死因子-α(TNF-α)、生长转化因子-β(TGF-β)、白细胞介素-1(IL-1)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-10(IL-10)、白细胞介素-13(IL-13)、白细胞介素-17(IL-17)、白细胞介素-18(IL-18)、白细胞介素-23(IL-23)检测试剂盒,均购自江苏晶美生物科技有限公司;Nova Vet血酮(BHBA)检测试纸(哈罗德,中国)。
1.2 实验动物的选择与样品制备本试验中实验动物均为荷斯坦奶牛。从宁夏贺兰中地生态牧场一场随机选取8头2~3胎次产后0~21 d患有子宫内膜炎奶牛和8头2~3胎次产后0~21 d健康奶牛,尾静脉采血,装入抗凝管,制备血浆,—80℃保存。
1.3 血液中细胞因子的测定采用酶联免疫吸附试验(ELISA)法测定血浆中促炎性细胞因子TNF-α、IL-1、IL-6、IL-8、IL-17、IL-18、IL-23和抗炎性细胞因子TGF-β、IL-4、IL-10、IL-13的质量浓度,所有试验步骤均按照试剂盒所带说明书中的方法进行。
1.4 血酮值的测定用血酮检测试纸测量血酮值(KET,ketone bodies),并记录。
2 结果
2.1 子宫内膜炎奶牛血浆中促炎性细胞因子的变化规律ELISA检测子宫内膜炎奶牛和健康奶牛血浆中促炎性细胞因子的表达量,结果显示,子宫内膜炎组血浆中促炎性细胞因子TNF-α、IL-1、IL-6、IL-8、IL-17和IL-18的含量显著升高(P<0.05),而IL-23的含量无明显变化(P>0.05)(表1)。
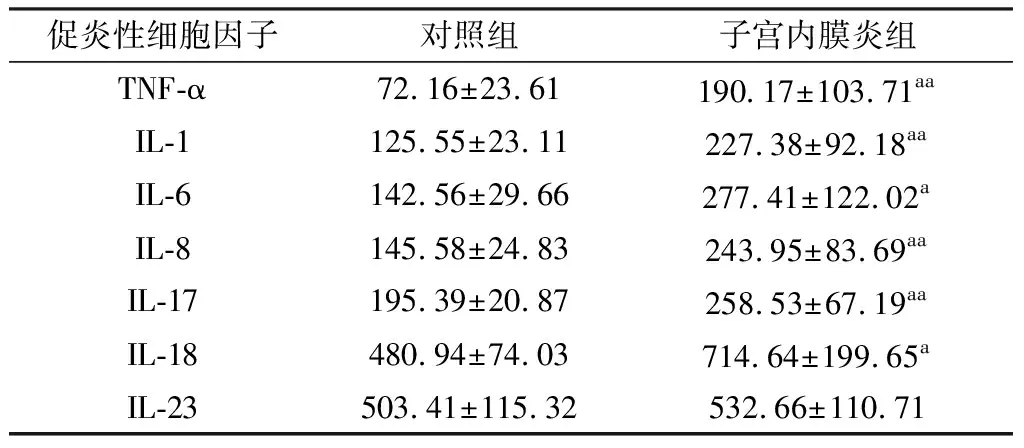
表1 子宫内膜炎组和对照组血浆中促炎性细胞因子测定结果 ng/L
2.2 子宫内膜炎奶牛血浆中抗炎性细胞因子的变化规律ELISA检测子宫内膜炎奶牛和健康奶牛血浆中促炎性细胞因子的表达量,结果显示,子宫内膜炎组血浆中抗炎性细胞因子TGF-β、IL-4和IL-10的含量与对照组相比明显升高(P<0.05),而IL-13的含量无明显变化(P>0.05)(表2)。

表2 子宫内膜炎组和对照组血浆中促炎性细胞因子测定结果 ng/L
2.3 奶牛产后炎性细胞因子和酮体相关性分析
2.3.1奶牛产后试验组和对照组血酮值变化 图1中四分位数为箱型方框的上、下边,以最大值(max)、最小值(min)为线的上、下端,箱型方框中的线为中位数(median)的位置。子宫内膜炎组奶牛的最大血酮值(mmol/L)约为3.5,上四分位数约为2.8,中位数约为1.5,下四分位数约为1.1,最小血酮值约为0.5(对照组);而对照组的最大血酮值(mmol/L)约为1.5,上四分位数约为1.2,中位数约为0.8,下四分位数约为0.5,最小血酮值约为0.2(子宫内膜炎组);说明子宫内膜炎组奶牛的血酮值显著升高(P<0.05)。
2.3.2炎性细胞因子和酮体相关性分析 子宫内膜炎奶牛KET与促炎性细胞因子TNF-α、IL-1、IL-8、IL-18的相关系数分别为0.786,0.833,0.810,0.881,与抗炎性细胞因子TGF-β、IL-4、IL-10的相关系数分别为0.738,0.738,0.714。KET与TNF-α、IL-1、IL-8水平之间呈显著性正相关(P<0.05),与IL-18水平之间呈极显著性正相关(P<0.01),KET与TGF-β、IL-4、IL-10水平之间呈显著性正相关(P<0.05)(表3)。

注:**代表极显著性差异(P<0.01)
3 讨论
3.1 子宫内膜炎奶牛促炎性细胞因子含量变化奶牛子宫在正常情况下受生理屏障和防御机能的保护,处于无菌健康状态。即使有细菌入侵,子宫会逐渐将其净化,在一定的时间内复旧。奶牛分娩后,子宫颈扩张,细菌易通过外阴、生殖道和开张的子宫颈入侵子宫,而且奶牛产后初期子宫内的环境和温度有利于细菌的繁殖,产后初期奶牛子宫内都会产生一定程度的炎症。但是,奶牛的子宫复旧机能能够在产后21 d之内,清除子宫内感染的细菌等有害物,使其恢复健康状态。然而,体质差、免疫机能弱的奶牛,细菌在其体内大量繁殖,造成子宫内膜损伤,引发子宫内膜炎等疾病。子宫内膜炎的发病率高达20%~40%[7]。造成子宫内膜炎的可能原因是奶牛分娩后初期泌乳增加、干物质采食量不足等,导致奶牛的免疫力下降,大量的细菌入侵子宫并繁殖。
本试验结果发现,子宫内膜炎奶牛血浆中TNF-α的表达水平明显升高。TNF-α是一种可以诱导多种细胞分泌的致炎因子,是奶牛子宫内膜炎的诊断标志物之一[8]。TNF-α能增强单核吞噬细胞、T细胞和成纤维细胞等各种细胞中IL-6合成而具有继发性炎症作用,并且可能调节免疫、炎性或修复性反应[8]。另外,当TNF-α的表达量过高时,可直接作用于子宫内膜上皮细胞,使内皮细胞受损,导致子宫产生炎症反应[9]。
同时,高水平的TNF-α能够增加细胞毒性,诱导IL-1、IL-6、IL-8的产生,加重奶牛子宫内膜炎炎症[10]。本试验结果发现,子宫内膜炎组血浆中IL-1、IL-6、IL-8的质量浓度显著升高。有相关研究发现,子宫内膜炎奶牛血清中IL-1的表达水平显著升高[10],IL-6[11]和IL-8[9]的表达水平也有升高趋势。IL-1质量浓度增加,可能由于奶牛子宫炎症持续的过程中,抗原刺激巨噬细胞分泌大量的IL-1,诱导IL-6、IL-8、TNF-α和趋化因子表达,以达到促进炎症反应的作用。作为中性粒细胞的趋化剂,高质量浓度的IL-8能够趋化嗜中性粒细胞及炎性细胞等向病灶部位游走、积聚,以清除炎症部位的细菌、坏死组织和损伤的细胞,从而促进奶牛子宫内膜炎炎症的发展,增强和放大炎症反应,引起机体局部免疫反应[2]。
本试验结果发现,子宫内膜炎奶牛组血浆中IL-6的质量浓度显著高于对照组。有研究证实奶牛子宫内膜炎通常会导致TNF-α和IL-6等促炎性细胞因子含量增加[9]。IL-6 mRNA的表达不受子宫炎症的影响[12],当奶牛受到病毒或其他一些促炎因子(IL-1、TNF-α)的刺激时,局部免疫系统的细胞才会产生IL-6[13]。高质量浓度的IL-6能够促进B细胞分化为浆细胞,导致机体产生更多的抗体。子宫内膜炎奶牛的子宫中存在病原微生物,将会导致白细胞(主要是中性粒细胞)数量增加[14]。本试验中子宫内膜炎奶牛血液中促炎性细胞因子IL-6水平升高。然而,有相关研究表明,血清中IL-6含量在子宫内膜炎奶牛和健康奶牛之间没有差异性[15],推测是病原微生物刺激子宫产生的白细胞和随血液一起流入的白细胞分泌IL-6,导致子宫冲洗液中IL-6质量浓度显著性升高。
目前,国内外关于IL-17的研究集中在皮癣、炎性关节炎、牛皮癣关节炎的治疗方面[16],尚未发现奶牛子宫内膜炎方面的相关报道。本试验结果表明,子宫内膜炎组血浆中IL-17的质量浓度显著升高。有研究发现,患有慢性子宫内膜炎的人,IL-17质量浓度明显升高[17]。同时,乳腺炎奶牛IL-17的表达量也显著性升高[18]。IL-17过度表达,会导致细胞中趋化因子的产生和白细胞浸润[19],介导奶牛子宫内膜炎的炎症反应。
3.2 子宫内膜炎奶牛抗炎性细胞因子含量变化研究发现,子宫内膜炎奶牛的血清中IL-10的表达水平有显著升高趋势,子宫内膜异位症妇女的血清中TGF-β、IL-10表达水平显著升高[10,20],同时,猪子宫内膜炎中IL-4、IL-10表达量显著升高[21]。本试验结果显示,子宫内膜炎奶牛血浆中抗炎性细胞因子IL-4、IL-10、IL-13和TGF-β的质量浓度显著升高。CD8+淋巴细胞释放增加,在奶牛子宫内膜炎炎症持续的过程中,发挥其抑制功能,抑制炎症反应[13]。本研究中IL-10表达水平升高可能与CD8+淋巴细胞释放增加相关。高质量浓度的IL-10通过抑制T细胞的增殖使局部细胞的免疫能力下降,抑制免疫效应细胞对子宫内膜组织的保护作用,此时,子宫局部抵抗细菌等感染的能力减弱,微生物无法被完全清除而损坏奶牛子宫内膜组织,从而使奶牛子宫内膜炎持续存在。目前,IL-4和IL-13在动物子宫内膜炎等方面的研究还未见报道。本试验IL-4和IL-13表达水平升高,其可能原因是细菌等病原微生物入侵子宫,造成局部感染,体液免疫和细胞免疫被激活,而T辅助细胞(TH)的活化和增殖是特异性免疫产生的关键,活化的TH细胞分泌大量IL-4和IL-13。高质量浓度的TGF-β可能通过诱导免疫球蛋白IgA分泌并促进组织修复来发挥抗炎作用。
本试验结果表明,子宫内膜炎奶牛血浆中IL-13、IL-18和IL-23的质量浓度与对照组无显著性差异。已知IL-13是一种多功能的Th2型细胞因子,它可以减轻炎症反应,但其与奶牛子宫内膜炎的相关性有待研究。国内外关于IL-13的报道发现,IL-13能够增强病灶周围区域受损神经元的小胶质细胞和巨噬细胞的吞噬作用,以改善神经炎症和促进脑功能的恢复[22]。奶牛被分枝杆菌感染时,促炎性细胞因子IL-18水平显著升高,导致免疫反应增强[23]。国内外关于细胞因子IL-23的最新研究,都体现在其对包括关节炎在内的炎性疾病进展的影响,通常与T淋巴细胞的生物学有关[24]。
3.3 子宫内膜炎奶牛炎性细胞因子与酮体相关性分析围产期奶牛由于饲粮、管理和环境等改变,能量需要和生产需求增加,干物质采食量下降,导致奶牛能量负平衡(negative energy balance,NEB)。奶牛产后子宫易受微生物感染,引发子宫炎症。长期NEB导致奶牛产生大量酮体,引起酮病,使奶牛体质下降和子宫的免疫力减弱而引起子宫复旧机能显著下降[25]。有研究发现,NEB与奶牛产后疾病具有很大的相关性,NEB使临床型子宫内膜炎发病率显著增加[26]。本研究中,子宫内膜炎组奶牛的血酮值显著升高,KET与TNF-α、TGF-β、IL-1、IL-4、IL-8、IL-10水平之间呈显著性正相关,与IL-18水平之间呈极显著性正相关,表明奶牛产后能量负平衡能显著降低奶牛的免疫水平,进而诱发子宫内膜炎的发生。
本研究采用Nova Vet血酮仪和ELISA法对子宫内膜炎奶牛血液中的KET与炎性细胞因子进行了测定和相关性分析,结果显示子宫内膜炎奶牛KET、TNF-α、TGF-β、IgG、IL-1、IL-4、IL-6、IL-8、IL-10、IL-17及IL-18的水平显著升高,KET与TNF-α、IL-1、IL-8、TGF-β、IL-4、IL-10和IL-18之间呈显著性或极显著性正相关,说明奶牛产后能量负平衡可显著降低其免疫水平,是子宫内膜炎发生的因素之一。

