大鼠70%肝缺血再灌注(IRI)合并部分肝切除对机体氧化应激和炎症反应的影响
徐嘉元,张千振,朴晨曦,王 月,刘 涛,张建涛,王洪斌
(1.东北农业大学 动物医学院 黑龙江省普通高等学校动物普通疾病防治重点实验室,黑龙江 哈尔滨 150030)
缺血再灌注损伤(IRI)是一种引起机体一系列复杂反应导致细胞损伤的病理生理现象,包括缺血损伤和炎症介导的再灌注损伤的动态过程。与其他器官不同,肝脏是机体唯一涉及门静脉和肝动脉的双重供血脏器,对缺血再灌注损伤极不耐受。肝脏缺血再灌注损伤(HIRI)多发于肝肿瘤切除、严重创伤或器官移植、血管重建等肝血流阻断后,导致肝功能衰竭及远隔器官损伤[1-2]。研究表明,在IRI损伤中,缺血期间由于代谢紊乱引起线粒体失调,导致肝细胞损伤。再灌注期间,功能失调的组织产生活性氧(ROS)和有毒代谢物诱导氧化应激,参与激活局部或全身凋亡介质和炎症级联反应[3]。如何提高肝IRI合并部分肝切除术的成功率和生存率,是近年来临床医学上比较重视的问题。目前,对于肝IRI合并肝切除的动物研究模型大部分局限于全肝或部分肝叶Pringle法[4]进行缺血,于再灌注后行肝叶切除。因此,本研究建立更贴近于临床的70%肝IRI合并部分肝切除模型进行模拟临床上的不规则肝切除、肝移植等手术,并检测机体氧化应激及炎症反应的变化,分析该模型对机体损伤的影响,为探讨肝IRI合并部分肝切除损伤的发病机制和保护性研究提供理论依据。
1 材料与方法
1.1 实验动物清洁级健康雄性Sprague-Dawley大鼠48只,6~7周龄,选用体质量200~250 g的大鼠进行造模,购自辽宁长生生物技术股份有限公司。分笼饲养于12 h昼夜交替、温度及湿度适宜的动物房,给予SPF级大小鼠维持饲料,自由饮水。
1.2 主要设备与试剂呼吸麻醉系统,美国小动物医疗器械公司生产;Epoch酶标仪,美国BioTek公司生产;异氟烷,河北一品制药有限公司生产;天冬氨酸氨基转移酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒均购自南京建成生物工程研究所;肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-10(IL-10)酶联免疫吸附(ELISA)测定试剂盒均购自江苏晶美生物科技有限公司。
1.3 大鼠70%肝IRI合并30%部分肝切除模型的建立及分组将48只雄性SD大鼠适应性饲养1 周后随机分为2组,假手术组(Sham组)、模型组(70%IRI+30%PH),每组24只。假手术组沿大鼠腹正中线切开,暴露肝脏,不行血管阻断及部分肝叶切除,仅用棉签翻动肝叶,然后关腹。模型组行70%部分肝(肝中叶+左外叶)缺血30 min,于再灌注前切除左外叶(占全肝的30%)。术前禁食8~12 h,不禁水。将大鼠放置于麻醉诱导盒中,连接呼吸麻醉导联系统行异氟烷呼吸麻醉,仰卧位保定,腹部备皮,消毒,铺设创巾。
麻醉成功后,自剑状软骨向下沿正中腹白线做长4~5 cm的切口,逐层进腹,用湿棉签探查肝脏,充分暴露肝门,游离肝周韧带,按照顺序分别游离镰状韧带、肝胃韧带、肝圆韧带,用显微弯镊钝性分离肝中叶、左叶的Glisson系统(包括门静脉分支、肝动脉及胆管)[5]。将无损伤微血管夹放置在下腔静脉和门静脉之间,阻断肝中叶、左叶的血流,诱导70%肝脏缺血。此时可见肝中叶、左叶呈灰白色,证明缺血成功。阻断血供期间右叶和尾状叶门静脉及动脉血供保留,预防肠道淤血。再灌注前切除左外叶,切除前用3 cm直无损伤血管夹夹闭左外叶根部作为预切线,防止结扎肝中左叶血供,造成再灌注后血供恢复不完全。用3-0号丝线沿无损伤微血管夹上端行左外叶结扎,切除。松开夹闭无损伤微血管夹,观察肝叶颜色由灰白色变为鲜红色,证明血液恢复。温生理盐水冲洗腹腔后,常规逐层闭合腹腔。
1.4 样本采集及指标检测
1.4.1样本采集及处理 各组大鼠分别于再灌注6,24,72,168 h后经心脏采血,抽取10 mL血液样本置真空采血管中,室温下静置约15 min后,常温低速离心机3 500 r/min离心15 min,将血清分装于1.5 mL离心管中,保存于-80℃冰箱用于后续实验室检测。
1.4.2肝功能检测 取各组6,24,72,168 h血清样本,按照AST试剂盒说明书进行操作,使用酶标仪在相应波长检测。
1.4.3血清氧化应激反应指标的检测 检测前取出各分组冻存于-80℃的血清样本,分别按照GSH-Px、SOD、MDA商品化试剂盒说明书进行操作,使用酶标仪在相应波长检测各时间点指标的含量。
1.4.4血清炎症反应相关指标的检测 检测前取出各分组冻存于-80℃的血清样本,分别按照TNF-α、IL-6、IL-1β、IL-10 ELISA试剂盒说明书进行操作,检测各时间点的含量。

2 结果
2.1 大鼠70%肝IRI损伤合并30%部分肝切除模型的建立在本研究中,大鼠模型为研究小体积肝移植术、肝肿瘤切除术及不规则肝切除术后肝IRI损伤提供了更贴近临床医学的动物模型,为防止出现肠道充血,采用高精准性分离并夹闭肝中叶和左外叶门静脉分支、肝动脉及胆管。再灌注前行肝左外叶切除术,恢复血供,模拟临床中小体积肝移植术、肝肿瘤切除术及不规则肝切除术等,以研究IRI后的肝功能。结果表明,再灌注前15 min行肝左外叶切除术可模拟临床中小体积肝移植术、精准肝切除术及不规则肝切除术等(图1)。

图1 大鼠70%肝IRI合并部分肝切除模型操作示意图
手术具体操作步骤:高精准分离并夹闭肝中叶和左外叶Glisson系统(图2A),成功建立70%肝缺血模型(图2B),再灌注前行肝左外叶切除,保留肝中叶并恢复血供(图2C),常规闭合腹腔。
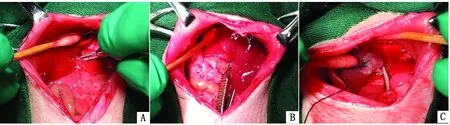
图2 大鼠70%肝IRI合并部分肝损伤模型试验
2.2 肝损伤大鼠血清中AST水平的变化假手术组AST再灌注后6 h升高,而后下降趋于平稳;模型组AST再灌注后6 ,24 h大幅度升高,极显著高于假手术组(P<0.01),而后下降趋于平稳,较假手术组差异不显著(表1)。
表1 不同时间点两组血清中AST变化 IU/L
2.3 肝损伤大鼠全身氧化应激的变化
2.3.1血清中抗氧化酶SOD水平 假手术组SOD再灌注后6,24 h下降,而后升高趋于平稳;模型组SOD再灌注后6,24 h大幅度降低,显著低于假手术组(0.01 2.3.2血清中抗氧化酶GSH-Px水平 假手术组GSH-Px再灌注后6 h下降,而后升高趋于平稳;模型组GSH-Px再灌注后6 h大幅度下降,极显著低于假手术组(P<0.01),而后升高趋于平稳,再灌注后24 h显著低于假手术组(0.01 表2 不同时间点两组血清中SOD变化 U/L 表3 不同时间点两组血清中GSH-Px变化 U/L 2.3.3血清中MDA水平 假手术组MDA再灌注后6 h升高,而后下降趋于平稳;模型组MDA再灌注后6 h大幅度升高,极显著高于假手术组(P<0.01),而后下降趋于平稳,再灌注后24 h显著高于假手术组(0.01 表4 不同时间点两组血清中MDA变化 μmol/L 2.4 肝损伤大鼠全身炎症反应变化 2.4.1血清中促炎细胞因子TNF-α水平 假手术组TNF-α再灌注后24 h升高,而后下降趋于平稳;模型组TNF-α再灌注后24 h大幅度升高,极显著高于假手术组(P<0.01),而后下降趋于平稳,再灌注后72 h显著高于假手术组(0.01 表5 不同时间点两组血清中TNF-α的变化 ng/L 2.4.2血清中促炎细胞因子IL-1β水平 假手术组IL-1β再灌注后24 h升高,而后下降趋于平稳;模型组IL-1β再灌注后24 h大幅度升高,显著高于假手术组(0.01 表6 不同时间点两组血清中IL-1β变化 ng/L 2.4.3血清中促炎细胞因子IL-6水平 假手术组IL-6再灌注后72 h下降,而后趋于平稳;模型组IL-6再灌注后24 h大幅度升高,显著高于假手术组(0.01 表7 不同时间点两组血清中IL-6变化 ng/L 2.4.4血清中抗炎细胞因子IL-10水平 假手术组IL-10再灌注后72 h升高,而后下降趋于平稳;模型组IL-10再灌注后72 h大幅度升高,极显著高于假手术组(P<0.01),而后下降趋于平稳,再灌注后24 h 显著高于假手术组(0.01 表8 不同时间点两组血清中IL-10变化 ng/L 肝IRI合并部分肝切除损伤引起的肝组织再生不足[6]和长时间缺血及再灌注造成严重的肝实质损伤,是造成临床上发病和死亡的主要因素。近年来,不少外科医生在动物肝切除模型中不断改进保护肝免受IRI损伤的手术方法。随着手术策略的改进,更加注重围手术期的护理及患者体况的选择,在肝切除术中研究了许多阻断入肝血流的外科技术,包括Pringle法、间歇性Pringle法和半肝血管阻断法等[7-9]。研究表明,Pringle法阻断全肝血流后,由于内脏器官的缺血和充血以及血液动力学的改变,增加了对其他肝叶的损伤[7]。而其他研究发现,门静脉阻断保留肝动脉血流的缺血方法可降低大出血和术后肝功能衰竭的风险[8]。以往的研究比较门静脉阻断保留肝动脉血流和Pringle法缺血30 min再灌注后对78%肝切除后发现,前者的肝再生率较高[9]。YIN等[10]报道了肝血流阻断30 min时会导致大鼠术后早期的DNA合成和肝细胞增殖减少,并抑制肝功能的恢复及轻微的可逆损害。在临床上,经常会遇到脂肪肝、肝硬化等并发症,比正常肝脏更敏感,进一步增加了术后预后不良的可能性,一旦切除,剩余肝脏不足以满足全身的需求,因此本课题组对以往的手术模型进行改进,成功建立了大鼠70%肝IRI合并30%部分肝切除损伤模型,在缺血期间行部分缺血肝叶的切除,减少再灌注后的失血量,以模拟临床上肝不规则切除术、肝移植等。 近年来研究发现,IRI损伤是全身性的,可导致多个器官、组织功能损伤,其中氧化应激和炎症反应起关键作用。本研究发现肝实质受损时释放大量AST,同时检测血清中氧化应激及炎症因子的变化,发现模型组机体内氧化应激和促炎因子的水平较假手术组均明显升高,证实大鼠70%肝IRI合并部分肝切除损伤可诱导机体氧化应激和炎症反应的发生。 SOD是动物机体内关键的抗氧化酶之一,可将超氧阴离子自由基还原为过氧化氢,减少细胞内堆积的超氧阴离子自由基[11]。GSH在中和自由基、减少脂质过氧化物的产生和保持细胞完整性方面起着关键作用[12],GSH和SOD在维持机体内氧化与抗氧化的平衡之间起着重要作用。MDA是机体内一系列脂质过氧化降解反应后的主要产物,其在机体内的浓度与机体清除自由基的能力呈正比,是反映肝组织受氧化应激损伤程度的间接客观标志[13]。本研究结果显示,模型组大鼠血清中SOD,GSH-Px酶水平在术后6,24,72,168 h各个时间点较假手术组均呈先下降后升高的趋势,在术后24 h时达到最低值,且显著低于假手术组。模型组大鼠血清中MDA水平在术后6,24,72,168 h各个时间点较假手术组均呈先升高后下降的趋势,在术后6 h达到峰值,且显著高于假手术组。GEDIK等[14]建立大鼠肝脏缺血45 min模型,血液供应恢复45 min后 SOD、CAT、GSH水平与正常对照组相比显著降低,MDA水平与正常对照组相比显著升高。葛延松等[15]利用腹腔镜技术建立小型猪右半肝缺血60 min 后行左半肝的切除,检测再灌注后1,3,7 d血清中SOD、GSH-Px和MDA水平,发现再灌注后SOD和GSH-Px随再灌注时间的延长呈先降低后升高的趋势,并在1 d时出现最低值;MDA水平随再灌注时间的延长呈先升高后降低的趋势,并在1 d时出现峰值。结合本研究结果,提示SOD、GSH和MDA在肝脏IRI合并部分肝切除损伤中维持机体氧化与抗氧化动态平衡中起着重要作用。 在IRI过程中,Kupffer细胞可能被激活,分泌大量细胞因子和趋化因子,细胞促炎因子TNF-α、IL-1β和IL-6在先天性免疫应答中起重要作用,而细胞抗炎因子IL-10具有负性免疫调节作用[16]。LIAO等[17]报道在大鼠70%肝脏缺血60 min 再灌注6 h后,促炎因子TNF-α、IL-1β、IL-6均较假手术组升高,抗炎因子IL-10较假手术组降低。孟伟静等[18]研究发现,在小型猪右半肝缺血60 min 后行左半肝切除,检测再灌注后2,6,1,2,3,5,7 d血清中TNF-α、IL-1β、IL-6较假手术组均显著升高,在术后1 d达到峰值,IL-10在术后3 d达到峰值。 大鼠70%肝IRI合并部分肝切除损伤可诱导机体氧化应激和炎症反应的发生,其机制可能与抗氧化酶水平的下调及促炎细胞因子表达增强有关。






3 讨论

