引起人工授精种鸡产蛋下降的鸭源鸡杆菌的分离鉴定
张玉杰,刘 东,孙 宁,刘红祥,高天佐,郭玉广,于 静,袁 飞,宋姗姗,王玉超,钟 声,马 冬,张宇龙,杜元钊*
(1.青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室,山东 青岛 266114;2.山东省青岛第一中学,山东 青岛 266002)
KJOS等[1]在1950年首次报道了鸭源鸡杆菌,CHRISTENSEN等[2]于2003年将巴氏杆菌科中的鸭巴氏杆菌、输卵管炎巴氏杆菌和溶血性巴氏杆菌单独成立为鸡杆菌属,BISGAARD等[3]于2009年进一步将鸭源鸡杆菌明确为鸡杆菌属的一个代表种。鸡、火鸡、鸭、鹅、鹦鹉、鹧鸪和珍珠鸡等[4]各种禽类中都可以分离出鸡杆菌,从具有不同临床症状的禽类中可以分离到不同的鸡杆菌属细菌[5]。研究表明,鸡杆菌可以从健康的禽类中分离到,有人认为这些细菌可能是上呼吸道和下生殖道正常微生物群的一部分[6];与此相反,诸多研究[7-12]从患生殖系统疾病的蛋鸡中亦可分离到鸡杆菌,并认为该病原菌是开产蛋鸡输卵管炎、输卵管囊肿和败血症的潜在致病菌,进而导致产蛋量和蛋的品质下降。此外,该病原菌还能造成患有免疫抑制疾病的鸡群较高的死亡率[13]。国内关于该菌的研究主要局限于菌株分离培养特性,但对于该菌在临床上的危害以及实验室相关动物回归试验数据尚无人论证。王川庆等[14]于2008年首次报道了鸭源鸡杆菌在我国的存在,郑鹿平等[15]于2010年从64只患输卵管炎鸡的不同脏器中分离鉴定到45株鸭源鸡杆菌,方翟等[16]于2014年从患腺胃肿大的10日龄雏鸡腺胃内分离到1株鸭源鸡杆菌。自2000以来,我国一些规模化种鸡场每批鸡群在开产后人工授精均会出现产蛋量和孵化率双双下降的情况,并且有愈演愈烈的趋势,给养鸡企业造成了巨大的经济损失。为弄清楚本病的病因,本研究从山东、辽宁和河南采集发病种鸡疑似样品,通过病毒和细菌的分离鉴定以及动物回归试验,确定了引起开产种鸡人工授精后产蛋量下降和孵化率下降的病原为鸭源鸡杆菌,进而为该病的深入研究奠定基础。
1 材料与方法
1.1 病料、鸡胚及实验动物64份病料样品(主要包括气管、肺脏、腹膜、肝脏、脾脏、胆囊、心脏、泄殖腔、卵泡、输卵管、睾丸和精液)来自2020年山东、辽宁、河南8个不同养殖企业的发病鸡场;6日龄、10日龄SPF鸡胚,购自北京梅里亚维通实验动物技术有限公司;11日龄SPF鸭胚,购自哈尔滨兽医研究所;188日龄海兰褐蛋鸡,购自河北华裕农业科技有限公司。
1.2 主要试剂LB培养基、TSA培养基、TSB培养基(美国BD公司);绵羊血平板培养基(青岛海博生物技术有限公司);马血清(HyClone公司);Column Viral RNAout(TIANDZ 71001);Premix TaqTM(TaKaRa TaqTMVersion 2.0 R004A);DL2000 DNA Marker (TaKaRa 3427Q);PrimeScriptTMOne Step RT-PCR Kit Ver.2.0(TaKaRa RR055A);pMD19-T Vector(TaKaRa 6013);E.coliDH5α competent cells(TaKaRa 9057);DNA gel extraction Kit(BioFlux BSC02M1);药敏片(杭州微生物试剂有限公司);鸡杆菌鉴定引物参考KORCZAK等[17]及BOJESEN等[18]方法,根据GenBank上公布的鸭源鸡杆菌16S rRNA序列,运用Primer 5.0软件设计引物,用于扩增16S rRNA基因全长,以上引物均由上海生工生物工程股份有限公司合成(表1)。
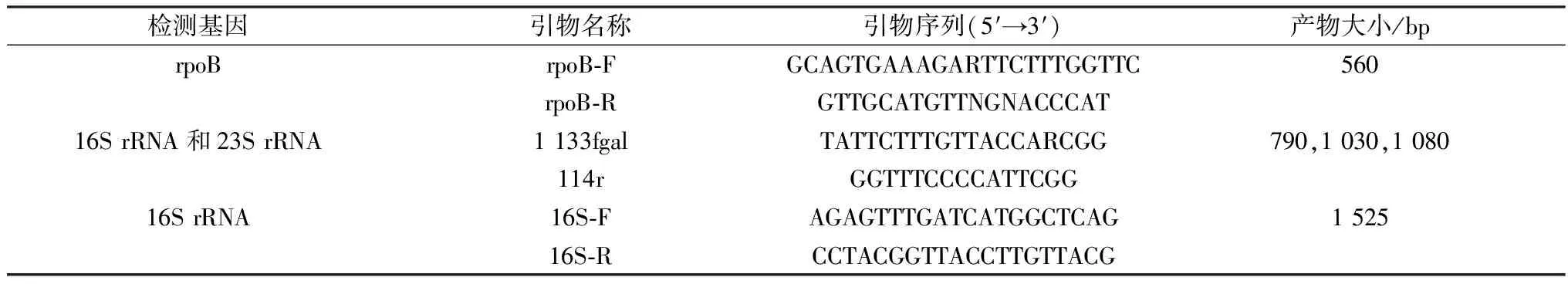
表1 引物序列
1.3 病毒分离无菌采集病鸡输卵管、卵泡和肝脏等组织,弃掉卵泡内卵黄,将卵泡膜、输卵管和肝脏剪碎后,加入适量生理盐水,匀浆器匀浆后加双抗各1 000 U,反复冻融3次,4℃、8 000 r/min离心15 min,吸取上清液,0.22 μm滤器过滤除菌。将上述滤液经尿囊腔接种10日龄SPF鸡胚20枚,12日龄SPF鸭胚20枚,0.2 mL/枚。接种后置于37℃生化培养箱恒温孵化。弃掉24 h内死亡的鸡胚和鸭胚,连续观察5 d,收获接种24 h后的鸡胚尿囊液和鸭胚尿囊液,-80℃冻存备用。按照上述方法盲传3代。
1.4 支原体的分离培养无菌取病鸡输卵管、卵泡,将卵泡内卵黄弃掉,用无菌生理盐水冲洗数遍后用高压灭菌后的研钵研磨输卵管和卵泡膜,加入适量的无菌生理盐水充分涡旋,4℃静置1 h,取上清用0.45 μm无菌滤器过滤除菌后经卵黄囊接种6日龄SPF鸡胚,37℃培养7 d。弃掉24 h内死亡的鸡胚,收获接种24 h后的鸡胚卵黄膜,并连续盲传3代。
1.5 细菌的分离、纯化及鉴定打开病鸡腹腔,剖开输卵管,用高压灭菌的棉棒蘸取输卵管壁表面和病变的卵泡表面后浸入盛有适量生理盐水的2 mL离心管中,无菌摘取公鸡睾丸置于超净工作台酒精灯周围,用烧红的刀片将睾丸纵向切开,用无菌棉棒蘸取睾丸内容物后浸入盛有适量生理盐水的2 mL离心管中,将以上样品充分涡旋后,吸取0.2 mL液体于3%马血清TSA平板上,并用涂板器涂抹均匀,37℃培养过夜;挑取疑似菌落于3%马血清的TSB培养基中,37℃、2 00 r/min摇菌培养过夜。参照文献[17-18],利用鸡杆菌保守基因rpoB、16S rRNA和23S rRNA鉴定引物对菌液进行PCR鉴定,将阳性菌液划线于3%马血清的TSA培养板上,如此重复直至TSA琼脂平板菌落单一。将纯化后的菌落分别接种麦康凯培养基、绵羊血琼脂平板,观察其生长特性。
1.6 药敏试验参照CLSI标准进行操作[19],采用K-B纸片扩散法对临床分离株进行药物敏感性测试,其中包括红霉素、林可霉素、普那霉素、阿奇霉素、阿莫西林、泰乐菌素、多黏菌素E、利福平、大观霉素、氟苯尼考、头孢噻呋、复方新诺明、丁胺卡那霉素、庆大霉素、磺胺甲恶唑、氟甲喹、恶喹酸、恩诺沙星、呋喃妥因、夫地西酸、甲硝唑 21种抗生素;采用琼脂平皿稀释法测定26株临床分离菌对以上21种药物的最小抑菌浓度(MIC),结果按照CLSI标准进行判断。
1.7 分离菌株的同源性及亲缘关系分析用16S rRNA基因全长引物对临床分离株进行PCR特异性扩增,将电泳得到的阳性目的条带回收后,连接pMD19-T载体并转化大肠杆菌 DH5α感受态,AMP+/LB固体培养基培养后挑取疑似菌落摇菌后送上海生工生物工程股份有限公司测序。用DNAStar软件将所测序列与GenBank中收录的巴氏杆菌科菌株进行同源性比对,用MEGA 6.0软件构建系统发育树。
1.8 动物回归试验将40只22周龄健康海兰褐蛋鸡平均分为5组,8只/组,饲养在装有通风管道并能提供过滤空气的封闭房间,光照、通风、饮水和饲料等严格执行海兰蛋鸡饲养管理方案。攻菌前1周,采集每只鸡的泄殖腔拭子和咽拭子样本进行细菌分离,所有试验鸡只鸡杆菌检测均为阴性。
鸡群在135日龄,开始按照表2试验设计进行试验,1,3组只进行1次攻菌,2,4组隔4 d进行2次攻菌,5组为对照。每天观察鸡只是否有临床异常,每日下午17:00点收集各组鸡蛋并记录数量。分别于攻菌后3,5,7 d采集每组鸡只的泄殖腔拭子和生殖道拭子(无菌棉棒进入深度至少6 cm)进行细菌分离,试验过程共持续31 d,试验结束后将所有鸡只处死尸检、取样并进行细菌分离。

表2 试验设计
2 结果
2.1 病毒及支原体分离培养66份样品接种SPF鸡胚和SPF鸭胚,经盲传3代,均无死亡现象,胚体无异常,尿囊液无血凝活性,未发现疑似病毒;经卵黄囊接种后,均未分离到支原体。
2.2 细菌的分离、纯化和鉴定结果从66份样品中分离到66株鸭源鸡杆菌,分离菌大多定植于开产母鸡输卵管和卵巢、性成熟公鸡精液和睾丸,其他脏器如肝脏、气管和肺脏等几乎分离不到,公鸡泄殖腔拭子排菌率亦较高,但母鸡泄殖腔拭子排菌率很低(表3)。
分离菌在TSA培养基上呈针尖样,添加3%马血清后生长旺盛,形成圆形、灰白、半透明、边缘整齐,直径1~2 mm的小菌落(图1A)。在绵羊血琼脂平板上呈β溶血(图1B)。光学显微镜下观察呈短小杆状,革兰染色阴性(图1C)。在麦康凯琼脂平板上不生长。

表3 66份样品中不同脏器鸭源鸡杆菌分离情况

图1 菌落在TSA(A)、血平板(B)及革兰染色后光学显微镜(C)下图片
2.3 药敏试验结果不同分离菌株对以上21种抗生素均存在较强的耐药性,只有庆大霉素和丁胺卡那霉素对个别菌株有一定效果,整体表现为该菌无敏感抗生素。
2.4 分离菌株的同源性及亲缘关系分析66个临床分离株的16S rRNA序列同源性高达99.9%,与GenBank中收录的鸭源鸡杆菌同源性最高,均在99.8%以上,处于同一进化分支(图2),这表明试验中的临床分离株细菌均为鸭源鸡杆菌。

▲.从不同鸡场分离的鸭源鸡杆菌菌株
2.5 动物回归试验结果试验1组自攻菌后3 d开始吃料速度减慢,采食量下降,较对照组减料最高5 g/d,持续时间为3~4周,然后开始缓慢恢复,期间试验3组无任何异常;试验2组1次攻菌后情况与试验1组一致,并于2次攻菌后2 d减料达到最高10 g/d(表4),持续时间为4~5周,然后开始缓慢恢复,同时于2次攻菌后5 d开始出现打蔫现象,个别鸡只拉黄色泡沫样稀粪,期间试验4组无任何异常;试验1组尤其是试验2组攻菌鸡只生殖道均出现严重程度不一的炎症反应,外翻困难,个别鸡只生殖道有炎性分泌物流出,与现场实际发病情况完全一致;整个试验过程中,对照组鸡只一切正常。
试验1组在攻菌后10 d出现一过性产蛋下降,但自攻菌后23 d开始,日产蛋率从87.5%~100.0%降到75%左右,并维持在这一水平(图3),所产鸡蛋蛋壳质量正常。试验2组自2次攻菌后5 d开始,出现剧烈的降蛋现象,日产蛋率从87.5%~100.0% 降到0.0%~25.0%,有的鸡只甚至绝产,随着时间的推移,日产蛋率开始逐渐恢复,但不能恢复到发病前的水平,最后日产蛋率在50%左右徘徊(图3);产蛋中后期个别鸡只所产鸡蛋蛋壳质量差,皮薄、易碎(图4A),绝大多数鸡蛋的蛋清和蛋黄正常,仅少数鸡蛋的蛋清稀薄。试验3,4组和对照组均正常。

表4 攻菌后各组鸡群的临床表现
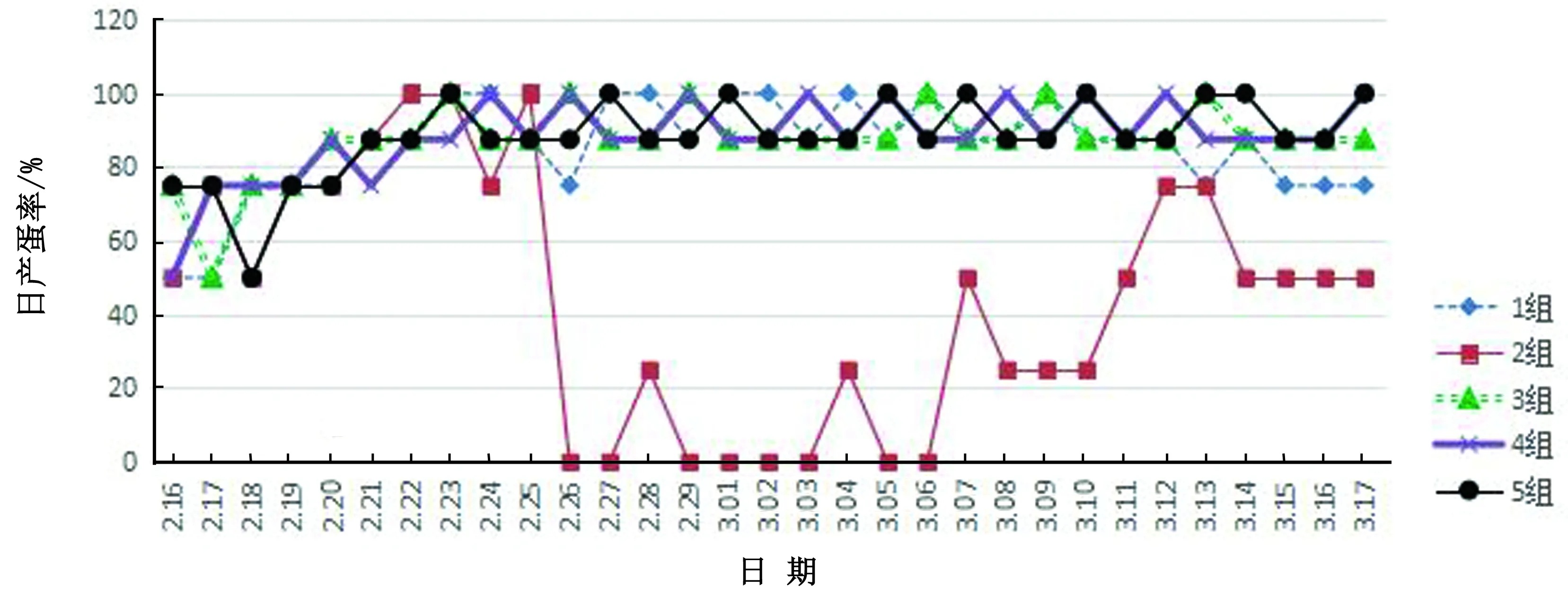
图3 攻菌前后各组鸡群的平均日产蛋量统计
试验1,2组自攻菌后3,5,7 d的泄殖腔拭子中极难分离到鸭源鸡杆菌,而从对应鸡只的生殖道拭子中均能分离获得大量菌落形态单一的鸭源鸡杆菌,但试验结束后的鸡泄殖腔和生殖道拭子均未分离到鸭源鸡杆菌(表5)。试验结束后,剖检所有试验鸡只,发现试验1组尤其试验2组鸡只均出现不同程度的生殖系统病变,卵泡充血、变形、液化,破裂后卵黄跌入腹腔形成腹膜炎,输卵管囊肿、积液、内有白色干酪物(图4B,C),与现场剖检变化一致,其他脏器无异常。试验3,4组和对照组均无异常。
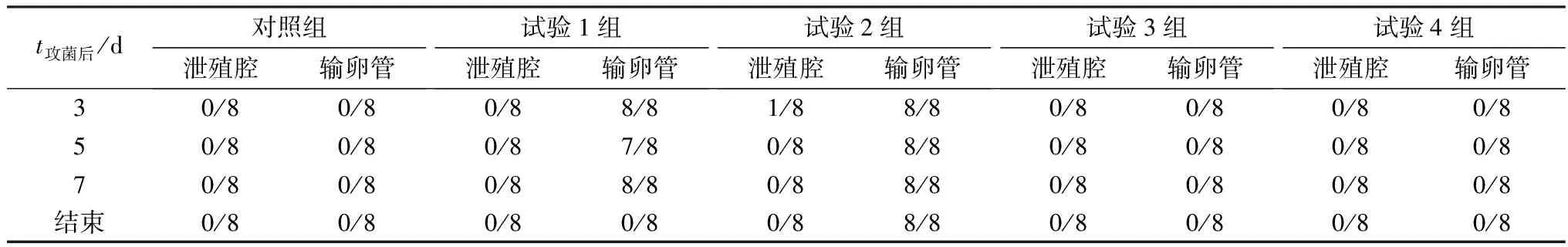
表5 攻菌后不同时间的细菌分离结果
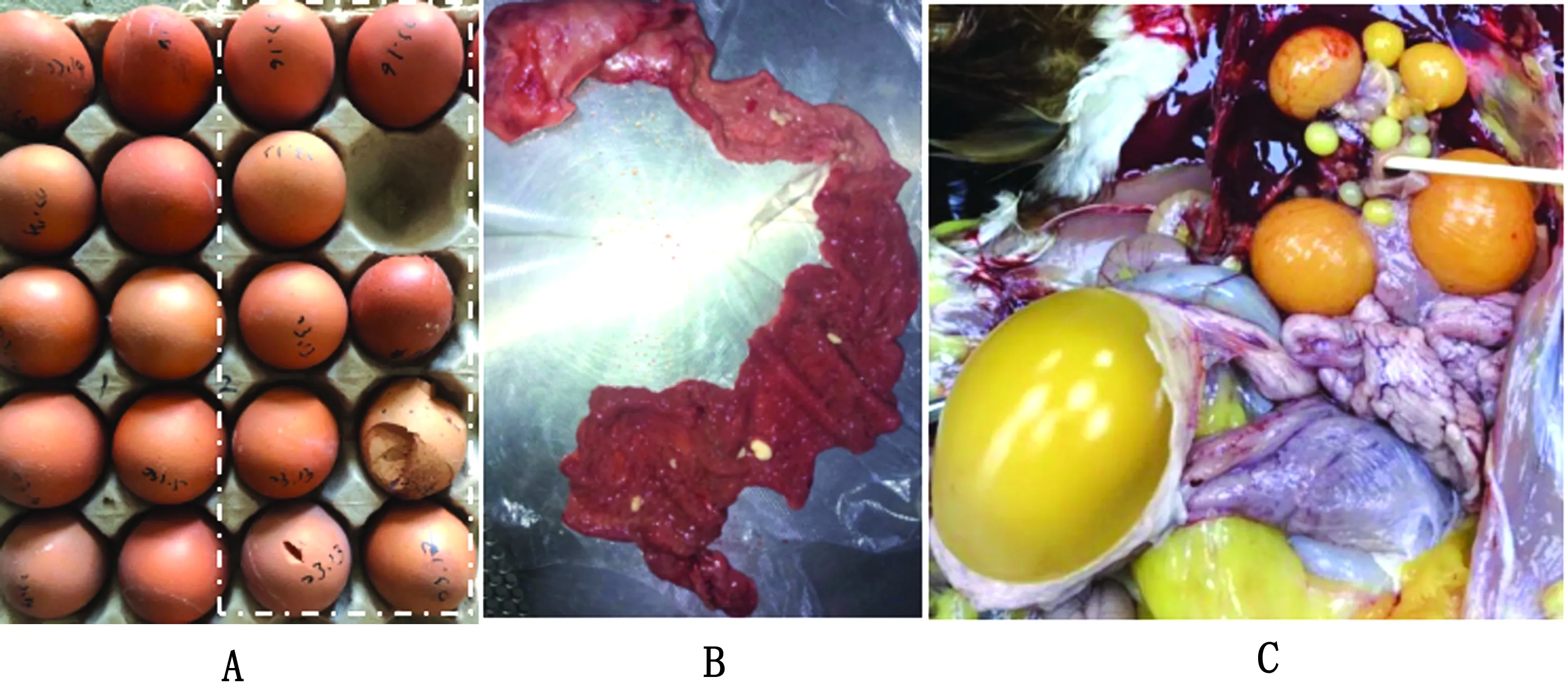
A.白色虚线框内为试验2组所产鸡蛋,左侧为试验5组所产鸡蛋;B.试验2组鸡输卵管;C.试验2组鸡输卵管和卵泡
3 讨论
鸭源鸡杆菌在鸡体内分布广泛,已报到该菌可以定植于鸡的呼吸系统、生殖系统和消化系统[20-23]。通过口鼻途径模拟自然感染的研究结果表明,在试验过程中能够从高频率的鸡上呼吸道检测到鸭源鸡杆菌,故而认为鸭源鸡杆菌感染的靶器官为呼吸道和生殖道,但鸡群上呼吸道既无任何呼吸表征又无肉眼和显微镜下可见的病变[24-25];后来,PAUDEL等[26]试验结果表明尽管可以不断从试验鸡上呼吸道中分离到病原,但该菌对呼吸道无致病性,却造成卵巢明显的损伤,因此认为鸭源鸡杆菌是一种专嗜生殖型而非呼吸型病原体[27-28]。本研究从发病公鸡睾丸、精液以及发病母鸡输卵管中分离到大量鸭源鸡杆菌,其他器官则较少,这与郑鹿平等[15]从气管分离率最高的研究结果有差别。首先,可能是发病时期不同,发病初期和发病后期的细菌分离结果对于病因的确定影响很大,前者采集的是发病初期样品,而后者采集是发病后期样品;其次,感染途径不同,前者人工授精是通过生殖道感染,后者自然感染是通过口鼻;是否符合“柯赫氏法则”,前者是从人工授精后发病母鸡的输卵管和公鸡的睾丸中分离到的鸭源鸡杆菌,并通过回归蛋鸡试验复制出了与临床发病完全一致的病例,而后者是从患输卵管炎的“假母鸡”体内分离到的鸭源鸡杆菌,且回归SPF鸡试验未复制出与临床发病完全一致的“假母鸡”病例。在2010年前后,我国蛋鸡发生了严重的“假母鸡”或“水袋子鸡”病,后经研究确定该病是由鸡传染性支气管炎病毒所引起[29-30],单纯的鸭源鸡杆菌并不能引起“假母鸡”或“水袋子鸡”现象,该菌可能是继发感染。基于以上研究,正常情况下,鸭源鸡杆菌主要存在于上呼吸道,生殖系统几乎不存在,鸡带菌却不发病,受应激等因素,一旦该菌侵入生殖系统,则引起严重的生殖障碍疾病。
鸭源鸡杆菌作为巴氏杆菌科鸡杆菌属中的代表种,人们对其致病性及致病机理一直不甚明确。NEUBAUER等[20]从患生殖系统疾病的蛋鸡体内分离到了鸭源鸡杆菌,并认为该菌与开产蛋鸡的产蛋下降、腹膜炎和输卵管炎有关;PAUDEL等[31]通过滴鼻攻菌的方式回归动物证明鸭源鸡杆菌可以导致SPF鸡发生产蛋量下降、蛋壳质量变差以及较低的死亡率。早在2000年前后,我国就有关于种鸡人工授精后产蛋下降的报道[32],当时由于试验条件的限制,大多认为该病是病毒性传染病,如鸡产蛋下降综合征(EDS-76)病毒、鸡传染性支气管炎病毒和禽脑脊髓炎病毒等[33-35]。本研究通过对分离菌回归蛋鸡试验验证,复制出了与临床发病相一致的病例,初步确定了引起开产种鸡人工授精后发生产蛋下降、蛋壳质量变差的病原为鸭源鸡杆菌,特别是通过模拟人工授精这一攻菌方式,直接佐证了该菌作用的靶器官主要是生殖系统,对该菌的致病机理研究具有重要意义。
王珊等[36]对我国部分地区的蛋鸡群进行了鸭源鸡杆菌血清学调查,检测样本的鸭源鸡杆菌抗体阳性率为45.06%,不同省份的血清抗体阳性率差别较大,罗曼鸡的血清阳性率比海兰鸡高,开产前蛋鸡的血清阳性率低于开产后,但鸡群健康,说明通过口鼻的自然感染途径难以使动物发病,即病原菌既不能引起鸡群呼吸道疾病,又难以到达感染的靶器官生殖系统,最终鸡群健康带菌。缘何临床上人工授精后的鸡群频频发病呢?推测原因,一是养鸡场内存在鸭源鸡杆菌污染,场内鸡群通过口鼻途径自然感染鸭源鸡杆菌并通过泄殖腔不断向环境中排菌,工人在采集公鸡精液过程中,鸭源鸡杆菌由泄殖腔通过精液上行感染至生殖器,严重的会进入公鸡睾丸内,鸭源鸡杆菌在公鸡睾丸内大量繁殖,产生的精液中含有大量鸭源鸡杆菌;二是采集不同公鸡的精液过程中存在严重的交叉感染现象,进一步对感染个体进行了放大;三是污染鸭源鸡杆菌的公鸡精液通过高频率的人工授精方式将鸭源鸡杆菌不断地输入开产母鸡生殖道,加之开产母鸡性成熟后生殖系统对外界刺激高度敏感,最终导致鸡群发病。
NASSIK等[37]首次从摩洛哥产蛋下降的蛋鸡分离到了鸭源鸡杆菌,分离株对恩诺沙星、氟苯尼考和庆大霉素敏感。一些研究[38]发现,随着抗生素的使用,鸭源鸡杆菌的耐药性会逐渐增强。DRIESSCHE等[27]从牛的支气管肺泡中分离到了一株广泛耐药的鸭源鸡杆菌,该分离株对各类抗生素均不敏感,同一农场分离到的不同分离株之间存在很大的遗传变异。本研究中分离的66株鸭源鸡杆菌对不同抗生素均存在较强的耐药性,这表明鸭源鸡杆菌在环境中存在已久,加之对该菌的危害以及防治缺乏科学的认识,大量滥用抗生素,导致该菌的耐药谱越来越广。一些前期报道敏感的抗生素如头孢菌素和阿莫西林等,对该菌已经不起作用,这说明该菌已经具有多重耐药性,在抗生素压力下,各地分离株获得的耐药基因越来越多。
临床上,许多人工授精病例还会出现种蛋受精率和雏鸡孵化率严重下降的情况,说明鸭源鸡杆菌具有垂直传播的潜在可能,这对养禽业影响很大。有研究[39-40]报道从患鸭源鸡杆菌的病鸡所产蛋中能够分离到鸭源鸡杆菌,虽然分离率较低,说明该菌可以垂直传播,但缺乏该菌对受精率和孵化率的研究。本研究受实验动物的限制,未能在种鸡上进行动物回归试验,后续的相关研究将围绕这点展开。
鉴于该菌较强的耐药性,普通抗生素又很难通过血-睾屏障和血-卵屏障,因此,该病需要严格的生物安全净化措施。通过药敏试验筛选敏感抗生素用于阴性鸡群的一般性预防及阳性鸡群的程序性治疗,商品化的疫苗可能对该病的防治具有事半功倍的效果。

