超表达SRD5A2基因对山羊卵巢颗粒细胞增殖和产羔相关基因表达的影响
洪 磊,陈 祥,唐 文,周志楠
(贵州大学 动物科学学院 高原山地动物遗传育种与繁殖教育部重点实验室/贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025)
类固醇激素是动物体内最主要的一类性腺激素,包括雄激素、雌激素和孕酮等[1],参与动物的生殖调控,与动物的繁殖性状密切相关。类固醇5α还原酶2(steroid 5 alpha-reductase 2,SRD5A2)是微粒体蛋白,能催化睾酮转化为二氢睾酮[2]。20世纪90年代初,ANDERSSON等[3]首先克隆了SRD5A2的2种异构体全长cDNA,分别命名为1、2型微粒体蛋白。SRD5A2基因决定着哺乳类(包括人类)胚胎生殖道原始细胞的分化和性别发育[4]。二氢睾酮结合雄激素受体后启动外生殖器发育,使其分化为男性型并促进前列腺发育,若该酶缺陷会引起男性型分化障碍。研究显示SRD5A2基因与生殖系统及前列腺组织发育有关[5],SRD5A2基因缺乏,会造成女性生殖能力低下的临床症状。ZI等[6]比较多羔金堂黑山羊和单羔藏羊卵巢基因转录表达情况,结果显示SRD5A2基因在多羔金堂黑山羊卵巢组织表达高于在单羔藏羊卵巢组织,推测其可能与金堂黑山羊高繁殖性能有关。ZOU等[7]对单、多羔川中黑山羊卵巢进行RNA高通量测序,结果发现SRD5A2基因在类固醇激素生物合成中显著富集。通过检测SRD5A2基因对山羊产羔性状相关基因表达量变化,有助于探究SRD5A2基因对黔北麻羊产羔性状的调控机制。而生长因子对动物卵泡发育有着极其重要作用,山羊繁殖相关基因包括转化生长因子超家族β(TGFβ)中的骨形态发生蛋白15(BMP15)、生长分化因子9(GDF9)和骨形态发生蛋白1B(BMPR-1B),他们是卵巢中启动卵泡发育以及调节排卵的必要生长因子[8-11],是山羊多羔性状候选基因。MIAO等[12]通过对济宁青山羊和莱芜黑山羊的卵巢RNA-Seq发现,miR-187和miR-874这2个miRNA可以通过调节BMPR-1B、SRD5A2等基因的表达而调控山羊的繁殖力。BMP15与GDF9基因共同作用于卵泡,影响优势卵泡的选择和闭锁卵泡的形成,调控颗粒细胞的增殖和分化。促卵泡素(FSH)是一种由垂体前叶分泌的糖蛋白激素,它与性腺细胞受体结合,促使颗粒细胞增殖,刺激类固醇合成,从而调节配子细胞的发育和成熟,FSH由α和β两个亚基组成,β亚基决定着FSH的生物活性[13]。促卵泡素β亚基(FSHB)在山羊繁殖过程中起着重要作用,是山羊高繁殖性状的主效基因。因此,SRD5A2基因是否通过影响产羔相关基因表达来参与调控山羊产羔性状,是本研究主要目的之一。
黔北麻羊是贵州地方三大优良山羊品种之一,具有良好的种质特性,如遗传性能稳定,抗病力强,合群性好,适应性强等特点[14],有较高研究价值。研究其多羔遗传分子机制,对培育多胎黔北麻羊新品系和提高黔北麻羊养殖效益具有重要意义。本研究通过克隆黔北麻羊SRD5A2基因,构建SRD5A2基因真核表达载体并培养黔北麻羊卵巢颗粒细胞用于转染,检测SRD5A2基因对细胞增殖和产羔性状相关基因表达的影响,为探究SRD5A2基因对黔北麻羊产羔性状调控的分子机制及提高产羔性能的研究提供基础。
1 材料与方法
1.1 实验动物实验动物来自贵州省习水县富兴牧业有限公司,选择健康的(2~3岁)黔北麻羊经产母羊6只,体质量均匀,平均体质量38 kg。参照贵州省地方标准《羊屠宰操作规程》(DB22/T 2740—2017)进行屠宰,采集卵巢组织,用75%酒精冲洗3次,置于含双抗的PBS溶液中保存,4~5 h内进行分离培养卵巢颗粒细胞及RNA提取。
1.2 主要试剂及仪器快速琼脂糖凝胶回收试剂盒、T-克隆PCR产物克隆试剂盒、pMD19-T载体连接试剂盒均购自生工生物工程技术有限公司(上海);氨苄青霉素、TOP10感受态细胞购自北京全式金生物技术有限公司; EcoRⅠ和BamHⅠ酶购自北京索莱宝科技有限公司;TRIzol试剂购自贵州绿盟英创生物科技有限公司;10×QuickCut Green Buffer购自宝生物工程(大连)有限公司;Hi Fi Script cDNA第1链合成试剂盒、高纯度质粒小提试剂盒等购自北京康为世纪生物科技有限公司;无内毒素质粒提取试剂盒、PBS溶液、DMEM/F12 1∶1培养基、胰蛋白冻等购自广州飞扬生物工程有限公司。
1.3 相关基因的引物设计根据NCBI上传的山羊SRD5A2、BMP15、BMPR-1B、GDF9、FSHB基因mRNA序列,以β-actin为内参基因,利用Primer 5.0 软件进行引物设计和酶切位点分析,在SRD5A2基因5′端添加EcoRⅠ和BamHⅠ酶切位点,由生工生物工程技术有限公司(上海)进行合成(表1)。

表1 PCR反应引物信息
1.4 总RNA提取及cDNA合成采用TRIzol法提取黔北麻羊的卵巢组织的总RNA,并吸取1 μL测定总RNA浓度和纯度,D260/D280值为1.8~2.0,-80℃保存。按照Hi Fi Script cDNA第1链合成试剂盒操作步骤反转录为cDNA,并进行浓度和纯度检测,D260/D280值为1.7~1.9,-20℃保存。
1.5 目的片段合成及回收以cDNA为模板,进行SRD5A2基因CDS区克隆,PCR反应体系(20 μL):2×Es Taq Master Mix 10.0 μL,10 μmol/L上、下游引物各 1.0 μL,无酶水5.5 μL,2 mg/L cDNA模板2.5 μL。PCR反应程序:95℃预变性3 min;95℃变性30 s,59℃退火45 s,72℃延伸30 s,35个循环;72℃终延伸5 min。用1%琼脂糖凝胶电泳检测扩增目的产物。将发光较亮且长度符合条带,按照胶回收试剂盒操作步骤进行目的片段回收,取1 μL反应产物于超微量紫外分光光度计进行浓度和纯度检测。
1.6 PCR产物连接与测序将胶回收产物与pMD19-T载体在16℃恒温下连接过夜。将连接液加入到TOP10感受态细胞中,冰上静置30 min,42℃水浴热激90 s,再次冰上静置20 min 后,加入不含抗生素液体培养基700 μL,固定于37℃培养箱振荡培养1 h,均匀涂布在制好的LB固体培养基(含有氨苄青霉素)进行培养。观察平板上菌落生长情况,挑取10个白色单菌落置于含有氨苄青霉素LB液体培养基中,振荡培养12 h,参照1.5反应条件PCR鉴定菌液。PCR产物用1%的琼脂糖凝胶电泳进行检测。挑选与目的条带大小一致的菌液送至生工生物工程技术有限公司(上海)进行测序。
1.7 SRD5A2基因真核表达载体构建及验证对重组基因质粒和pEGFP-N3空载体进行EcoRⅠ和BamHⅠ双酶切,使目的片段与pEGFP-N3载体具有相同的黏性末端,酶切体系如下:重组质粒/pEGFP-N3空载体8 μL,EcoRⅠ和BamHⅠ分别1 μL,10×QuickCut Green Buffer 2 μL,ddH2O 8 μL,37℃恒温水浴2 h。双酶切SRD5A2基因与pEGFP-N3真核表达载体连接,反应体系为0.2 μmol/L目的基因2.5 μL,500 mg/L pEGFP-N3载体1 μL,10×Ligation buffer 1 μL,T4DNA Ligase 0.5 μL,ddH2O 5 μL。连接过夜所得产物全部转化至大肠杆菌。转化及挑菌步骤与1.6相同,双酶切检测,筛选阳性菌液,并送至生工生物工程技术有限公司(上海)进行测序。
1.8 山羊卵巢卵泡颗粒细胞的培养与鉴定参考刘晓鹏等[15]方法,将采集新鲜健康黔北麻羊卵巢用75%酒精冲洗后,用灭菌PBS冲洗3~5次,完全去除残留的酒精后,在DMEM/F-12新鲜培养液中,用医用无菌注射器针头刺入卵巢的卵泡腔,吸取卵泡液,使卵泡液完全释放,吸取DMEM/F-12培养液吹打使得卵泡液和培养液混合均匀。将混合液吸入至10 mL无菌离心管,静置10 min后,将上层清液吸入到新的10 mL无菌离心管中,1 000 r/min离心10 min;弃去上清液,加入3 mL DMEM/F-12 培养液,轻吹混和均匀,1 000 r/min离心10 min,此步重复1次;弃去上清液,加入新配制的 DMEM/F-12培养液,含10%胎牛血清和1%双抗(100 IU/mL青霉素+50 g/L链霉素),轻轻吹打混匀,转移至培养瓶中,放置在培养箱中,37℃ 5%CO2下培养24 h,使用灭菌的PBS冲洗2次后,更换培养液继续培养。
采用免疫荧光染色法,鉴定分离培养的卵巢颗粒细胞纯度,操作步骤参考高可心等[16]的方法。
1.9 SRD5A2基因真核表达载体瞬时转染将卵巢颗粒细胞均匀分装至6孔板中培养,待细胞生长至80%~90%汇合度时,更换为含10%胎牛血清且无抗生素的培养基,利用LipofectamineTM3000CD Reagent转染试剂盒,按照说明书将重组质粒pEGFP-N3-SRD5A2与转染试剂混合,均匀地滴加到细胞培养板中,在培养箱中37℃ 5%CO2培养24 h后,使用倒置荧光显微镜观察细胞转染情况。
1.10 超表达SRD5A2基因对卵巢颗粒细胞增殖的影响将细胞分装于96孔板中,待细胞生长到90%左右的汇合度,更换为含10%胎牛血清且无抗生素的培养基,将pEGFP-N3-SRD5A2重组质粒转染到细胞,分别培养6,12,24,48 h后,更换100 μL新鲜培养基,然后再加入10 μL CCK-8试剂,37℃ 5%CO2培养箱中培养2 h,酶标仪检测D450值,分析超表达pEGFP-N3-SRD5A2基因对细胞增殖的影响。
1.11 超表达SRD5A2基因对产羔性状相关基因表达的影响收集空白组细胞和转染pEGFP-N3-SRD5A2重组质粒的细胞,TRIzol法提取细胞RNA,返转录合成cDNA,qRT-PCR检测山羊产羔性状相关基因SRD5A2、BMP15、BMPR-1B、GDF9、FSHB的mRNA在两组细胞中的表达量。
1.12 数据处理及统计分析采用2-△△Ct法计算,利用SPSS 22.0软件进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 黔北麻羊SRD5A2基因的克隆与测序利用卵巢组织反转录的cDNA为模板,扩增黔北麻羊SRD5A2基因CDS区,PCR结果如图1所示,扩增产物条带清晰度高、特异性强,未发现有引物二聚体,片段长度与预期片段大小723 bp一致。将扩增的CDS区序列与pMD19-T载体连接,连接产物转入大肠杆菌感受态细胞E.coliTOP10中,挑选菌落进行摇菌与测序。测序结果比对显示,黔北麻羊SRD5A2基因与NCBI登录的山羊相应序列具有高度同源性,同源性达到100%,说明已经成功构建黔北麻羊SRD5A2基因T克隆载体。

M.DL5000 DNA Marker;1~2.SRD5A2基因扩增片段
2.2 山羊卵巢颗粒细胞的培养鉴定由于FSHR在其他卵泡细胞中不表达,在卵巢颗粒细胞中专一性表达,因此,利用FSHR免疫荧光法鉴定分离培养的卵巢颗粒细胞。免疫荧光结果显示,加入FSHR抗体的阳性细胞发出红光,表明细胞分泌的FSHR蛋白与FSHR抗体结合(图2A),卵巢颗粒细胞的细胞核经DAPI染色呈现蓝色(图2B),细胞核染色和细胞质染色完全重合(图2C),说明山羊卵巢颗粒细胞培养鉴定成功,经鉴定细胞纯度高于90%,可以用于后续试验。

A.FSHR染色;B.DAPI染色;C.A+B合成图
2.3 黔北麻羊SRD5A2真核表达载体的构建及细胞水平的检测重组载体pEGFP-N3-SRD5A2经限制性内切酶EcoRⅠ和BamHⅠ双酶切,获得约4 692 ,723 bp 2个条带,分别为pEGFP-N3载体和SRD5A2基因CDS区片段,表明真核表达载体构建成功(图3)。将pEGFP-N3-SRD5A2重组质粒送上海生工生物工程公司测序,结果显示,黔北麻羊SRD5A2基因与NCBI上传的山羊SRD5A2基因的序列完全吻合。将重组质粒pEGFP-N3-SRD5A2转染到卵巢颗粒细胞中,24 h后在倒置荧光显微镜下观察发现,转染重组质粒的细胞在荧光显微镜下可观察到明显的绿色荧光,阴性对照组细胞未见有绿色荧光(图4)。
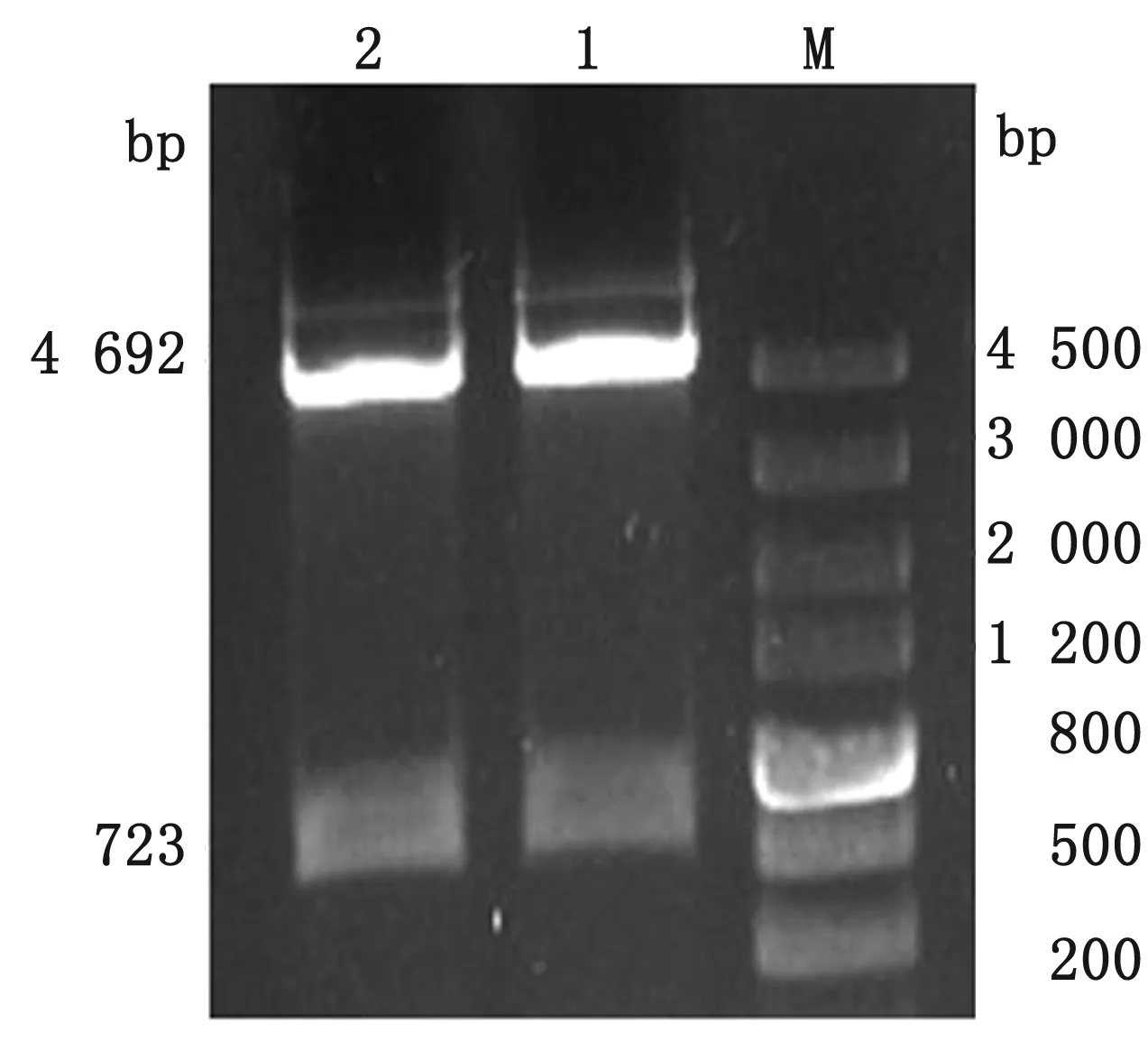
1,2.重组载体;M.DL5000 DNA Marker

A.空白对照组;B.N3空载体组;C.SRD5A2基因超表达组
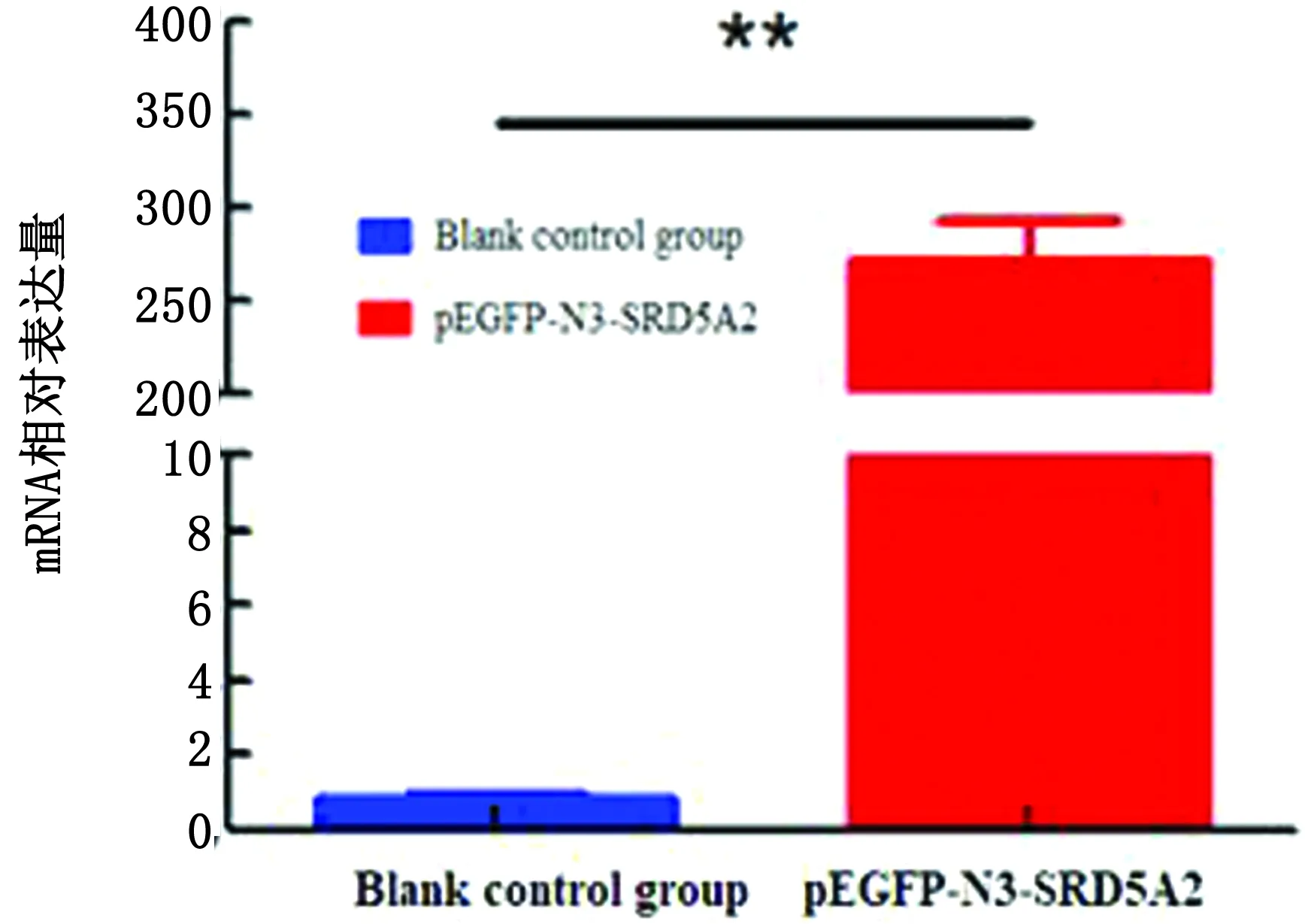
2.4 超表达SRD5A2基因转染效率检测超表达SRD5A2基因后,RT-qPCR检测结果显示(图5),转染组SRD5A2基因mRNA水平极显著高表达于空白组(P<0.01),说明pEGFP-N3-SRD5A2真核表达载体可以显著提高SRD5A2基因表达,SRD5A2基因超表达载体构建并转染成功,可进行下一步试验。
2.5 超表达SRD5A2基因对卵巢颗粒细胞增殖的影响CCK-8检测结果由图6可知,超表达SRD5A2基因对卵巢颗粒细胞增殖均具有促进作用,在6,12,24 h显著促进细胞增殖(P<0.05),48 h 达到极显著促进作用(P<0.01),初步证明SRD5A2基因能促进卵巢颗粒细胞增殖。
2.6 超表达SRD5A2基因对山羊产羔性状相关基因的影响转染重组质粒成功组细胞BMPR-1B、BMP15和FSHB基因的mRNA表达水平极显著高于空白对照组(P<0.01),GDF9基因mRNA表达水平显著高于空白对照组(P<0.05)。结果表明,超表达SRD5A2基因可促进产羔相关基因BMPR-1B、BMP15、GDF9、FSHB在黔北麻羊卵巢颗粒细胞中的表达(图7)。
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同

图6 超表达SRD5A2基因对卵巢颗粒细胞增殖的影响

图7 超表达SRD5A2基因对产羔性状相关基因的表达影响
3 讨论
SRD5A是一种位于细胞内质网膜上的蛋白质,能催化睾酮转化为另一种雄激素—二氢睾酮(DHT),在性分化及雄激素生理中发挥重要作用。目前已知,在人类和大鼠体内,至少存在2种5α-还原酶,即5α-还原酶1型和2型。研究显示SRD5A2基因参与调控哺乳类(包括人类)胚胎生殖道原始细胞的分化和发育性别,与动物繁殖密切相关。为了阐明SRD5A2基因在黔北麻羊产羔性能中的具体调控机制,本研究成功分离培养了黔北麻羊卵巢颗粒细胞,并构建pEGFP-N3-SRD5A2真核表达载体,进一步将载体转染至黔北麻羊卵巢颗粒细胞中,为后续研究该基因在卵巢颗粒细胞中的功能提供理想的试验材料。细胞增殖是生活细胞的重要生理功能之一,是生物体生长、发育、繁殖以及遗传的基础。研究发现抑制SRD5A2基因表达可以降低前列腺癌细胞增殖,说明该基因对前列腺癌细胞增殖具有促进作用[17]。超表达SRD5A2基因对卵巢颗粒细胞在6~48 h的增殖均具有促进作用,初步证明SRD5A2基因能促进黔北麻羊卵巢颗粒细胞的增殖。
产羔数是山羊重要的繁殖性状之一,受到多基因的调控。多羔候选基因BMPR-1B、BMP15、GDF9和FSHB等与羊产羔数存在一定的关联。本试验进一步研究超表达SRD5A2基因对黔北麻羊卵巢颗粒细胞中产羔相关基因表达的影响。GOYAL等[18]研究结果表明,BMPR-1B、BMP15和GDF9在绵羊黄体期卵巢中均高表达,在其他组织中也存在不同程度表达,说明这3个基因具有广泛生物学功能并在卵巢中发挥重要作用。BMPR-1B基因在绵羊卵巢中的颗粒细胞和卵母细胞中特异性表达,影响颗粒细胞分化和卵泡发育,具有促进排卵的作用[19]。本试验结果表明,超表达SRD5A2基因后,BMPR-1B基因在卵巢颗粒细胞中的表达显著提高(P<0.01),推测SRD5A2基因可能通过促进BMPR-1B基因在卵巢颗粒细胞中的表达来促进排卵,从而影响黔北麻羊产羔性状。BMP15是猪、牛、羊的多胎候选基因[20-22]。刘霜等[23]研究发现,BMP15基因在多羔金堂黑山羊卵巢中的mRNA表达量高于单羔藏山羊(P<0.05),说明卵巢中BMP15基因的表达量与金堂黑山羊多羔性状相关。相同的,CUI等[24]在单羔云岭黑山羊与多羔波尔山羊的比较研究中也发现,波尔山羊卵巢BMP15基因的表达量显著高于云岭黑山羊。GDF9基因是另一种影响绵羊多胎性的基因[25],主要由卵母细胞分泌,对卵泡的生长和分化、胚胎的发育起重要的调节作用。研究发现,高产的湖羊卵泡中的GDF9基因表达量显著高于低产的湖羊群体[26]。FSH和促黄体素(LH)都是糖蛋白类促性腺激素[27],是控制哺乳动物生殖的核心激素,由垂体前叶嗜碱性细胞合成和分泌。刘建斌等[28]研究发现,FSHB基因可能是影响小尾寒羊高繁殖性能的一个主效基因。同样,ZI等[29]研究报道,发情期高繁殖力乐至黑山羊脑垂体中FSHB基因的mRNA表达量显著高于低繁殖力藏山羊。本研究RT-qPCR结果显示,超表达SRD5A2基因后,BMPR-1B、BMP15、GDF9、FSHB基因的表达量均显著或极显著高于空白对照组。因此,结合前人研究结果,推测SRD5A2基因可能通过促进产羔相关基因的表达来参与调控产羔数量,进一步证明了SRD5A2基因与黔北麻羊产羔性状密切相关,具体的调控机制还有待深入研究。

