干扰素诱导的四肽重复序列(IFIT)基因家族蛋白抗病毒作用机制研究进展
许 凡,党 文,田 宏,郑海学
(中国农业科学院 兰州兽医研究,甘肃 兰州 730046)
干扰素诱导的四肽重复序列(interferon-induced proteins with tetratricopeptide repeats,IFIT)基因的发现,最早可以追溯到20世纪80年代,其中,人类干扰素刺激基因56(human IFN-stimulated gene 56,ISG56,正式基因符号IFIT1)就是一种IFIT基因,也被称为561基因[1-2],之后IFT2、IFIT3、IFIT5也陆续被发现,开启了IFIT基因家族研究,在近几年取得重大进展。IFIT蛋白对多种病毒表现出良好的抑制效果, IFIT蛋白本底表达水平较低,在Ⅰ型干扰素(type Ⅰ interferon,IFN-Ⅰ)的刺激下或病毒感染后高度表达[3]。当病原体入侵机体后激活宿主先天性免疫反应,诱导IFNs大量表达。这些IFNs进一步激活JAK-STAT通路,刺激细胞表达大量干扰素刺激基因(ISGs),启动宿主抗病毒免疫反应[4-5]。
不同类型的病原体均能诱导机体产生大量IFIT蛋白。病原体入侵宿主细胞,宿主细胞的病原识别受体(pathogen recognition receptors,PRRs)感受和侦测病原体相关的分子模式(pathogen associated molecular pattern,PAMPs),最终启动免疫应答[6]。 PRRs包括Toll样受体(Toll-like receptors,TLRs)与RIG-Ⅰ样受体(RIG-Ⅰ like receptors,RLRs),两者都可激活IFIT基因的表达[7]。TLRs家族根据分布特征主要分为普遍存在型(TLR1)、限制存在型(TLR2、TLR4、TLR5)以及特异存在型(TLR3)3类。TLRs激活后可使干扰素调节因子3(IRF3)和干扰素调节因子7(IRF7)磷酸化,随后磷酸化的IRF3和IRF7进入细胞核,诱导IFN-Ⅰ,IFN-Ⅰ进一步刺激IFIT蛋白的表达[8]。RLR家族主要包括黑色素瘤分化相关基因5(melanoma differentiation-associated gene-5,MDA-5),视磺酸诱导表达基因Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)以及遗传学和生理学实验室蛋白2(laboratory of genetics and physiology 2,LGP2)3类成员[9],分别由ifih1、Ddx58和Dhx58基因表达而来。双链RNA(dsRNA)或单链RNA(ssRNA)病毒入侵细胞后,其RNA暴露并被RLR识别,最终激活RLR信号通路。当RIG-Ⅰ和MDA-5被激活,可以进一步活化接头分子线粒体抗病毒信号蛋白(mitochondrail antiviral signaling,MAVS)[10]。RLR与MAVS之间的CARD-CARD相互作用可以激活干扰素激酶,进一步磷酸化激活相应的IRF3或IRF7,以及细胞核因子κB(NF-κB),诱导干扰素-α/β(IFN-α/β)表达[11]。IFN-α/β可通过自分泌或者旁分泌方式,诱导大量抗病毒基因表达,其中就包括 IFIT基因家族[7,11-12](图1)。

注:RLR和IFIT家族蛋白分别识别5′端修饰后双链RNA(dsRNA)、单链RNA(ssRNA)信号通路以及5′端修饰的化学结构[13-14]
2 IFIT基因家族的基因结构和蛋白特征
IFIT家族基因只存在于鸟类、哺乳动物类、鱼类、两栖动物中,在酵母、线虫、植物等低等生物中未有报道。IFIT家族基因主要有4个成员,分别为IFIT1/ISG56、IFIT2/ISG54、IFIT3/ISG60和IFIT5/ISG58[15],其中IFIT5只在禽类中有报道[16]。IFIT家族成员都是由 2个外显子和1个内含子组成:第1个外显子只编码5′-UTR(untranslated region) 区和起始密码子区,第2个外显子编码CDS(coding sequences)区和3′-UTR 区。在TATA Box启动子的上游200 bp左右有干扰素刺激应答元件(IFN stimulated response elements,ISRE),这是唯一可识别的顺式作用元件[15]。IRF具有识别这些元件的能力,各种刺激因素也可激活这些元件,并诱导相应的mRNA进行转录过程。不同的IFIT 家族成员所具有的ISRE的数目存在差异[17],其中IFIT1、IFIT2和IFIT3有2个ISRE,而IFIT5有3个ISRE[18](图2)。
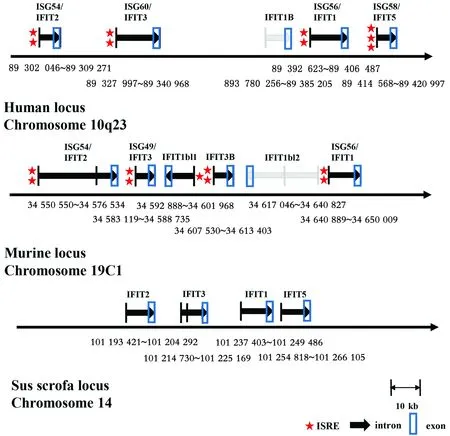
注:标记了外显子与内含子的结构以及开放阅读框(箭头方向所示);ISRE在启动子中的位置(星号表示)和数量(星号个数),其中猪的基因中ISRE数量未知[15]
IFIT蛋白家族相对分子质量为54~56 kDa,其特征是具有多拷贝串联阵列的螺旋-转角-螺旋基序形成螺旋管式支架结构,即由34个退化的氨基酸组成的螺旋-折叠-螺旋构象的三角形四肽重复(tetratricopeptide repeats,TPRs)结构域[18],这种结构域可介导多种蛋白-蛋白之间的相互作用,涉及翻译起始、病毒复制、细胞迁移和增殖等[19]。IFIT家族成员间的TPR数量各不相同。IFIT2有9个TPR结构,以二聚体形式存在,其C端部分折叠成超螺旋结构,并在内表面有带正电荷的核苷酸结合通道,可以特异性的结合富含AU的RNA或RNA元件[20]。IFIT5拥有8或9个TPR结构,形成钳夹结构,内侧正电荷,外侧负电荷,空隙处可识别特定的RNA结构[21]。这种结构使得IFIT基因可以在抗病毒应答中发挥重要作用。
IFIT蛋白家族具有以下特点:α/β-干扰素可以诱导一定数量具有相互作用的蛋白发生实质性变化,即IFIT1、IFIT2和IFIT3这3个蛋白只有在他们相互结合时,才会在α/β-干扰素的诱导下大量表达;IFIT蛋白可以通过招募其他细胞蛋白,并与它们组装成干扰素,进而触发一系列的细胞免疫机制来发挥功能。其中IFIT1B(IFIT蛋白家族中的亚类)可以与IFIT3进行连接,并相互交流,传递信息[22]。
3 IFIT基因家族蛋白的抗病毒作用机制
3.1 IFIT通过结合发生特定变化的病毒RNA来抑制其复制和转录多数原核细胞通过rRNA和tRNA 5′端的单磷酸与mRNA的N7-甲基鸟苷帽(cap0)结合形成5′-三磷酸盐桥连接到第1个碱基,并招募RNA翻译起始的细胞因子启动翻译[23]。大多数真核细胞进行蛋白翻译时则依赖于mRNA的5′端的帽结构且N-7和2′-O的甲基化结构,产生cap1(m7GpppNmN)或cap2(m7GpppNmNm)结构[24],cap1和cap2成为了真核细胞进行翻译的关键。研究表明,RNA 5′端的构成,包括其cap结构及甲基化状态,是宿主识别自身和非自身的决定性因素。有趣的是,在人和小鼠模型的研究中证明,小鼠肝炎病毒(mouse hepatitis virus,MHV)感染后,在IFIT1、IFIT2和IFIT3中只有IFIT1介导了IFIT复合物与cap-RNA的结合,并且有直接的相互作用,而IFIT5仅仅只与ppp-RNA结合,不与cap-RNA结合,因此IFIT1的特异性结合对于人和小鼠的IFIT复合物与其RNA靶标的募集是必不可少的[25]。是否可以找到一种方法,使病毒2′O位置不发生甲基化反应,或消除其甲基化,从而更加利于IFIT1或IFIT5蛋白的结合,发挥抗病毒效应。
3.2 IFIT通过结合病毒RNA 5′端的三磷酸碱基抑制病毒RNA复制当单链RNA病毒在进入宿主后,会在5′端生成1个三磷酸基团,即ppp-RNA结构,便于病毒复制,也可区别于宿主RNA。IFIT1和IFIT5蛋白具有1个内为正电荷,外为负电荷的闭合钳夹结构,此结构通过识别5′-RNA片段来鉴别细胞和病毒的mRNA,并以非序列特异性方式直接结合病毒的ppp-RNA并相互作用,启动宿主的抗病毒反应,抑制水泡性口炎病毒(vesicular stomatitis virus,VSV)和流感病毒(influenza virus)病毒RNA复制(图4)[26]。同时,IFIT2和IFIT3在抗病毒免疫中可以形成复合物稳定此结构,其中IFIT3通过YxxxL基序可以与IFIT1结合为二聚体,促进IFIT1与寨卡病毒(Zika virus)的mRNA中cap0结构的结合,使IFIT1稳定表达,发挥两者结合作用保证反应的进行[22,27-29]。而宿主细胞的RNA通常有cap1或cap2甲基化结构,避免了与IFIT结合,防止发生自身免疫,影响正常生理活动。
在最新研究中, IFIT1和IFIT5与mRNA配体相互作用的动力学分析显示,cap结构的改变对IFIT1/RNA复合物的稳定性有较大的影响,其中,IFIT1与GpppG/A- 和 m7GpppG/A-RNAs形成的复合物最为稳定,而对于IFIT5来说,含有NAD+和NADH作为帽结构的RNA与IFIT5结合后,其动力学参数与IFIT5结合pppG-RNA后的参数相当[30]。此研究向大家展示了含有NAD+和NADH帽子结构的RNA具有与pppG为帽子结构的RNA相同的作用,可以结合IFIT5,参与免疫反应,保护机体。那么,是否可以通过人为的方式在RNA末端添加或使其较容易形成NAD+和NADH的帽子结构,抑制病毒复制,为对抗病毒感染提供新的研究思路。
3.3 IFIT可竞争性结合elF3间接抑制病毒翻译过程IFIT基因家族还可以通过另外一种途径抵抗病毒侵袭。真核细胞翻译起始因子(eukaryotic initiation factor 4E/4F,eIF)elF3,是一种可以调控某些蛋白翻译的多亚基蛋白复合物,通过与elF2-GTP-MET-tRNA三聚体和40S亚基结合形成43S起始复合物,再结合到病毒5′端mRNA 的cap结构形成43S-mRNA复合物,从而开始翻译相应蛋白[31]。在抗病毒免疫中,IFIT不但可以通过与elF2-GTP-MET-tRNA三聚体竞争性结合eIF3来抑制43S复合物的形成,还能够紧密结合到病毒未甲基化的cap0-mRNA上面,从而抑制丙型肝炎病毒(hepatitis C virus,HCV)5′端mRNA cap结构蛋白质的翻译(图3)[25-26,32],而eIF3在随后的蛋白质合成过程中抑制了细胞核病毒中60%以上的翻译过程,起到抑制病毒增殖的功效[33-34]。
3.4 IFIT可直接结合病毒表面蛋白阻碍病毒复制IFIT1还可以通过直接结合病毒的蛋白,防止其进入细胞核来抑制病毒复制。病毒的E1解旋酶蛋白具有ATP酶和DNA解旋酶活性,是病毒复制所必须的蛋白。在IFIIT1抑制人类乳头状瘤细胞病毒(human papilloma virus,HPV)研究中发现,IFIT1可直接结合HPV的E1解旋酶,使其滞留在细胞质内,防止进入细胞核内形成复合体结构,有效地抑制了病毒的复制[35]。
3.5 IFIT通过调节多种细胞因子发生关联作用间接抑制病毒复制IFIT1通过破坏MITA蛋白(可以激活IRF3的介质)、MAVS(可发挥线粒体抗病毒作用的信号蛋白)以及TANK结合激酶1(tANK binding kinse 1,TBK1)之间的相互作用来负反馈调节细胞的抗病毒反应,而这些相互作用的传递源自于RLRs识别的病毒信号。IFIT1的过表达也可抑制仙台病毒(Sendai virus,SeV)诱导的IFN-β、NF-κB和IRF-3的激活作用[36](图3)。IFIT1和IFIT2可直接与eIF3结合,抑制病毒基因的转录;IFIT1、IFIT2和IFIT3在细胞质中形成复合物,识别和杀死病毒的ppp-RNA;同样的,IFIT5也可直接对ppp-RNA产生杀伤作用。IFT1干扰MITA、MAVS和TBK1之间的相互作用,从而负反馈调节细胞的抗病毒反应。IFIT2与MITA相互作用,通过先天性免疫反应诱导的线粒体途径诱导细胞发生凋亡。IFIT3在线粒体中连接TBK1和MAVS,协同加强IRF3和NF-κB的激活,进一步激活细胞的免疫应答。
IFIT5作为禽类中唯一存在的IFIT家族成员,发挥着保护禽类抵抗病毒,免受侵害的重要功能。VANDERVEN等[37]研究发现在鸭肺部感染高致病性甲型流感病毒(IAV)后,通过qRT-PCR测定,IFIT5的表达量明显上升。近年,WU等[38]在鸭胚成纤维细胞(DEFs)感染鸭坦布苏病毒(duck Tembusu virus,DTMUV)研究中也发现,鸭IFIT5(duIFIT5)的过表达可以显著抑制IFN-β的转录和IFN-β启动子的激活,并且能够明显抑制NF-κB和IRF7启动子,以及下游IFN诱导的干扰素刺激反应元件(ISRE)启动子的激活,以此来调节DTMUV的复制并抑制病毒激发的先天性免疫应答,起到保护宿主的作用。
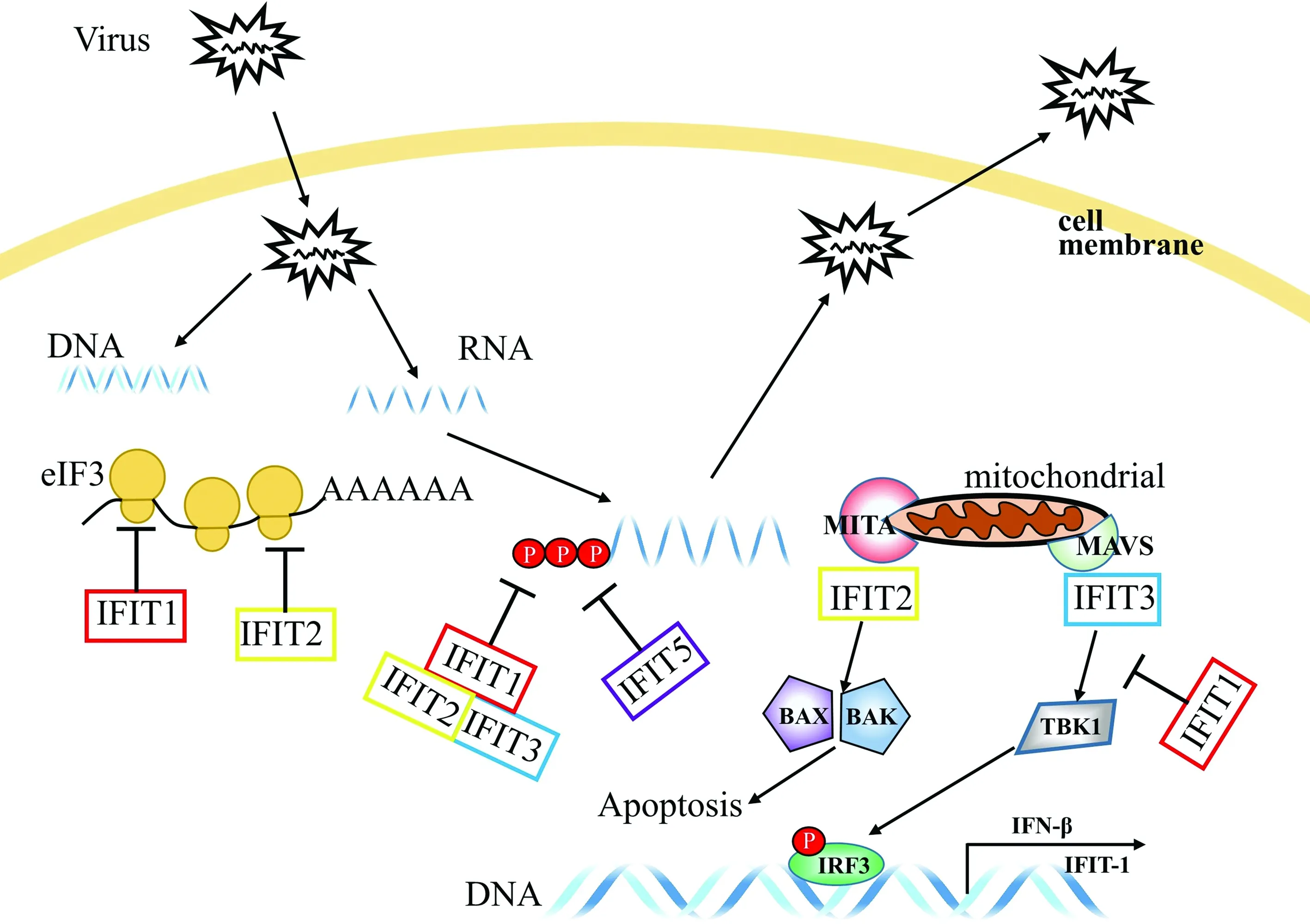
图3 IFIT家族基因的抗病毒和免疫调节功能
4 总结与展望
近些年来,随着人类活动的日益频繁,不同地理位置的人与人之间的联系日益密切,一些传染病和新发病的传播更加频繁,给人和畜禽的生命安全带来了巨大威胁。在此之下,通过先天性免疫途径保护生命健康问题已成为了研究的热门,其中IFIT基因家族作为干扰素刺激因子中的关键因子,在抗病毒免疫的研究中发挥着重要的指示作用,能够帮助我们更深入的了解宿主的抗病毒机制。
人类至今已经发现IFIT基因家族针对不同病毒保护机体的多种抗病毒策略。IAV可通过水禽、野鸭等在野生鸟类中自然传播,并可扩散到其他物种,包括人类,导致人类暴发较高的并发率和死亡率[39]。HOU等[40]研究证实,人感染IAV后,可在体内检测到IFIT1、IFIT2、IFIT3的表达量显著上调,而流感病毒的复制和转录明显下降。巨细胞病毒(cytomegalovirus,CMV)是疱疹病毒组DNA病毒,可引起以生殖泌尿系统、中枢神经系统和肝脏疾患为主的各系统感染[41]。ZHU等[43]研究表明,人感染CMV后的8 h,IFIT2可大量表达[42]。腺病毒(adenovirus)是一种双链DNA病毒,可诱发呼吸道的感染。ZHAO等[44]发现,在腺病毒感染后,机体IFIT1和IFIT2被激活表达,参与抗病毒反应。汉坦病毒(Hantan virus, HTNV)是一种负链RNA病毒,可引起肺部和肾脏严重病症,危害人民生命[45]。当内皮细胞受HTNV感染时,IFIT3被大量诱导表达,激发体内抗病毒反应[46]。猿猴病毒40是一种微小、具有DNA的乳头状瘤空泡型病毒,能诱导细胞转化,已被广泛的用于基础研究及基因工程载体的组建[47]。在RATHI等[48]研究中发现,猿猴病毒40可诱导细胞IFIT基因显著上调
IFIT基因家族拥有良好的抗病毒作用的发现,使人们在先天性免疫研究领域取得重要进展。总结前人的经验与成果,是否可以通过调控某些免疫通路中的某个因子,或通过人为因素修饰病毒,使机体对于病毒更加敏感,识别更加精准,捕获更加灵敏,从而发挥进一步的清除功能,保护机体。
到目前为止,尽管在IFIT基因家族的抗病毒机制上的研究已取得阶段性进展,在DNA、RNA病毒上,IFIT基因都能发挥抗病毒作用,但如何使IFIT基因家族发挥出最大、最好的抗病毒效应,IFIT基因家族又是如何从体内清除病毒的,是科研人员需要进一步研究的问题,从而为疾病治疗和药物研发奠定理论基础。

