精子发生调控因子重组人HSF5的原核表达、活性检测与结构预测
钟洪莉,肖城良,史祥睿,代宇婕,刘 威*,张庆华*
(1.陆军军医大学大坪医院 妇产科,重庆 400042;2.华中科技大学 生命科学与技术学院,湖北 武汉 430065;3.沈阳化工大学 化学工程学院, 辽宁 沈阳 110021; 4.陆军军医大学 全军免疫研究所, 重庆 400038)
热休克转录因子(heat shock transcription factors,HSFs)是真核生物中一个重要的转录因子家族,在细胞应激、分化、组织发育与机体繁殖中发挥了重要作用[1]。人类基因组共编码6种HSFs:HSF1、HSF2、HSF4、HSF5、HSFX和HSFY,均可识别并结合目的基因启动子中的热休克元件(heat shock elements,HSEs)。男性不育是一个全球性的健康问题,精子质量下降是男性不育的主要原因,HSF家族与精子发生关系密切[2]。最新研究报道hsf5编码基因缺失的斑马鱼,雄性出现严重不育[3]。由于之前HSF5的相关研究甚少,阻碍了人们对于其活性机制的进一步研究。与其他HSFs类似,HSF5包含多个结构域,其中有一个高度保守的DNA结合结构域。目前已知,该蛋白仅在睾丸中表达,但具体功能未知。本研究目的在于获得可溶性重组人源HSF5(recombinant human HSF5,rhHSF5)蛋白的表达,并对其与热休克元件结合的结构模型进行预测,为进一步解析HSF5结构、揭示HSF5的调控机制提供条件,为不育的治疗干预提供可能。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒:质粒pET-22b(+)、大肠杆菌菌株DH5α和菌株BL21(DE3)为本实验室保存。
1.1.2 主要试剂盒:包含HSEs的寡聚核苷酸(北京擎科新业生物技术有限公司);质粒抽提试剂盒(Omega公司);SDS-PAGE凝胶配制试剂盒、考马斯亮蓝染色液、Bradford蛋白质量浓度测定试剂盒(上海碧云天生物技术有限公司);蛋白marker、DNA ladder(赛默飞世尔科技有限公司);鼠抗His-Tag一抗(Cell Signaling公司)、羊抗鼠抗体二抗(Elabscience公司)。
1.2 方法
1.2.1 重组质粒的构建:通过多序列对比,选取人源HSF5蛋白DNA结合结构域(DNA-binding domain, DBD)部分氨基酸序列,交由华大公司进行基因合成并构建重组质粒。
1.2.2 重组蛋白的小剂量诱导表达:将合成的重组质粒转化到 BL21(DE3)菌株,涂布于含有100 μg/mL氨苄青霉素的LB琼脂平板上,挑取单克隆扩大培养过夜。次日,吸取200 μL菌液接种于含有100 μg/mL氨苄青霉素的20 mL LB液体培养基中,37 ℃、200 r/min振荡培养4 h。到时间后吸取1 mL菌液于含有100 μg/mL氨苄青霉素的100 mL液体LB培养基中,37 ℃、200 r/min振荡培养3 h。到时间后各吸取5 mL菌液到6个小型锥形瓶中,分别加入终浓度0、0.2、0.4、0.6、0.8和1 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG),37 ℃、200 r/min诱导表达4 h。
1.2.3 Western blot检测rhHSF5的表达:将蛋白样品进行上样、电泳、转膜,用牛奶封闭后一抗孵育过夜,PBST洗3次后进行二抗孵育1 h,PBST洗膜后ECL显色,并置于VILBER成像仪中曝光,后定量分析条带。
1.2.4 rhHSF5的大剂量诱导表达:根据小剂量表达的结果,将合成的重组质粒经转化和扩大培养后取40 mL菌液接种于4L LB液体培养基(含100 μg/mL氨苄青霉素),37 ℃、200 r/min振荡培养3 h后加入终浓度0.8 mmol/L IPTG进行诱导,37 ℃、200 r/min再振荡培养4 h。
1.2.5 rhHSF5的纯化
1.2.5.1 Ni离子亲和层析纯化:收获诱导表达的菌液,6 000 r/min离心15 min,收集细菌沉淀,重悬于裂解缓冲液(50 mmol/L NaH2PO4,50 mmol/L Na2HPO4,500 mmol/L NaCl,25 mmol/L咪唑,pH 8.0)中。800 bar(1 bar=100 kPa)高压破碎后,4 ℃,9 000 r/min离心1 h,取上清液用0.45 μm微孔滤膜过滤后,上样于用裂解缓冲液平衡好的HisTrap亲和层析柱。使重组蛋白羧基端的His6标签结合于固化的Ni树脂,再用洗涤缓冲液(50 mmol/L NaH2PO4,50 mmol/L Na2HPO4,40 mmol/L咪唑,5%甘油,pH 8.0)洗掉杂蛋白,最后用洗脱缓冲液(50 mmol/L NaH2PO4,50 mmol/L Na2HPO4,40 mmol/L咪唑,5%甘油,pH 8.0)洗脱目的蛋白。
1.2.5.2 凝胶过滤层析纯化:上一步收得的目的蛋白加入蛋白浓缩管中于4 ℃,5 000 r/min离心至样品体积浓缩至约1.5 mL,上样于Hiload 16/60 Superdex75凝胶过滤层析柱,用洗脱缓冲液(150 mmol/L NaCl,20 mmol/L Tris,1 mmol/L DTT,0.2 mmol/L EDTA,5%甘油,pH 8.0)洗1.5个柱体积,收集洗脱峰。
1.2.5.3 纯化蛋白的SDS-PAGE检测:将上一步收集的洗脱峰蛋白取20 μL,同离心后的沉淀、抽滤后得到的上清液、Ni离子亲和层析纯化的穿过峰部分、洗涤缓冲液冲洗部分、洗脱峰部分,各取20 μL加入5 μL考马斯亮蓝染色液,于沸水中加热5 min后,各取5 μL加入12% SDS-PAGE上样孔。
1.2.6 凝胶迁移实验检测重组蛋白活性:将纯化后收集的蛋白加入蛋白浓缩管中于4 ℃,5 000 r/min离心30 min,随后测其蛋白浓度以及热休克元件浓度。准备7支0.2 mL PCR小管,每支按比例依次加入凝胶迁移实验(electrophoretic mobility shift assay,EMSA)缓冲液、rhHSF5蛋白、包含HSEs的寡聚核苷酸。使用PCR仪30 ℃孵育20 min后每支加入10×上样缓冲液2 μL。混匀后每支各取10 μL上样于加入GoldView染料的2%琼脂糖凝胶上,进行电泳。
1.2.7 HSF5蛋白结构的预测:采用Modeller软件[4-5],参考蛋白质数据库(Protein Data Bank, PDB),以本实验室所解析的人源HSF1(PDB ID 5HDG)、HSF2(PDB ID 5HDK)[6]与HSF4(PDB ID 6J6V)[7]结构为模版进行HSF5-DBD的同源建模。使用分子可视化程序(visual molecular dynamics, VMD)对建模后的HSF5模型进行三点式可变换分子间势能函数(transferable intermolecular potential 3 points, TIP3P)模型溶剂化处理,再使用并行分子动力学(NAMD)程序,采用哈佛高分子力学化学(chemistry at Harvard macromolecular mechanics, CHARMM)力场、周期性边界条件与粒子网格埃瓦尔德(particle Mesh Ewald, PME)静电相互作用算法,对该体系进行能量最小化(100步)与压力-体积-温度(pressure-volume-temperature, PVT)平衡(时长500 ps),提取最后构象作为最终模型。
1.2.8 HSF5结合HSE复合物的结构预测:以人源HSF2与HSE(12 bp,含两个蛋白结合位点)的复合物晶体结构(PDB ID 5D8K)[8]为模版,将其中的两个HSF2-DNA结合结构域用上一步所获得的HSF5模型替换,并使用相同方式对替换后的模型进行分子动力学模拟,提取最后构象作为最终模型。使用VMD与蛋白可视化程序(PyMOL)对模拟结果进行了可视化处理与分析。
1.3 统计学分析
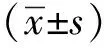
2 结果
2.1 重组人源HSF5蛋白的小剂量诱导表达
IPTG浓度为0.2、0.4、0.6、0.8和1 mmol/L时,rhHSF5蛋白均有表达(图1)。
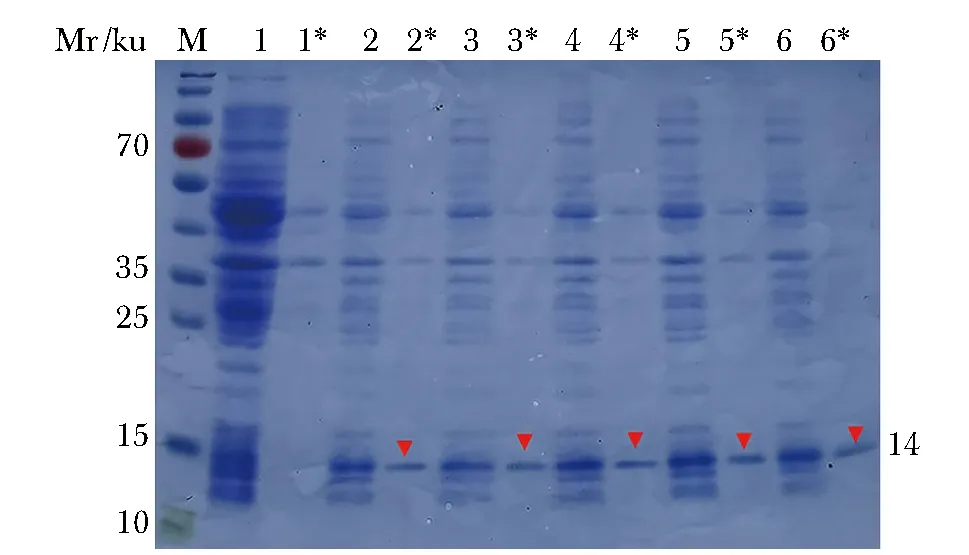
M.protein marker;1-6.sediment with 0, 0.2, 0.4, 0.6, 0.8, 1 mmol/L IPTG induction; 1*-6*.supernatant with 0, 0.2, 0.4, 0.6, 0.8, 1 mmol/L IPTG induction图1 重组人源HSF5(rhHSF5)蛋白小剂量表达(考马斯亮蓝染色)Fig 1 Low dose protein expression of recombinant human HSF5(rhHSF5) (Coomassie brillant blue staining)
2.2 Western blot检测重组蛋白的表达
IPTG浓度为0.8 mmol/L时,rhHSF5蛋白表达量较多(图2)。
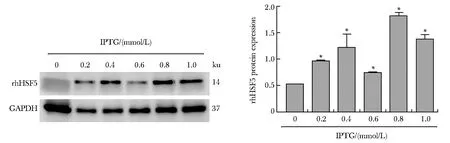
*P<0. 05 compared with IPTG in 0 mmol/L图2 rhrhHSF5在不同浓度IPTG的表达Fig 2 Expression of rhHSF5 at different concentrations of
2.3 rhHSF5蛋白的大剂量诱导表达和纯化
凝胶过滤柱目标蛋白洗脱峰出现在76.3 mL处,此位置对应于HSF5-DBD的单体分子质量(图3A)。SDS-PAGE及Western blot结果显示目的蛋白的表观分子质量为14 ku,与根据氨基酸序列所计算的理论分子质量(14.272 ku)相符(图3B)。每升菌液纯化过程中蛋白含量情况如(表1)所示。
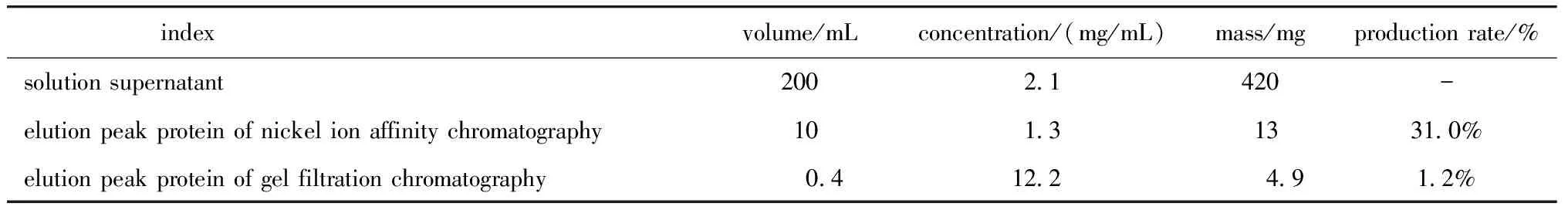
表1 每升菌液纯化过程中蛋白质含量情况Table 1 Protein content per liter of bacterial fluid during purification
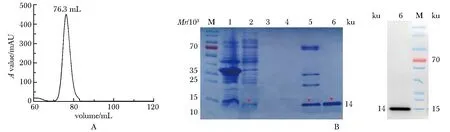
M.protein marker;1.sediment;2.solution supernatant;3.through the peak part;4.wash part;5.elution peak protein of nickel ion affinity chromatography;6.elution peak protein of gel filtration chromatography
从电泳及Western blot结果来看,rhHSF5蛋白的纯度在90%以上,已达到蛋白质结晶的条件。
2.4 rhHSF5蛋白与热休克元件凝胶迁移实验(electrophoretic mobility shift assay,EMSA)
在500~750 bp之间有明显DNA迁移条带,并且随着蛋白浓度的增加,条带有越亮的趋势 ,尤其以429.6 μg/mL rhHSF5最明显(图4)。
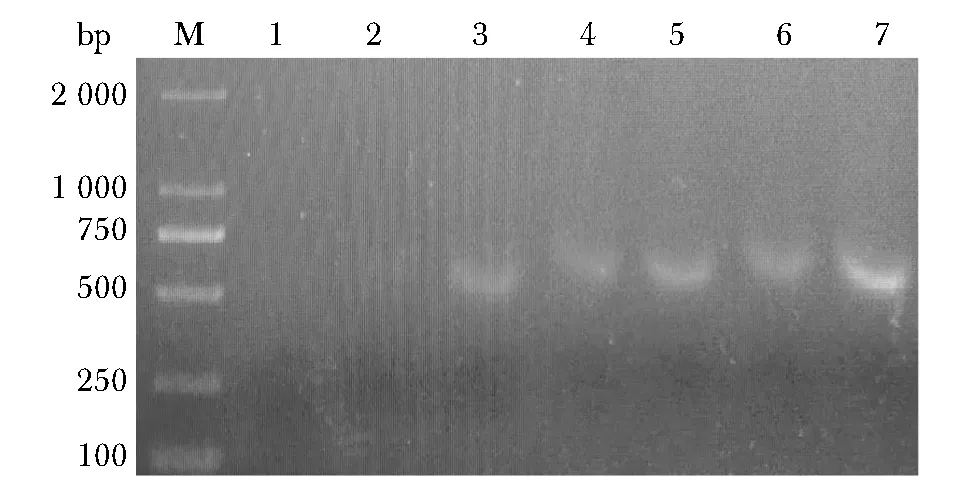
M.DNA ladder;1.28.4 μg/mL DNA;2.53.7 μg/mL HSF5+28.4 μg/mL DNA;3.107.4 μg/mL HSF5+28.4 μg/mL DNA;4.214.8 μg/mL HSF5+28.4 μg/mL DNA;5.268.5 μg/mL HSF5+28.4 μg/mL DNA;6.322.2 μg/mL HSF5+28.4 μg/mL DNA;7.429.6 μg/mL HSF5+28.4 μg/mL DNA图4 EMSA检测rhHSF5与热休克元件的结合Fig 4 Binding activity detection of rhHSF5 protein and heat shock element by EMSA
2.5 HSF5三维结构的预测
HSF5与HSF1、2、4之间的序列对比及HSF5三级结构模型(图5A,B)。
2.6 HSF5与HSE结合的复合物结构预测
HSF5-HSE复合物的模型(图5C,D)。

图5 HSF5与HSF1、HSF2、HSF4序列对比(A)、HSF5蛋白的三级结构特点(B)、HSF5与HSE结合的模型预测(C)和HSF5与HSE结合的部分位点相互作用分析(D)
3 讨论
精液质量和精子浓度下降是过去几十年在全世界范围内观察到的男性不育主要因素,至今仍不清楚睾丸内那些分子参与了精子发生。在HSF的相关研究中, 目前主要集中在HSF1与HSF2上。例如,Hsf1敲除的雄性小鼠与野生型小鼠相比减少了20%的精子[9-11], 而Hsf2的敲除会导致雄性小鼠的正常精子水平更低[12-13]。虽然分别敲除了Hsf1或Hsf2的小鼠仍具备生殖能力,但同时敲除了这两个转录因子则导致雄性小鼠的完全不育[14]。然而,对于HSF5与HSFY,这两个仅在睾丸中表达的HSF家族成员的研究却鲜有报道。最近,通过CRISPR/Cas9技术,获得了hsf5缺失的斑马鱼。观察到在第一次减数分裂前期精子发生过程中,细线期和粗线期细胞积累,而减数分裂完成后细胞凋亡增加,同时相当多参与细胞周期、凋亡,蛋白修饰和信号传导的基因在生殖器官中表达失调,这些实验数据表明HSF5在精子发生的早期阶段发挥了至关关键的作用[3]。从这个意义上来说,深入探讨HSF5的作用机制很可能为揭示男性不育病因提供重要依据,还可为临床相关诊疗提供新思路与新方法。
对于HSF5这个以前研究甚少的HSF家族成员而言,第一步工作是分子特征鉴定,包括对其生化活性、 三维结构与分子功能的测定。本研究通过原核表达系统成功获得可溶性的、高纯度的且具有HSE结合活性的rhHSF5蛋白,并通过同源建模和分子动力学模拟的方法预测了它与热休克元件结合的三维模型。由于DBD是HSF家族成员中最保守的一个结构域,HSF5与HSF1、2、4之间的序列同源度均在50%以上,使得同源建模的可靠性得以保证。该模型基本上与HSF1、2、4的晶体结构一致,都呈现典型的winged helix-turn-helix的核心结构。值得关注的是,在HSF5的结构中,第二个螺旋(α2)被打断,中间插入了一段较长的自由卷曲。这是由于相比于HSF1、2、4,HSF5序列中,第49-65位残基间插入了一段富含甘氨酸的序列。由于甘氨酸没有侧链,这一段序列呈现出高柔性的自由卷曲构象。虽然位于DNA结合面的外侧,但有可能通过参与蛋白质-蛋白质间相互作用而影响HSF5对于下游调控基因的选择。换而言之,HSF5的调控对象很可能不同于HSF1、2、4,而其结构基础就在于这一段高度柔性的插入序列。总之,本研究为后续进一步解析人源HSF5蛋白的晶体结构,揭示其调控机制及其在精子发生过程中的具体功能奠定了坚实基础。

