miR-125b参与TRAF6影响的人胰腺导管上皮屏障作用
韦碧薇,龚雅慧,苏 州,杨慧莹,覃蒙斌,梁志海*
(1.广西医科大学第一附属医院 消化内科,广西 南宁 530021; 2.荆州市中心医院 儿科, 湖北 荆州 434020;3.广西医科大学第二附属医院 消化内科, 广西 南宁 530007)
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症,其发病机制有多种,胰腺导管上皮屏障的完整性被破坏是AP发生的主要启动因素之一[1]。肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)是肿瘤坏死因子受体相关蛋白家族的成员,上调TRAF6可使核因子κB(NF-κB)亚基从细胞质进入细胞核,促进促炎因子成熟产生炎性反应,诱发重症急性胰腺炎(sever acute pancreatitis,SAP)[2]。有研究表明,NF-κB信号通路激活可以导致胰腺导管上皮屏障损伤[3]。因此,TRAF6可能是NF-κB信号通路上损害胰腺导管上皮屏障的关键环节,对TRAF6进行调控也许可以影响胰腺导管上皮屏障损伤。
近年研究发现,miR-125b可以通过多种途径调控炎性反应,在疾病的发生发展中发挥重要作用[4]。使用Targetscan检索发现miR-125b与TRAF6的3′ UTR端位于1 276~1 283的碱基位点上有互补碱基序列。但目前有关miR-125b在TRAF6参与胰腺导管上皮屏障损伤的作用尚不清楚。故本研究拟探讨TRAF6调控胰腺导管上皮屏障的机制、miR-125b与TRAF6靶向结合关系,以期为AP的发病机制研究提供新观点。
1 材料与方法
1.1 材料
1.1.1 细胞系:人胰腺导管上皮细胞系HPDE6C7(广州吉妮欧生物公司)。
1.1.2 试剂及试剂盒:RPMI-1640培养液和DMEM培养液(Gibco公司);胎牛血清(上海吉泰依科赛生物科技有限公司);Polybrenne及enhanced infection solution(上海吉凯基因科技有限公司);慢病毒载体和阴性病毒液(南宁维尔凯生物科技有限公司);Trizol(Invitrogen公司);反转录和扩增试剂盒(TaKaRa公司);兔抗TRAF6抗体和山羊抗兔二抗(Abcam公司);兔抗-occludin、-claudin-1、-NF-κB p65、-TAK1及TAB1抗体(武汉三鹰生物技术有限公司);Western blot实验相关试剂(北京索莱宝科技有限公司);FITC-D(Sigma-Aldrich公司);双荧光素酶报告基因载体和双荧光素酶报告基因检测试剂盒(Promega公司)。
1.2 方法
1.2.1 细胞的分组及处理: 复苏后的HPDE6C7细胞用RPMI-1640培养基(含10%的胎牛血清)置于37 ℃、5%CO2培养箱中培养,48 h更换次培养基,待细胞汇合至80%时,加入0.25%胰蛋白酶消化传代。将HPDE6C7细胞分为:对照(control)组、TRAF6高表达感染(TRAF6)组和空载慢病毒感染(blank)组。感染6 h后进行换液,TRAF6组换用DEME培养基(含10%的胎牛血清)继续培养,48 h后收集细胞。
1.2.2 RT-qPCR检测细胞中TRAF6的mRNA表达: 收集处于对数期生长的细胞,用Trizol法提取各组细胞总RNA,并测定其浓度和纯度。RNA反转录按反转录试剂盒说明书操作,获得cDNA,再行PCR(SYBRGree染料法)扩增。TRAF6的上游引物序列为5′-CGCGCATAGAACGACAAG-3′,下游引物序列为5′-TTTCCAGGGGTGGGTCAAAC-3′;GAPDH的上游引物序列为5′-CAAATTCCATGGCACCGTCA-3′,下游引物序列为5′-GACTCCACGACGTACTCAGC-3′。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样本设置3个复孔,取平均值,采用2-ΔΔCt的方法计算相对表达水平。
1.2.3 Western blot检测蛋白表达: 收集各组细胞,加入细胞裂解液提取细胞总蛋白,应用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。进行SDS-PAGE后将蛋白转移至PVDF膜,转膜完成置于5%脱脂牛奶中封闭45 min,放入一抗中4 ℃孵育过夜,次日室温孵育二抗1 h。使用Odyssey系统对条带进行扫描和分析。
1.2.4 检测各组细胞的单层细胞通透率: 取各组处于对数增殖期的细胞,消化后将细胞调整至3×105个/mL,分别取100 μL加入Transwell小室上室中进行培养。4 d后,用PBS润洗小室3次,加入适量PBS浸泡小室,置于培养箱培养30 min,充分清洗细胞表面杂质。吸净PBS,于上室加入异硫氰酸荧光素-葡聚糖(fluoresceine isothiocyanate-dextran, FITC-D),下室加入PBS,室温孵育1 h。将Transwell小室下室中的PBS溶液转移至96孔板,荧光分光光度计测定各孔荧光强度。相对通透率(%)=(实验孔荧光值-空白孔荧光值)/(对照孔荧光值-空白孔荧光值)×100%。
1.2.5 双荧光素酶报告基因实验验证miR-125b与TRAF6的靶向结合关系: 利用Targetscan预测TRAF6基因3′UTR区第1276-1283号碱基与has-miR-125b-5p存在结合位点。合成包含TRAF6基因3′UTR与has-miR-125b-5p结合位点的野生型(wild-type,WT)序列和突变(mutant,mut)序列,长度均为209 bp。构建TRAF6-WT质粒和TRAF6-mut质粒,利用Lipofectamin 3000将双荧光素酶质粒和miR-125b模拟物mimics共同转染293T细胞并分别设立对照,4个组分别为TRAF6-WT+mimic control组、TRAF6-WT+miR-125b mimic组、TRAF6-mut+mimic control组和TRAF6-mut+miR-125b mimic组;转染48 h后,计算相对发光强度。
1.3 统计学分析
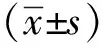
2 结果
2.1 TRAF6转染HPDE6C7细胞的效果
感染HPDE6C7细胞TRAF6基因后,TRAF6组中TRAF6基因表达水平明显高于对照组和blank组(P<0.05)(图1)。
2.2 上调TRAF6对HPDE6C7细胞相关因子的影响
与对照组相比,TRAF6组的NF-κB p65、TAK1和TAB1蛋白表达升高(P<0.05)。相反,occludin和claudin-1蛋白显著降低(P<0.05)(图2)。
2.3 单层HPDE6C7细胞FITC-D通透率的测定
上调TRAF6基因后,TRAF6组单层细胞通透率明显高于对照组(P<0.05)(图3)。
2.4 miR-125b与TRAF6的靶向结合关系的验证
TRAF6-WT+miR-125b mimic组与TRAF6-WT+mimic control组比,荧光强度显著下降(P<0.05)(图4)。
3 讨论
AP是常见的胰腺炎性疾病,以炎性细胞浸润和胰腺坏死为特征。当进展为SAP,可出现全身炎性反应综合征、多器官功能衰竭等多种严重并发症[5]。胰腺导管上皮屏障是由胰管上皮细胞及其分泌黏液组成,其在生理状态下防止胆汁、胰蛋白酶等反流进入胰腺实质,同时防止胰液中HCO3-反流入血液[1]。胰腺相邻细胞间连接有紧密连接(tight junction,TJ)、桥粒、黏附连接和缝隙连接等, 胰管上皮细胞间的TJ是维持胰腺导管上皮屏障完整性的主要连接方式,能防止炎性介质侵入胰腺组织[6]。TRAF6是一种泛素连接酶,可介导急慢性炎性疾病的发生。被上游信号激活后,TRAF6与泛素偶联酶复合物一起作用,激活包括TAB1在内的TAK1复合物,进而磷酸化和激活IκB激酶,启动NF-κB入核,最后产生炎性反应[7-8]。细胞间通透性是上皮屏障功能的重要组成部分,利用Transwell小室可检测细胞间通透性[9]。有研究发现在体内外实验中,激活NF-κB信号通路可以增加细胞间通透性并损伤上皮屏障功能[10-11]。本课题组前期研究已经证实激活NF-κB信号通路可促使胰腺导管上皮细胞间TJ减弱,胰管上皮屏障损伤以及通透性增加[12]。因此,本研究旨在探讨TRAF6能否作为关键蛋白通过激活NF-κB信号通路引起AP发病的胰腺导管上皮屏障受损。
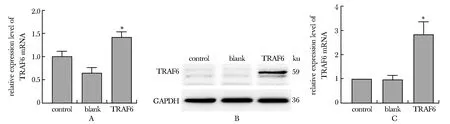
A.mRNA expression of TRAF6; B,C.protein expression of TRAF6; *P<0.05 compared with control and blank group图1 各组HPDE6C7细胞TRAF6的表达量Fig 1 Expressions levels of TRAF6 in HPDE6C7 n=3)
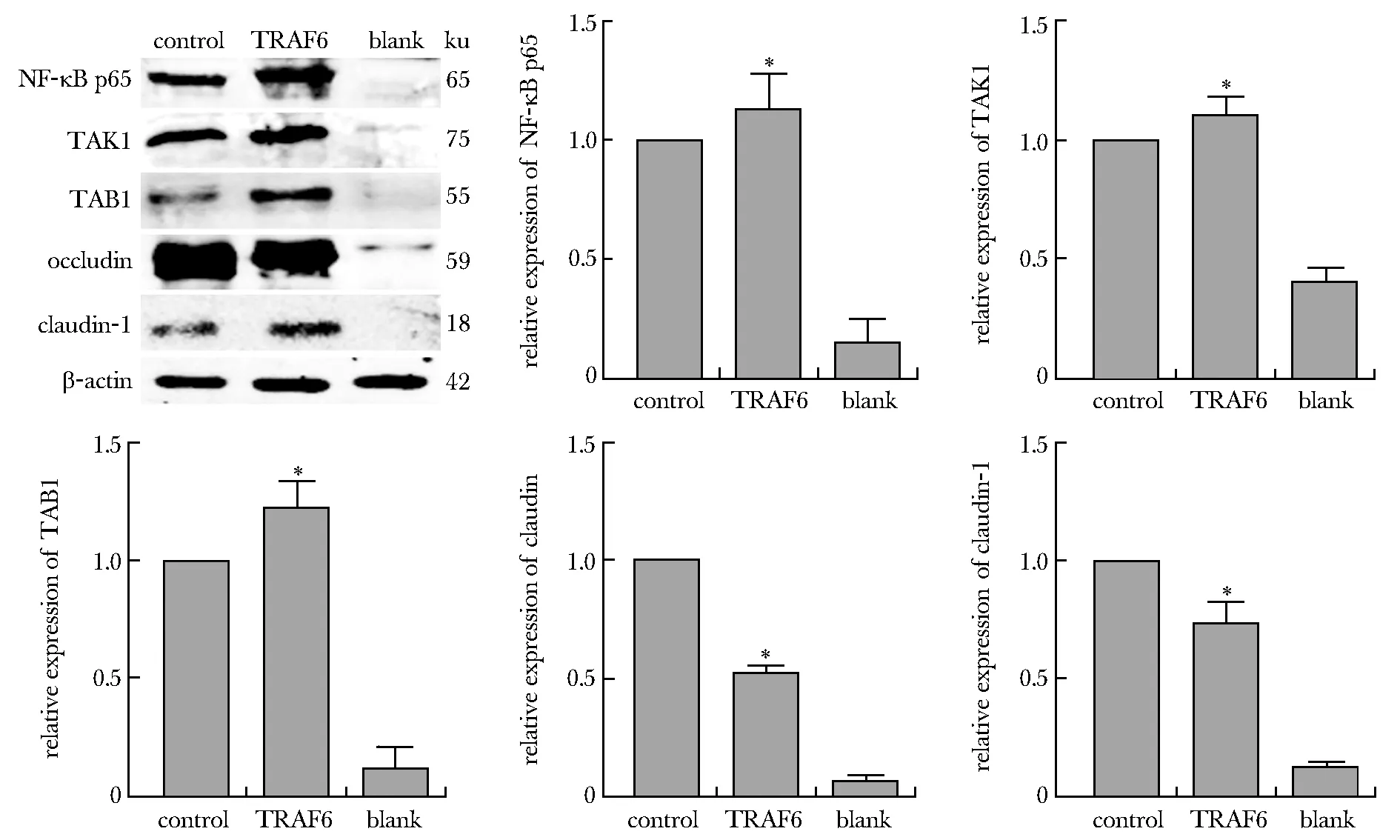
*P<0.05 compared with control group图2 Western blot检测各组细胞NF-κB p65、TAK1、TAB1、occludin和claudin-1蛋白表达

*P<0.05 compared with control group图3 各组单层HPDE6C7细胞的相对通透率Fig 3 Relative permeability in monolayer HPDE6C7
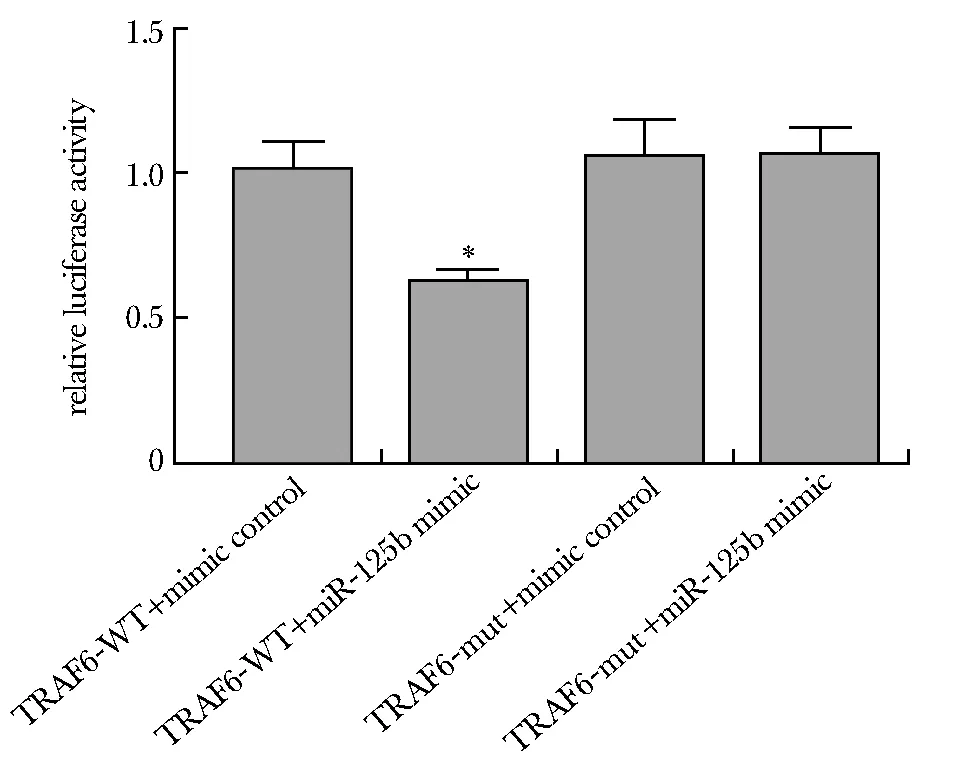
*P<0.05 compared with TRAF6-WT+mimic control group图4 miR-125b与TRAF6基因的靶向关系Fig 4 Targeted binding of miR-125b and TRAF6
miRNAs是一类内源基因编码的长度约22个核苷酸的非编码单链RNA分子,其发挥作用的方式主要是通过与目标mRNA分子的 3′端非编码区域(3′-untranslated region,3′-UTR)序列互补结合,引起靶基因 mRNA 的降解或抑制翻译,介导转录后基因沉默。另外,近年来研究发现 miRNA 还可以与受体直接互作,产生对信号传导通路的影响[13]。有研究表明,miR-125b可降低TRAF6表达,抑制NF-κB活化,减轻炎性反应[14-15]。所以miR-125b可能与TRAF6特异性结合影响上述机制。
本研究选取人胰腺导管上皮细胞HPDE6C7作为研究对象,研究发现TRAF6基因过表达能显著上调HPDE6C7细胞NF-κB p65、TAK1和TAB1蛋白水平,并且使紧密连接蛋白occludin和claudin-1表达下降,上调TRAF6同时可增加HPDE6C7细胞的单层细胞通透率。另外,双荧光素酶报告基因表明miR-125b可与TRAF6的3′ UTR mRNA靶向结合,抑制荧光素酶表达。
综上所述,HPDE6C7细胞中高表达TRAF6可能激活NF-κB信号通路,改变胰腺导管上皮细胞紧密连接蛋白表达、影响胰腺导管上皮屏障的通透性。同时,miR-125b可能通过与TRAF6靶向结合抑制该机制。进一步研究miR-125b调控TRAF6在HPDE6C7细胞的作用机制,有利于阐明AP发病机制,也可为AP的治疗提供新的靶点和基础实验依据。

