呈典型双峰脑炎表型的单纯疱疹病毒脑炎继发自身免疫性脑炎
高煜 王向波 闫鹤立 马红梅
单纯疱疹病毒脑炎 (herpes simplex virus encephalitis,HSE)是病毒性脑炎中最常见的类型,超过 90%由单纯疱疹病毒 1型 (herpes simplex virus type 1,HSV-1)感染引起。即使充分抗病毒治疗,仍有患者缓解期临床症状再度恶化,其中部分患者的症状恶化是由于病毒感染触发免疫反应,继发自身免疫性脑炎(autoimmune encephalitis,AE)所致[1-3],临床上表现出“发病-缓解-再发”的双相病程。成人HSE继发AE的病例组报告较少,现总结分析我院7例HSE继发AE的临床资料,提高认识,分享诊治经验。
1 对象与方法
1.1 研究对象 收集2017年3月至2020年9月北京丰台右安门医院连续收治的HSE继发AE患者临床资料。回顾性分析HSE和AE两病程阶段临床表现、脑脊液检查、AE相关抗体检测、影像学表现,治疗及预后。HSE的确诊依据为脑脊液 (cerebrospinal fluid,CSF)二代基因测序(next generation sequencing,NGS)检出HSV基因序列,或CSF HSV-IgM阳性,或HSV-IgG阳性且滴度进行性升高。AE的诊断符合《中国自身免疫性脑炎诊治专家共识》的 AE确诊标准[4],脑脊液、血清AE相关抗体阳性。
1.2 抗体检测 AE相关抗体检测包括:抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)抗体、抗γ-氨基丁酸A/B受体(γ-aminobutyric acid-A/B receptor,GABAA/BR)抗体、抗 α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor,AMPAR)抗体、抗富含亮氨酸胶质瘤失活1 蛋白 (leucine-rich glioma inactivated 1,LGI1)抗体、接触蛋白相关蛋白-2(contactin-associated protein-like 2,CASPR-2)抗体。中枢神经系统脱鞘病相关抗体检测包括:水通道蛋白-4(aquaporin-4,AQP4)抗体、髓鞘碱性蛋白(myelin basic protein,MBP)抗体、髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体。
1.3 治疗与随访 治疗包括阿昔洛韦抗病毒治疗,糖皮质激素、静注人免疫球蛋白(intravenous immunogloblin,IVIG)一线免疫治疗,硫唑嘌呤长程免疫抑制治疗,抗癫痫、精神症状的对症治疗及支持治疗等。通过门诊及电话随访了解病情转归,中位随访时间为5(范围3~8)个月。采用Rankin量表(modified Rankin scale,mRS)评价预后,mRS≤2分为预后良好,≥3分为预后不良。
1.4 统计学方法 本研究为描述性研究,计量资料以中位数(范围)表示,计数资料以例数或百分比表示。
2 结果
2.1 一般资料 共纳入7例患者,男5例,女2例,中位发病年龄27(16~45)岁。7例均未发现AE相关肿瘤。
2.2 临床症状与病程 7例均急性起病,临床过程均呈现典型的“双峰脑炎”表型,第一峰期为HSE期,第二峰期为AE期。①HSE期症状:发热5例,头痛4例,癫痫发作3例(强直-阵挛性发作),意识障碍3例(嗜睡),认知功能障碍2例,记忆力减退1例,视幻觉1例,语言障碍1例。②AE期症状:精神行为异常5例(躁动、胡言乱语、行为异常),认知功能障碍3例,癫痫发作3例(强直-阵挛发作2例,失神发作1例),记忆力减退2例,意识障碍1例(昏睡),语言障碍1例,肢体运动障碍1例。③HSE期与AE期间隔时间为27(18~55)d(表 1)。
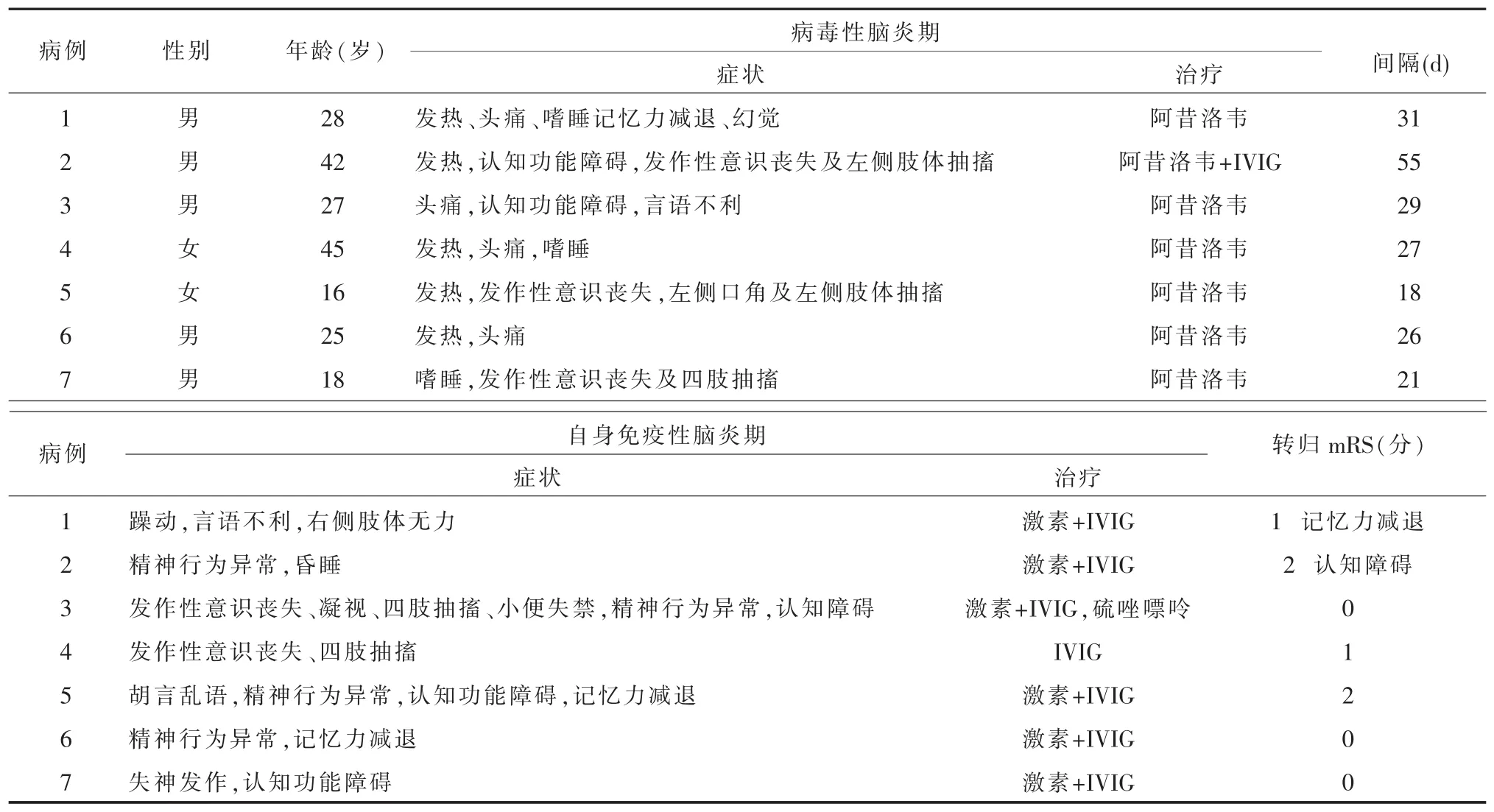
表1 7例患者一般资料、临床表现、病程、治疗及预后
2.3 脑脊液检查与抗体检测 ①HSE期:7例脑脊液白细胞均升高[(29~152)个/mm3,正常值≤8 个/mm3],5 例蛋白升高[(52~105)mg/dL,正常值 8~43 mg/dL)]。3例脑脊液NGS检出HSV-1基因序列,4例脑脊液HSV-IgM阳性。7例AE相关抗体均阴性。②AE 期:4例脑脊液白细胞升高[(12~34)个/mm3,正常值≤8个/mm3],1例蛋白升高(96 mg/dL,正常值8~43 mg/dL)。7例均行AE抗体检测,脑脊液抗NMDAR抗体均阳性,其中4例同时血清抗NMDAR抗体阳性;1例合并脑脊液抗GABABR抗体阳性。4例行中枢神经系统脱鞘病相关抗体检测,2例脑脊液MOG抗体阳性,其中1例同时血清MOG抗体阳性(表2)。
2.4 影像学检查结果 ①HSE期:6例MRI发现异常信号,分布于颞叶6例,岛叶1例,海马1例,额叶2例;1例未见脑实质异常信号。②AE期:3例出现新发病灶,分布于基底节区、丘脑、脑室旁、胼胝体、额叶皮质、顶叶皮质(图1),其中2例行增强扫描1例病灶强化;4例未见新发病灶(表2)。
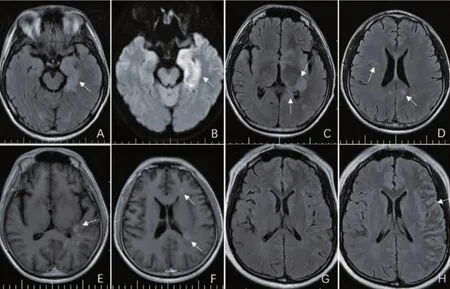
图1 单纯疱疹病毒脑炎继发自身免疫性脑炎患者的头颅MRI A、B.例1 HSE期头颅MRI可见左侧颞叶内侧病灶,FLAIR、DWI高信号。C~F.例1 AE期头颅MRI可见基底节区、胼胝体、脑室旁、顶叶新发病灶,病灶部分强化。G.例3HSE头颅MRI未见脑实质病灶。H.例3 AE期头颅MRI可见左侧额叶、颞叶皮层异常信号。
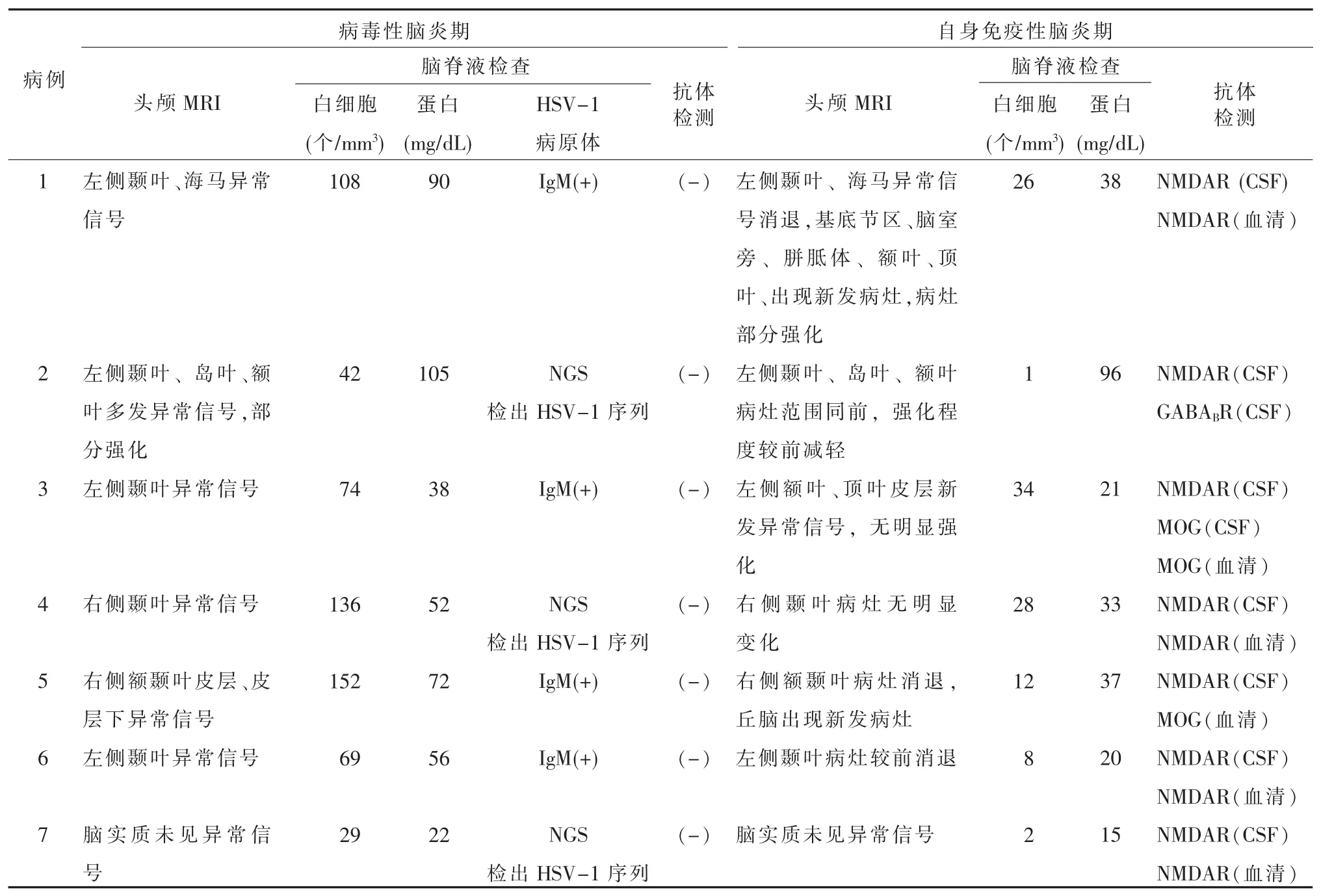
表2 7例患者两个峰期影像学、脑脊液检查及抗体检测结果的比较
2.5 治疗与转归 HSE期7例患者均接受了足量足疗程阿昔洛韦抗病毒治疗,1例联合静脉注射用免疫球蛋白。AE期6例接受糖皮质激素治疗联合IVIG,1例仅接受IVIG,1例序贯硫唑嘌呤长程免疫抑制治疗。随访3~8个月7例患者均预后良好,7例AE期症状均较前缓解,1例遗留HSE期出现的记忆力减退,1例遗留HSE期出现的认知功能障碍(表1)。随访期复查MRI发现 AE期新出现的病灶消退,1例脑脊液抗NMDAR抗体在随访期持续阳性。
3 讨论
始于中枢神经系统的感染,特别是病毒感染可以诱发AE。PRÜSS等[5]证实30%的HSE患者病程中抗NMDAR抗体由阴性转为阳性。ARMANGUE等[3]研究发现HSE发病后3个月内继发AE的发生率为27%,其中64%为抗NMDAR脑炎。HSE继发AE机制的研究多基于HSE继发抗NMDAR脑炎。首先提出的假说是分子拟态,即HSV的病毒蛋白序列激发免疫反应,产生的抗体错误地与NMDAR上抗原决定簇发生反应。但目前尚未发现HSV与NMDAR有相同结构的抗原决定簇。随后的研究发现不存在HSE与抗NMDAR脑炎之间的固定对应关系,其他类型病毒性脑炎也可继发抗NMDAR脑炎[6-7],HSE可以继发其他抗体类型的AE[3,8-10],故认为HSE继发AE不是分子拟态的结果。目前认同度较高的机制是HSV易侵犯的部位与NMDAR高表达区域有一定重叠,病毒感染破坏边缘系统等结构,导致NMDAR抗原决定簇暴露与修饰,成为自身免疫反应的靶点,启动免疫应答。另一种可能的机制是HSV感染后T细胞、B细胞激活,分泌大量炎性细胞因子,透过血脑屏障引起中枢神经系统的免疫反应[11]。
HSE继发AE多呈典型的双相病程,即在HSE缓解过程中,距HSE症状首发2~16周出现AE症状[3]。本组病例均呈现典型的“双峰脑炎”表型,病程的第一峰期为HSV侵犯颞叶、额叶和边缘系统引起HSE,第二峰期为继发的AE,AE相关抗体是该期的致病因子。AE期突出表现为新的或复发的神经系统症状,成年患者以精神行为异常、认知功能障碍最常见,癫痫发作次之,症状总体较经典AE轻[3]。与以往报告一致,本组AE期精神行为异常发生率71.4%,认知功能障碍、癫痫发作发生率均为42.9%。例7在AE期再发癫痫,发作形式由HSE期的强直-阵挛发作转变为失神发作,提示恢复期癫痫发作形式的改变也提示继发AE的可能。其他症状包括语言、运动障碍及记忆力减退,未见经典抗NMDAR脑炎常见的自主神经功能紊乱和中枢性通气不足。
AE期脑脊液白细胞数、蛋白定量较HSE期下降,降至正常或轻度升高,脑脊液HSV基因测序、HSV-IgM转为阴性[1,3],本组病例呈现相同趋势,提示炎症反应消退。AE期脑脊液显著变化为AE相关抗体转为阳性。目前观察到最多的是抗NMDAR抗体阳性,本组NMDAR抗体阳性率100%,可能的原因是与其他受体或通道相比,NMDAR更为丰富。抗NMDAR抗体在HSE后1~4周开始合成[2]。动态观察病例7发现抗NMDAR抗体转为阳性发生于AE期症状出现之前,推测这种情况是因为免疫应答启动数天,抗体到达足够水平才会表现出相应症状。故HSE恢复期动态观察AE抗体是必要的,以便及时发现继发AE,指导后续治疗。越来越多的病例研究发现AE期可合并多种神经元表面或突触蛋白抗体阳性,属于多重抗体阳性AE。该现象总体发生率低,机制不明,叠加的抗体可导致临床表现的叠加或者变异[3,8,12]。例2 AE期脑脊液抗NMDAR抗体、抗GABABR抗体均阳性,提示这两种类型AE共存,但患者只表现精神行为异常,无严重且难治的癫痫发作,不同于经典抗GABABR脑炎。抗NMDAR脑炎可合并MOG抗体阳性,其发生机制与少突胶质细胞膜表面有NMDAR有关,MOG抗体出现可能是继发的免疫反应,也可能是两者有共同免疫途径异常[13]。这类病例可兼具抗NMDAR脑炎和中枢神经系统脱髓鞘病的临床及影像特点[13-14]。例3、例5合并MOG抗体阳性,提示AE合并MOG抗体病,兼具两者临床特点,因为合并MOG抗体时预后可能更差,需要更积极的免疫治疗[15],建议将MOG抗体检查扩展到继发AE患者中。此外,例3随访过程中发现虽症状缓解,但抗NMDAR抗体持续阳性,为预防复发经验性给予长程免疫治疗。抗体的持续存在是否为复发的预测因素,治疗方案是否需要因此做出调整,有待进一步研究。
既往研究报告AE期MRI与HSE期相比,多无明显变化,新发病灶少见[16]。但例1、例3、例5在AE期均出现新发病灶,分布于基底节、脑室旁、丘脑、胼胝体、额顶叶皮质,提示免疫反应发生于更广范围,而不局限于病毒直接侵犯的部位。例3新发皮质病变,符合MOG抗体阳性单侧皮质脑炎的MRI表现,例5新发病灶为位于MOG抗体病常累及的丘脑,考虑这两例新发病灶可能是MOG介导的免疫损伤所致。例1在AE期出现的偏瘫不是抗NMDAR脑炎的典型症状,运动障碍与MRI发现的基底节、脑室旁病灶对应,病灶呈T2WI、FLAIR高信号,部分强化,具有脱髓鞘病灶的特点,不除外AE期叠加了MOG抗体病的可能,遗憾的是该患者未行相关抗体检测。文献报告82%AE期病灶强化[17],比例远大于经典AE。本组2例AE期行增强扫描1例强化,这与病毒感染导致血脑屏障破坏有关。随访期间本组AE期的新发病灶均消退,可能原因是AE主要通过免疫机制引起相对可逆的神经系统损害,而不是HSV直接侵犯所致。
AE期对免疫治疗反应良好[2,17],一旦排除HSE复燃,应尽早开始免疫治疗。治疗方案与经典AE一致。部分患者可遗留与HSV感染相关的后遗症[17]。如例1,经免疫治疗AE期新发症状完全缓解,新发病灶消失,但HSE期出现病变的颞叶明显萎缩,随访期仍有记忆力减退。故患者的整体预后似乎更取决于HSE期病毒感染导致的损伤程度。
总之,HSE抗病毒治疗有效的恢复期内再发精神行为异常、认知功能障碍、癫痫发作等症状时,应高度怀疑继发AE的可能,应结合临床表现、脑脊液检查、相关抗体检及MRI做出综合判断。继发AE以抗NMDAR脑炎最常见,可合并抗GABABR抗体、MOG抗体阳性。头颅MRI可见其他部位的新发病灶,新病灶的出现可能与MOG抗体介导的免疫损伤有关。成人继发性AE对免疫治疗反应良好,但患者可遗留可归因于HSE的神经功能缺损。

