慢性萎缩性胃炎患者血清胃蛋白酶原、胃泌素17 水平的变化及其临床意义
史萍 李静 王姜琳
慢性萎缩性胃炎是临床常见的消化系统疾病,当患者胃黏膜上皮与腺体发生萎缩,胃黏膜变薄、数量减少、胃黏膜肌层变厚或者发生不典型增生就会引发炎性反应,主要表现为嗳气、上腹部隐痛、胀痛、食欲不振等[1]。该疾病多与患者生活作息不规律、饮食结构不健康、过度劳累、压力过大、情绪波动较大等因素有关,病程较长,发病早期症状不明显,很容易被忽视而错过最佳治疗时机[2]。该疾病如果没有及时控制,随着病情的发展很可能进展成胃癌等更为严重的胃部疾病,因此,能够早期发现并对症治疗对降低其癌变的风险以及改善预后极为重要。由于慢性萎缩性胃炎临床表现缺乏特异性,临床诊断该疾病主要采取胃镜与胃黏膜活组织病理检查。PG 与G-17 是反映胃黏膜功能的重要指标,为了进一步证实这两种指标对慢性萎缩性胃炎的筛查价值,本文对100 例胃镜受检者的PG 与G-17 水平变化进行分析,具体结果报告如下。
1 资料与方法
1.1 一般资料 分析2020 年3 月~2021 年3 月本院100 例胃镜受检者的临床资料,所有受检者均经胃镜检查与病理学检查,根据诊断结果分成对照组(检查未见异常者,20 例)、慢性萎缩性胃炎组(慢性萎缩性胃炎,55 例)及慢性非萎缩性胃炎组(慢性非萎缩性胃炎,25 例)。对照组男11 例,女9 例;年龄23~66 岁,平均年龄(45.03±8.12)岁。慢性非萎缩性胃炎组男13 例,女12 例;年龄22~65 岁,平均年龄(45.32±8.08)岁。慢性萎缩性胃炎组男29 例,女26 例;年龄26~67 岁,平均年龄(41.53±8.85)岁;胃体萎缩(胃体萎缩组)16 例,胃窦萎缩(胃窦萎缩组)18 例,全胃多灶性萎缩(全胃多灶性萎缩组)21 例。对照组、慢性萎缩性胃炎组及慢性非萎缩性胃炎组一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①年龄≥18 岁;②近期内未应用过抑酸药、抗生素与胃黏膜保护剂;③患者与家属了解研究内容自愿配合。排除标准[3]:①存在胃及十二指肠溃疡、胃癌者;②合并其他恶性肿瘤者;③合并心脏、肝脏、肾脏等重要脏器器质性病变者;④精神异常或无法正常语言沟通者。
1.2 方法 所有受检者均接受胃镜检查并取材进行病理学诊断,在进行胃镜检查时分别在胃窦小弯、胃窦大弯、胃体小弯、胃体大弯与胃角各取1 块组织进行活检。取出活检的标本需足够大,应达到胃黏膜肌层。制备石蜡切片,经资深病理科医师进行读片给出诊断结果。与此同时,在患者清晨空腹状态下采集3 ml 静脉血,进行血清分离后将其快速保存在-20℃的环境中等待进一步检测。采用酶标仪和试剂[必欧瀚生物(合肥)有限公司]检测PGⅠ、PGR 与G-17 水平。
1.3 观察指标 对比三组PGⅠ、PGR 与G-17 水平及不同萎缩部位PGⅠ、PGR 与G-17 水平。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差() 表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 三组PGⅠ、PGR 与G-17 水平对比 慢性非萎缩性胃炎组PGⅠ、PGR 与G-17 水平与对照组对比差异无统计学意义(P>0.05);慢性萎缩性胃炎组PG I、PGR 水平均明显低于对照组,G-17 水平高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 三组PGⅠ、PGR 与G-17 水平对比()
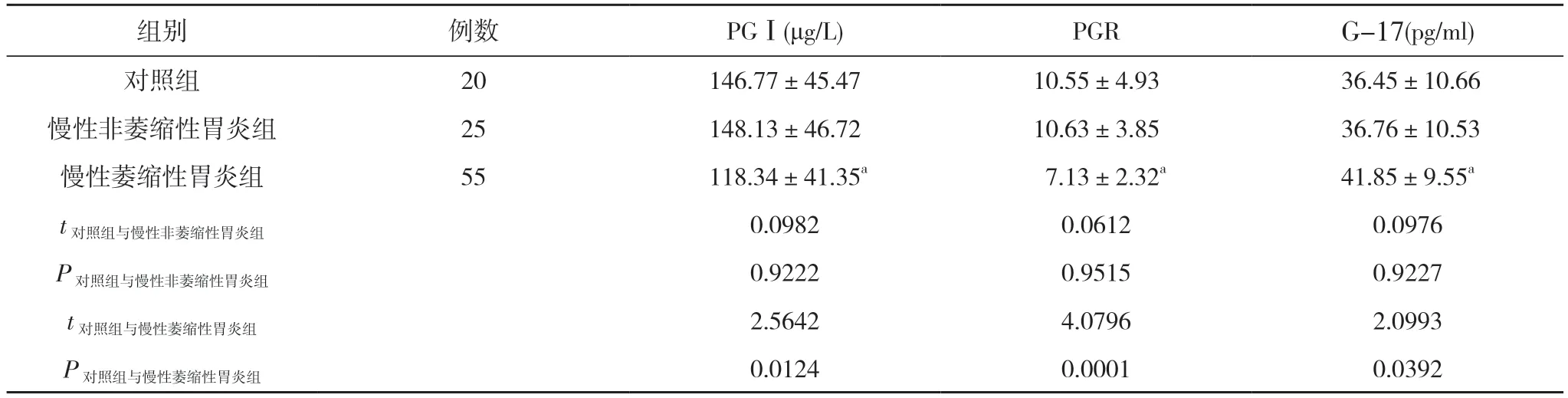
表1 三组PGⅠ、PGR 与G-17 水平对比()
注:与对照组对比,aP<0.05
2.2 不同萎缩部位PGⅠ、PGR 与G-17 水平对比 胃体萎缩组PGⅠ、PGR 水平均低于对照组,G-17 水平高于对照组,差异有统计学意义(P<0.05);胃窦萎缩组PGⅠ、PGR 水平与对照组对比,差异无统计学意义(P>0.05),G-17 水平低于对照组,差异有统计学意义(P<0.05);全胃多灶性萎缩组PGⅠ、PGR 及G-17 水平均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 不同萎缩部位PGⅠ、PGR 与G-17 水平对比()

表2 不同萎缩部位PGⅠ、PGR 与G-17 水平对比()
注:与对照组对比,aP<0.05
3 讨论
萎缩性胃炎又称慢性萎缩性胃炎,是慢性胃炎的一种类型,表现为胃黏膜的腺体萎缩、消失,与浅表性胃炎相比,萎缩性胃炎更严重[4]。大部分慢性萎缩性胃炎患者早期症状不明显,即便有症状也与其他胃病相似,患者表现为消化不良、上腹痛、胃脘部胀满、消瘦、乏力、贫血等症状,因此仅凭症状很难与非萎缩性胃炎进行区分[5]。临床研究表明,导致慢性萎缩胃炎的原因有很多,包括慢性萎缩性胃炎家族史、自身免疫力低下、年龄、幽门螺杆菌、不规律生活作息和饮食结构、吸烟或酗酒、滥用药物等。该疾病病程较长,很多患者重视度不高,随着病情的发展部分患者会出现肠上皮化生现象,严重者可发生癌变,危及患者的生命安全,生活质量也会下降[6]。临床医学已经将慢性萎缩性胃炎当做癌前病变,所以越早诊断并进行干预对患者病情的进展及预后效果越有帮助[7]。PG是一种胃蛋白酶无活性前体,能够在胃酸作用下转化成有活性的胃蛋白酶,包括PGⅠ和PGⅡ,PGⅠ可反映胃底体部黏膜的分泌功能,而PGⅡ与PGR 能够反映全胃黏膜的分泌功能,如果PGⅡ水平异常升高则应警惕疾病进展的风险会增加[8]。
胃泌素产生于胃窦G 细胞,主要用来促进胃酸分泌,不仅能够反映胃窦部黏膜的分泌功能,还能够与PG 相互补充更好的评估胃黏膜功能,PG 与G-17 都是反映胃黏膜功能的重要指标。慢性萎缩性胃炎通常呈片状分布,在进行组织学检查时只能够代表活检部位的胃黏膜状态,如果胃黏膜发生了病变,PG 与G-17 水平也会发生变化[9]。当胃黏膜产生慢性炎症时黏膜就会出现萎缩,多发于胃角小弯部位,随着病情的发展会逐渐累及到胃窦、胃体,腺体的正常功能减退,会影响到酶的合成与分泌[10]。当胃黏膜萎缩时胃体腺和胃底腺数量就会减少,PGⅠ分泌减少其水平会降低,而PGⅡ水平不受影响就会造成PGR 水平下降,可见血清PGⅠ与PGR 水平降低能够反映出胃黏膜萎缩的情况[11,12]。同时,当胃窦萎缩后G 细胞数量也会减少,G-17 水平会下降,而胃体萎缩时胃酸分泌减少,胃窦G 细胞抑制作用衰退就会使得G-17 分泌增多,其水平就会升高,若G-17 水平持续升高胃黏膜萎缩的程度就会加重[13]。
本文研究结果显示,慢性非萎缩性胃炎组PGⅠ、PGR 与G-17 水平与对照组对比差异无统计学意义(P>0.05);慢性萎缩性胃炎组PG I、PGR 水平均明显低于对照组,G-17 水平高于对照组,差异有统计学意义(P<0.05)。胃体萎缩组PGⅠ、PGR 水平均低于对照组,G-17 水平高于对照组,差异有统计学意义(P<0.05);胃窦萎缩组PGⅠ、PGR 水平与对照组对比,差异无统计学意义(P>0.05),G-17 水平低于对照组,差异有统计学意义(P<0.05);全胃多灶性萎缩组PGⅠ、PGR 及G-17水平均低于对照组,差异有统计学意义(P<0.05)。
综上所述,临床通过检测血清PG 与G-17 水平可有效筛查出慢性萎缩性胃炎,其可反映出胃黏膜功能与萎缩的严重程度,在检测过程中若存在异常情况可做胃镜检查以待确诊。

