3,3′-二吲哚甲烷对肠炎沙门氏菌生物被膜的抑制作用
张 慧,郭晓梅,白 婧,张森林,孙 群
(1. 四川大学轻工科学与工程学院,四川 成都 610064;2. 四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064)
0 引 言
沙门氏菌(Salmonella)是引起微生物性食源性疾病最常见的致病菌之一[1]。每年全球范围内大约94 000 000人因感染沙门氏菌而引起肠炎,其中约155 000人死亡[2]。2008年到2015年,我国食品中毒事件中,因微生物导致的食物中毒事件占60%以上,而在所有致病菌中,沙门氏菌占比为23%,居于首位[3]。自然界中,几乎所有细菌都是以生物被膜的形式存在,只有约0.1%的细菌处于浮游状态[4]。研究表明,生物被膜是造成食品污染、导致微生物性食源性疾病爆发的重要原因。据估计,约65%的食源性微生物污染由生物被膜状态的致病菌引起[5]。成熟生物被膜胞外基质的阻隔性以及休眠状态的里层细菌导致其对各种极端环境及压力的抗性相对于浮游菌进一步增强[6],从而使得常规的消毒灭菌处理效果不佳,而且消毒杀菌剂的大量使用使得细菌产生抗性[7]。有研究表明次氯酸钠浓度提高5倍也无法完全杀灭生物被膜里层肠炎沙门氏菌[8]。由此可见,生物被膜一旦成熟,难以完全清除,其导致的一系列问题如耐药性的出现或增强,将会给食品安全造成巨大的潜在威胁。因此,预防生物被膜形成对于保证食品安全是十分迫切且重要的。
生物被膜形成大致分为初始粘附、细菌聚集、成熟和分散4个阶段,且在不同阶段,细菌所表现的生理特征各不相同[9],初始粘附阶段大多数细菌能够通过菌毛介导的游动或细菌自身的滑动性进行独立运动来促进细菌粘附[10],而在细菌聚集和成熟阶段则主要是通过产生胞外多糖(extracellular polysaccharide, EPS)、胞外 DNA (extracellular DNA,eDNA)、蛋白质和磷脂等物质组成胞外基质(extracellular matrix, ECM)形成并维持生物被膜三维结构[11]。3,3′-二吲哚甲烷 (3,3′-diindolemethane,DIM)是存在于十字花科芸苔属蔬菜中的一种植物化学物,此前研究表明DIM具有抗肿瘤、抗癌等多种生物活性[12],但是关于DIM对细菌生物被膜影响的研究较少且作用机制尚不完全清楚,目前缺乏定量评估DIM影响生物被膜形成过程、胞外基质以及微观结构等的报道。
本研究通过测定生长曲线和细菌代谢活性分析DIM对S. enteritidis生长的影响,利用光学显微镜、激光共聚焦显微镜(CLSM)和扫描电镜(SEM)观察和分析DIM对生物被膜三维结构的影响,探究DIM对生物被膜形成过程、细菌运动性以及与生物被膜三维结构密切相关的胞外基质(EPS、eDNA)的影响,为DIM在食品生产中的应用提供理论基础。
1 材料与方法
1.1 菌株与试剂
实验所使用的Salmonella enteritidis为实验室保存的分离株。
DIM (纯度≥98%,CAS:1968-05-4,Aladdin 公司);TSB培养基(青岛海博公司);LB培养基(青岛海博公司);0.1%结晶紫染色液 (Solarbio公司);PBS片 剂 (Solarbio公 司);Styo 9试剂 (Thermo Fisher公司);2.5%戊二醛固定液(北京雷根公司);Gel extraction kit (Omega 公司);琼脂粉、乙醇、甲醇、二甲基亚砜(DMSO)、蒽酮等试剂均购于成都鹏世达实验用品有限公司。
1.2 主要仪器设备
Bio-Rad 680 酶标仪 (Bio-Rad 公司);BX53F 光学显微镜(Olympus公司);JSM-7500F扫描电子显微镜 (JEOL公司);TCS SP5II激光共聚焦显微镜(Leica公司);BD1110超微紫外分光光度计(Bio Drop 公司);Eppendorf 5804R 高速离心机 (Eppendorf公司)等。
1.3 方法
1.3.1 菌株活化
将保存在–20 ℃的S. enteritidis划线于LB固体培养基活化,挑取单菌落接种于TSB液体培养基中,于 130 r/min、37 ℃ 摇床中培养 12 h 进行二次活化,将二次活化后的S. enteritidis划线于LB固体培养基,培养18 h后将长有单菌落的固体平板保存于4 ℃。挑取单菌落接种于10 mL TSB液体培养基中,过夜培养活化。吸取1 mL过夜培养液于9 mL TSB液体培养基中,培养至菌液浓度约为1×108CFU/mL,备用。
1.3.2 最小生物被膜抑制浓度 (MBIC)测定
将DIM溶解于DMSO制备浓度为2×10–2mol/L母液。按照方法1.3.1准备菌液。在96孔板的中间选取 7列 8个复孔,第1列每孔加入5 µL DMSO、175 µL 1/10-TSB 培养基 (稀释 10倍的 TSB 培养基)、20 µL TSB 培养基作为阴性对照;第 2 列每孔加入 5 µL DMSO、175 µL 1/10-TSB 培养基、20 µL按照方法1.3.1准备的菌液作为空白对照;第3列到第7列分别加入5 µL梯度稀释的DIM溶液、175 µL 1/10 - TSB 培养基、20 µL 菌液,使最后 DIM 浓度分别为 7.8,15.6,31.2,62.5,100 µmol/L。将 96 孔板于28 ℃恒温培养箱中培养48 h形成生物被膜。取出培养后的96孔板进行结晶紫染色定量生物被膜,具体操作步骤:1) 弃去培养基,用无菌PBS缓冲液轻轻洗涤两次除去浮游细菌。每孔加入200 µL 95%甲醇溶液,室温固定15 min后弃去固定液,室温晾干。2) 每孔加入 200 µL 0.1% 结晶紫室温染色15 min后弃去染液,用超纯水洗涤至洗出液无色,室温晾干。3) 每孔加入 200 µL 95% 乙醇溶液溶解15 min后,用酶标仪测定OD570。最小生物被膜抑制浓度(MBIC)定义为当处理浓度提高之后,生物被膜抑制率没有显著变化时的最小浓度[13],DIM对S. enteritidis生物被膜抑制率采用以下算式计算:
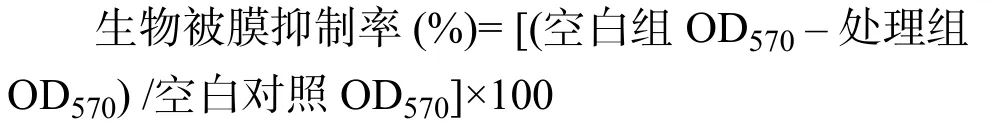
1.3.3 DIM 对S. enteritidis生长的影响
生长曲线测定:如方法1.3.1准备菌液,以1%的接种量接入 DIM浓度为 15.6,31.2 µmol/L的1/10-TSB培养基(稀释10倍的TSB)中,以DMSO为空白对照。每2 h取一次样直至48 h结束,测定OD600,绘制生长曲线。
细菌代谢活性测定:XTT作为线粒体脱氢酶的底物,被活细胞还原成水溶性的橙黄色甲臢产物。当XTT与电子偶合剂(例如PMS)联合应用时,其所产生的水溶性的甲臢产物的吸光度与细胞代谢活性成正比,将XTT钠盐和吩嗪甲酯硫酸盐(PMS)分别以 20 µg/mL和 300 µg/mL的浓度溶解在 PBS溶液中,并按1∶1比例混合,现配现用。同时,按照方法1.3.2培养生物被膜。培养结束后,收集每孔的浮游菌,并用无菌PBS洗涤浮游菌,以850×g反复离心 5 min 后向沉淀中加入 200 µL XTT 与 PMS的混合液,并迅速转移至96孔板中;同样,孔板底部的生物被膜用无菌PBS溶液洗涤3次后,向孔中加入 200 µL XTT与 PMS混合液。最后,将 96孔板在 37 ℃、130 r/min 条件下避光孵育 3 h,用酶标仪检测OD490。
1.3.4 显微镜观察生物被膜结构
普通光学显微镜观察步骤:预先在24孔板每孔中从三个角度竖直放入3片无菌玻片(φ 14 mm),使其形成稳定三角结构,作为S. enteritidis生物被膜的载体。如方法1.3.1准备菌液。在24孔板中间选取4列4个复孔,第1列每孔加入25 µL DMSO、875 µL 1/10-TSB 培养基、100 µL TSB 培养基为阴性对照;第 2 列每孔加入 25 µL DMSO、875 µL 1/10-TSB培养基、100 µL菌液为空白对照;第3列和第4 列每孔加入 25 µL DIM 溶液、875 µL 1/10-TSB 培养基、100 µL菌液,使孔中DIM终浓度分别为15.6,31.2 µmol/L,随后将孔板置于 28 ℃ 恒温培养箱中培养48 h。生物被膜培养结束后,取出玻片按方法1.3.2进行结晶紫染色并用光学显微镜观察并拍摄放大400倍下的图像。
激光共聚焦显微镜观察步骤:如上述方法培养生物被膜结束后,取出覆有生物被膜的玻片,并用0.85% 氯化钠溶液清洗 3 次,取 100 µL 3.34 µmol/L的Syto 9染液均匀覆盖在玻片表面,将玻片置于28 ℃培养箱中避光染色15 min后。立即用激光共聚焦显微镜观察生物被膜并采集图像,并使用ImageJ软件重建生物被膜三维结构,COMSTAT2.1 (Dr. Claus Sternberg, DTU Systems Biology, Technical University of Denmark, Denmark)软件计算三维结构的定量参数。
扫描电子显微镜观察步骤:预先在48孔板每孔中从三个角度竖直放入3片无菌玻片(φ 8 mm),使其形成稳定三角结构,作为S. enteritidis生物被膜的载体。按照方法1.3.2培养生物被膜。将覆有生物被膜的玻片用无菌PBS溶液清洗3次后立即用 2.5%戊二醛固定液于 4 ℃固定 3 h。用 30%、50%、60%、70%、90%、95%和100%的乙醇溶液梯度脱水10 min后进行临界点干燥和喷金处理。扫描电镜观察并拍摄放大2000倍和5000倍下的图像。
1.3.5 生物被膜形成过程的测定
将20 mL如方法1.3.1准备的菌液与 180 mL 1/10-TSB培养基混合均匀后,向96孔板每孔中加入 200 µL,分别在不同时间点 (4,8,12,18,24,34,48,58,72,82,96,120 h)取出样品,每个时间点 18个复孔,按方法1.3.2进行结晶紫染色,酶标仪检测OD570,绘制生物被膜形成过程曲线。如方法1.3.2培养S. enteritidis生物被膜,不同之处在于分别在培养的 0,6 ,12,24,36 ,38 h 加入 DIM 溶液使孔中终浓度为 31.2 µmol/L,并于 48 h 停止培养。然后进行结晶紫染色,酶标仪检测OD570,并计算在不同时间加入DIM时的生物被膜抑制率以评估DIM的抑制的具体阶段。
1.3.6S. enteritidis运动性能的检测
按照方法1.3.1准备菌液。准备3个50 mL游动性检测培养基(1%胰蛋白胨、0.25%氯化钠、0.3%琼脂)和3个50 mL群集性能检测培养基(1%胰蛋白胨、0.25%氯化钠、0.7%琼脂),冷却到45 ℃左右分别加入1.25 mL DMSO作为空白对照、1.25 mL DIM 溶液使平板中终浓度分别为 15.6 µmol/L和31.2 µmol/L,混合均匀后倒平板,冷却凝固后于平板中央垂直加入15 µL菌液,水平放置于37 ℃恒温培养箱,24 h后观察并拍照。
1.3.7 胞外 DNA (eDNA)的测定
按方法1.3.4在DIM处理下培养S. enteritidis生物被膜,但不在24孔板中放置玻片。生物被膜培养结束后弃去浮游细胞并清洗生物被膜,向每孔加 5 µL EDTA (0.5 M),4 ℃ 条件下静置 1 h 后,向每孔加入700 µL TEN缓冲液重新悬浮生物被膜细胞。于 4 ℃ 下 18000×g离心 5 min,将 100 µL 上清液转移到含有300 µL TE缓冲液的EP管中。然后,将混合物和等体积的结合缓冲液(Gel extraction kit)加入吸附柱。室温静置2 min 后,于4 ℃ 下18000×g离心 60 s,然后用洗涤缓冲液清洗吸附柱,18000×g反复离心30 s。最后加入无菌水,离心收集eDNA。使用超微紫外分光光度计测定eDNA浓度。
1.3.8 胞外多糖 (EPS)的测定
S. enteritidis生物被膜中胞外多糖的提取方法:如方法1.3.1所述准备S. enteritidis菌液,在直径为60 mm 无菌培养皿中依次加入125 µL DMSO、4375 µL BHIGSS培养基、500 µL菌液作为空白对照,处理组加入 125 µL DIM 溶液使终浓度分别为 15.6 µmol/L和31.2 µmol/L。加样结束后将培养皿于在28 ℃条件下培养48 h以便形成生物被膜。弃去浮游细胞后,用无菌PBS洗3次后将生物被膜洗脱至2 mL PBS 中,洗脱液以 9500×g离心 10 min。收集上清液为待测样液。胞外多糖含量采用蒽酮硫酸法测定,具体检测步骤如下:1) 精密称取0.100 g蒽酮试剂,溶解于100 mL 80%的浓硫酸溶液中,定容后轻轻混合均匀配制成蒽酮硫酸溶液,现配现用。2) 精密称取0.100 g葡萄糖标准品置于100 mL容量瓶中,蒸馏水定容后,稀释成不同浓度的葡萄糖溶液。3) 向试管中加入2 mL葡萄糖溶液,以蒸馏水为对照,每组实验3个重复。迅速加入6 mL蒽酮硫酸溶液,振荡充分混匀,置于95 ℃沸水中加热15 min后,迅速放在冰水中冷却15 min,测定在 625 nm处的吸光值,然后绘制标准曲线。4) 取2 mL待测溶液于试管中,同前一样的步骤,记录在625 nm处的吸光值,根据标准曲线,计算待测样品糖含量。
1.3.9 数据处理与统计分析
采用 GraphPad Prism version 7.00 统计软件进行单因素方差分析(One-way ANOVA)并做图,以P<0.05代表差异显著,数据用平均值±标准偏差表示。
2 结果与分析
2.1 DIM 对 S. enteritidis的 MBIC 结果
由图1可知,DIM在 7.8~31.2 µmol/L范围内随着浓度的升高,对S. enteritidis生物被膜的抑制效果呈现浓度依赖性增强。在31.2 µmol/L时对生物被膜的抑制率约35%,当浓度再升高时对生物被膜抑制效果无显著升高(P>0.05)。由此可知,DIM对S. enteritidis的 MBIC 为 31.2 µmol/L。
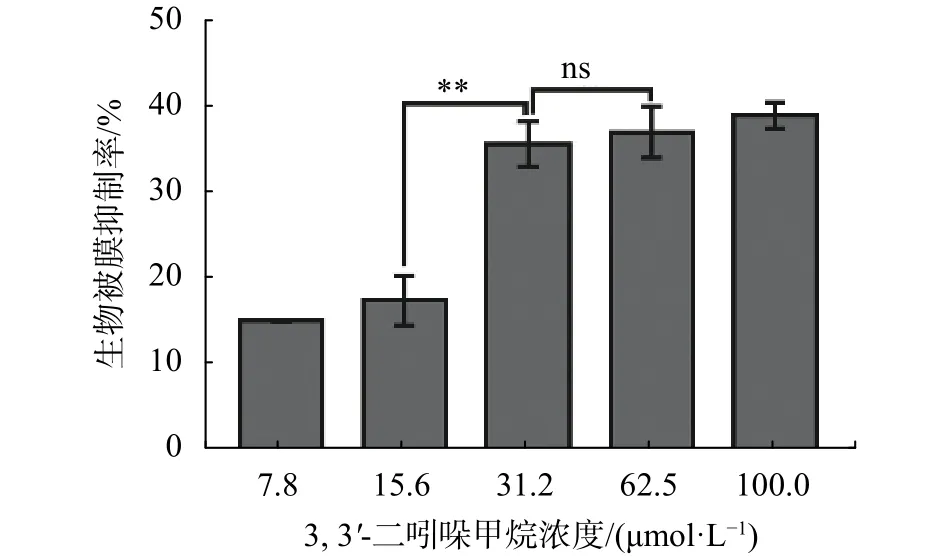
图1 DIM 对 S. enteritidis 生物被膜的影响
2.2 DIM 对 S. enteritidis生长的影响
对细菌生长和生物被膜结构的影响是评估生物被膜抑制剂效果的两个重要指标,有前景的生物被膜抑制剂应该是在抑制生物被膜的前提下,对细菌生长影响小或者几乎没有影响[14]。DIM对S. enteritidis生长的影响如图2所示,结果显示在培养48 h后,空白对照组和处理组的S. enteritidis细胞密度也没有显著差异 (P>0.05) (图2(a)) 。且 DIM 浓度在15.6 ~31.2 µmol/L 范围内,参与生物被膜形成的细菌代谢活性(被活细胞还原成的水溶性橙黄色甲臢产物在490 nm时的吸光值)以剂量依赖的方式减少,浮游细胞的代谢活性呈剂量依赖性增加,但对照组与处理组之间的代谢活性之和无显著差异(P>0.05) (图2(b)),证实 DIM 在测试浓度下对S.enteritidis无抗菌活性,即是指DIM的抗S. enteritidis生物被膜活性不是通过抑制生长实现的。

图2 DIM 对 S. enteritidis 生长的影响(空白对照 :2.5% DMSO)
2.3 DIM 对 S. enteritidis生物被膜结构的影响
经过结晶紫和Syto 9荧光染料对DIM处理后的S. enteritidis生物被膜染色结果如图3所示。普通光学显微镜图像显示对照组的生物被膜细胞团簇互相连接,而在实验组中可明显观察到生物被膜细胞团簇变小且分散(图3 (a))。在激光共聚焦显微镜图像中也观察到相似的结果,对照组中生物被膜的细胞团簇是互相连接的且荧光强度较强,在15.6~ 31.2 µmol/L范围内随着DIM浓度的增加,细胞团簇减少,荧光强度明显减弱,在31.2 µmol/L处理组中只能观察到分散的荧光微弱的细胞团簇(图3 (b))。扫描电镜图像可见对照组的生物被膜细菌数量多且排列紧密,经过15.6 µmol/L的DIM处理后的S. enteritidis生物被膜细菌数量明显减少,31.2 µmol/L的DIM处理的S. enteritidis生物被膜只分布了少数的单个菌落 (见图4)。
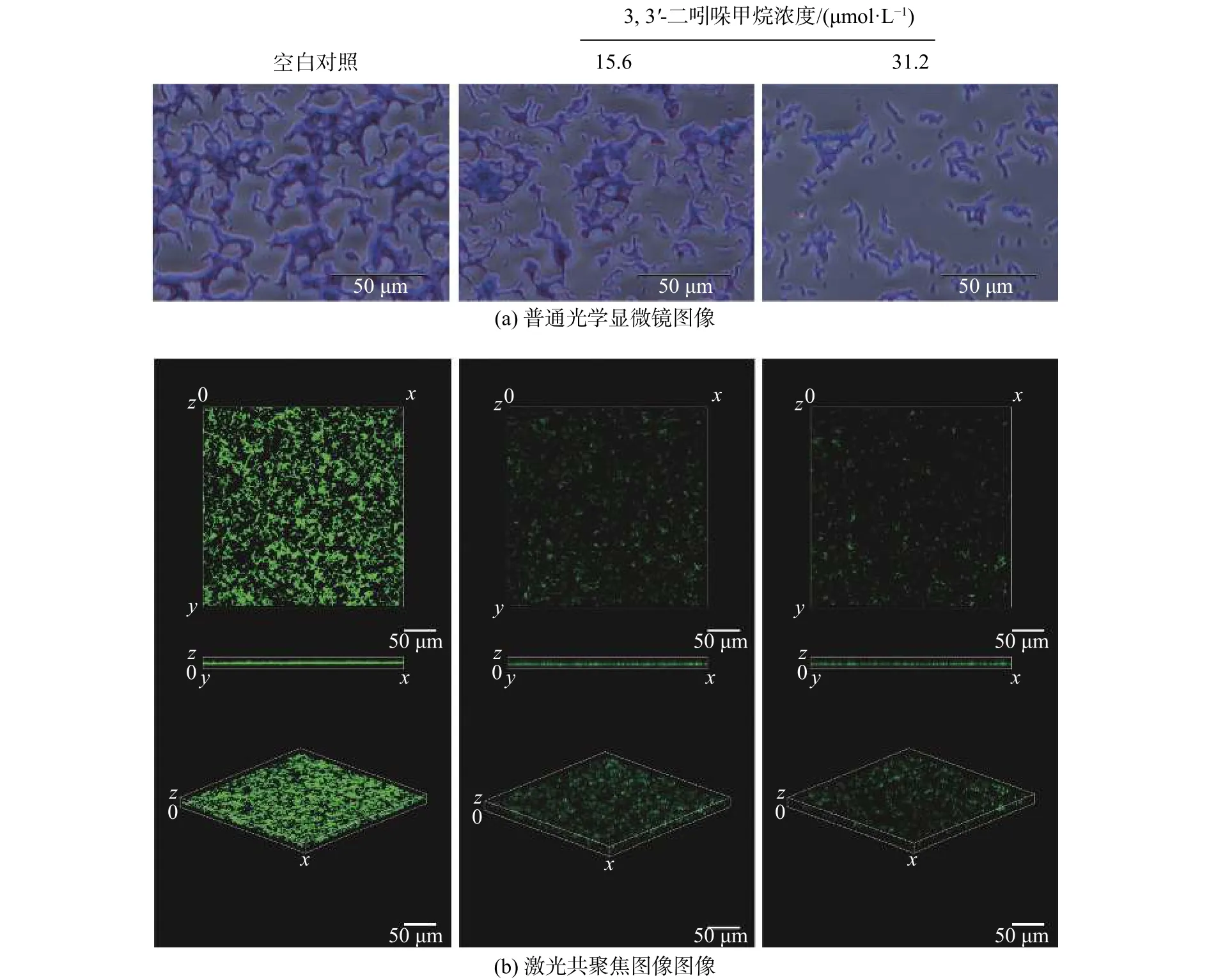
图3 DIM 对 S. enteritidis 生物被膜结构的影响(空白对照 :2.5% DMSO)

图4 扫描电子显微镜观察 DIM 对 S. enteritidis生物被膜结构的影响(空白对照 :2.5% DMSO)
激光共聚焦三维重建图像定量结果如表1所示,对照组中生物被膜厚度约为 25 µm,在 15.6~31.2 µmol/L内随着DIM浓度的增加生物被膜的厚度呈现浓度依赖性变薄,经过31.2 µmol/L的DIM处理后的生物被膜的厚度仅8 µm,相比对照组显著减少了约68% (P<0.05);对照组中生物被膜生物量约为9.615 µm3/µm2,经 15.6 µmol/L 和 31.2 µmol/L 的DIM 处理后分别为 2.828 µm3/µm2和 0.808 µm3/µm2,与对照组相比,处理组中单位面积生物量显著减少了约70%和91% (P<0.05)。结果说明,DIM明显抑制了生物被膜是三维结构形成且呈现浓度依赖性。
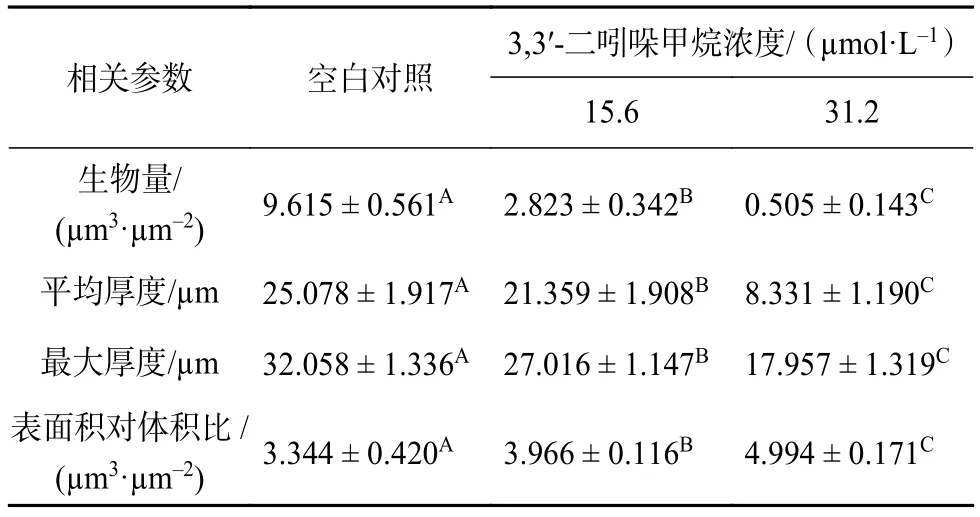
表1 COMSTAT2.1 分析 DIM 对 S. enteritidis生物被膜结构的影响1)
2.4 DIM 对 S. enteritidis生物被膜形成的影响
生物被膜形成大致分为初始粘附、细菌聚集、成熟和分散4个阶段,且在不同阶段,细菌所表现的生理特征各不相同[9],探究生物被膜形成过程有利于进一步研究DIM抑制生物被膜的机制。S.enteritidis生物被膜形成过程如图5所示,在0~8 h内OD570值偏低且上升缓慢,此时并未形成稳定的生物被膜;8~34 h内OD570值迅速上升,说明此时孔板中粘附的菌体越来越多;34~72 h内的OD570值基本稳定,说明生物被膜已经成熟,达到一个稳定的状态;72 h后OD570值不断下降,说明粘附的菌体不断脱落,生物被膜逐渐分散。由OD570变化趋势可知S. enteritidis生物被膜形成过程如下:0~8 h是初始粘附阶段,8~34 h 是细菌聚集阶段,34~72 h是生物被膜成熟阶段,72~120 h是生物被膜分散阶段。
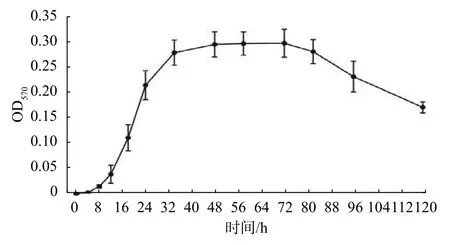
图5 S. enteritidis 生物被膜形成过程
为探究DIM对S. enteritidis生物被膜形成过程的影响,实验选择在生物被膜形成的不同阶段加入DIM。如图6所示,0 h添加DIM时对生物被膜的抑制率约为40%,6 h之后添加DIM,生物被膜抑制率逐渐降低,24 h之后添加DIM,生物被膜抑制率仅为10%。综上所述,DIM对S. enteritidis生物被膜的抑制作用主要体现在抑制生物被膜形成过程的初始粘附阶段和细菌聚集阶段。
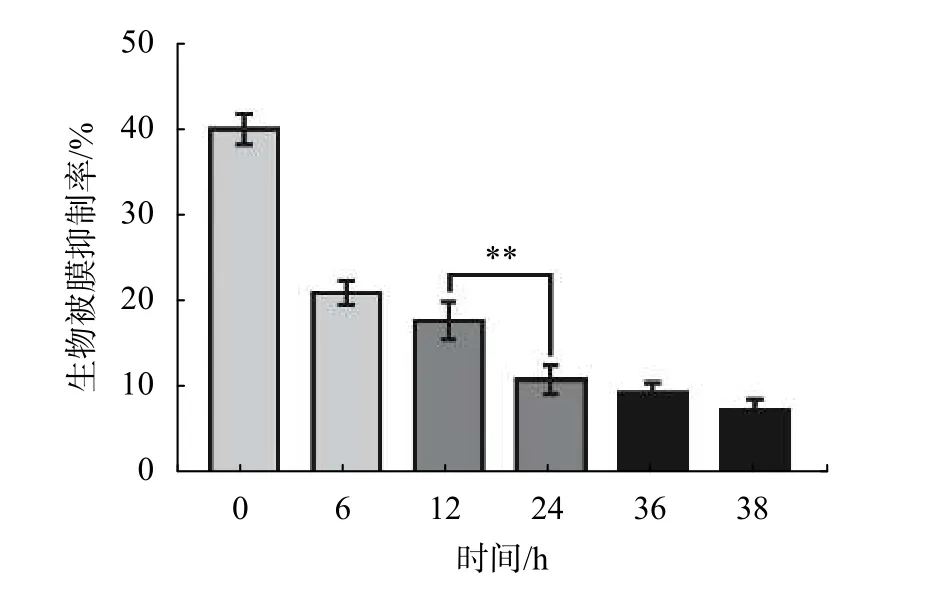
图6 DIM 对 S. enteritidis 生物被膜的影响(**P < 0.01)
2.5 DIM 对 S. enteritidis运动性的影响
在粘附初始阶段,运动性是微生物的一项重要生理活动,对细菌粘附表面和生物被膜的形成起着至关重要的作用[15]。由结果2.4可知DIM抑制了初始粘附阶段,因此实验探究了DIM对细菌运动性是否产生影响。S. enteritidis是一种有鞭毛的细菌,其运动性包含游动和群集/蜂拥两种,研究表明在不同琼脂含量的培养基中,细菌表现出的运动性也不同,琼脂含量为0.3%时,细菌的运动主要表现菌体游动,当琼脂含量为0.7%时,培养基中间隙较小,主要表现为群集运动[16]。DIM对S. enteritidis运动性的影响如图7所示,与对照组相比,在15.6 µmol/L至31.2 µmol/L范围内随着DIM浓度增加,S. enteritidis游动的直径逐渐减小,群集性能也逐渐减弱。

图7 DIM 对 S. enteritidis 游动 (A)和群集 (B)的影响
2.6 DIM 对 S. enteritidis eDNA 的影响
eDNA是一种普遍存在的胞外基质,研究表明,eDNA存在于细菌细胞表面,通过酸碱相互作用增强了粘附和表面聚集[17]。DIM对S. enteritidiseDNA释放的影响如图8所示,DIM显著抑制了S. enteritidiseDNA 的释放 (P<0.05),在 15.6 ~31.2 µmol/L 范围内随着DIM浓度增加,胞外基质中eDNA浓度从1.6 µg/mL 降低至 1.0 µg/mL,与对照组相比分别降低约46%和67%。
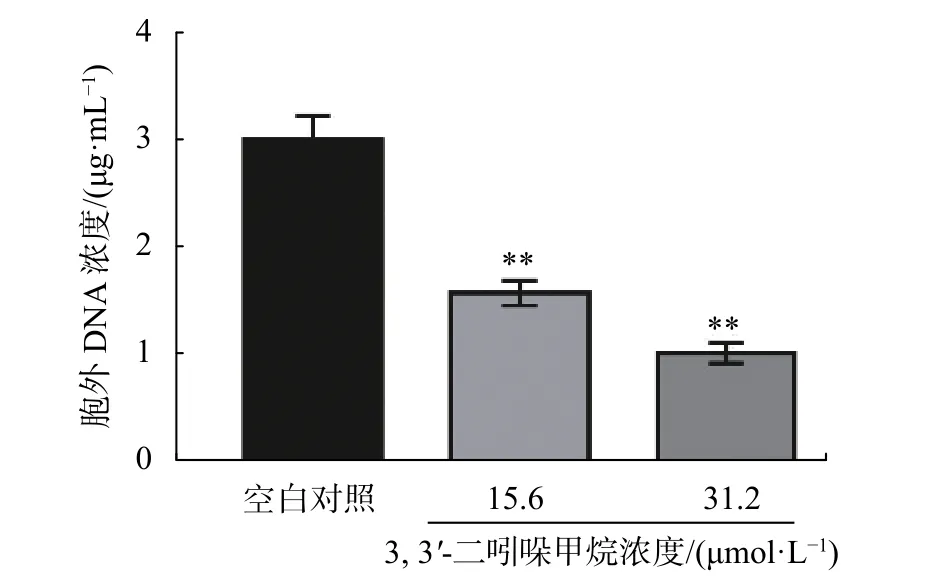
图8 DIM 对 S. enteritidis eDNA 释放的影响
2.7 DIM 对 S. enteritidis胞外多糖的影响
胞外多糖是保证生物膜三维结构完整性的重要因素,主要在生物被膜形成过程的细菌增殖阶段产生[18]。相关报道表明,有效的生物被膜抑制剂能抑制沙门氏菌胞外多糖的产生[19]。由图9可知,DIM显著抑制了S. enteritidis胞外多糖的产生(P<0.05),DIM 在 15.6 µmol/L 至 31.2 µmol/L 范围内,随着浓度的增加,胞外多糖浓度逐渐降低,在15.6 µmol/L处理下,胞外多糖含量为5.8 µg/mL,相对于对照组降低约48%,在31.2 µmol/L处理下,胞外多糖浓度降低至3.4 µg/mL,相对于对照组降低约70%。
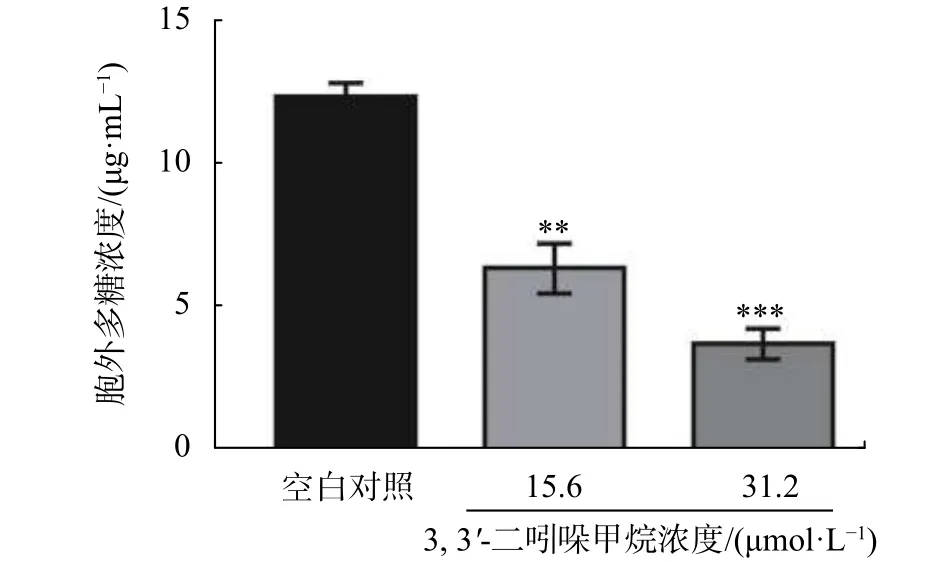
图9 DIM 对 S. enteritidis 胞外多糖的影响
3 结束语
沙门氏菌是导致食源性疾病的重要致病菌之一,能通过在食品接触表面甚至食品表面形成生物被膜来避免被清除[20]。生物被膜一旦成熟,其由EPS、eDNA、蛋白质等组成的ECM的阻隔性使消毒剂浓度在生物被膜中由外到内呈现梯度下降[6],导致不能完全消灭里层细菌,造成食品污染。因此,预防生物被膜形成对于保证食品安全尤为重要。
本研究表明,DIM使常见食源性致病菌S.enteritidis生物被膜厚度减少三分之二,有效抑制生物被膜形成三维结构。大多数细菌生物被膜的形成大致包含4个不同阶段(初始粘附、细菌聚集、成熟、分散),细菌在不同阶段表现出不同的生理活动。通过探究DIM具体作用阶段以及对相关生理活动的影响,发现DIM主要抑制生物被膜形成过程中的细菌粘附及聚集,细菌运动和胞外基质分泌分别在初始粘附和细菌聚集阶段起着关键作用[18]。本研究发现,DIM阻碍了S. enteritidis的游动和群集运动,可能通过抑制细菌运动性以及eDNA、胞外多糖的产生从而抑制S. enteritidis细菌粘附和聚集,导致生物被膜形成失败。且DIM的抗生物被膜活性不是通过抑制细菌生长实现的,因此具有不易诱导细菌产生抗性的优势,有良好的应用前景。

