γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的制备、表征及其对Pb(Ⅱ)的吸附研究
曹世权,王远曦,郑常义,戴学志,田 强,晏敏皓,3
(1. 西南科技大学 环境友好能源材料国家重点实验室,四川 绵阳 621010; 2. 西南科技大学材料科学与工程学院,四川 绵阳 621010; 3. 四川长晏科技有限公司,四川 绵阳,621000)
0 引 言
随着现代工业的飞速发展,工业污染物排放量及种类日益增加,尤其是以Pb(Ⅱ)等为代表的重金属污染,对人类健康及生态环境造成了极大危害,采用新型环境修复材料和技术实现对重金属等工业污染的高效治理是目前亟需解决的环境问题之一[1]。
最近,因超顺磁γ-Fe2O3纳米材料具有高比表面积、良好吸附性能、高稳定性、易通过磁分离实现循环再利用等优点,其在环境修复领域特别是在重金属去除中的应用成为研究热点[2-3]。通常采用表面接枝有机物的方法来提高超顺磁γ-Fe2O3纳米材料在水环境中的稳定性,并利用有机物中的特殊官能团与金属离子的相互作用实现对污水中重金属离子的吸附脱除。如含-NH2的有机物对 Cu(Ⅱ)、Ni(Ⅱ)、Pb(Ⅱ)等以及含-COOH 的有机物对 Cu(Ⅱ)、Zn(II)等分别具有良好的吸附性能[4]。天然高分子壳聚糖(Chitosan, CTS)作为代表性环境修复材料,对重金属Pb(Ⅱ)具有优异的吸附性能且具有良好的化学稳定性,其应用的局限性在于与重金属相互作用后难以实现固液分离及循环利用[5]。通过将壳聚糖交联包覆在超顺磁性纳米颗粒表面,可实现对Cr(VI)等的良好吸附及吸附材料的磁分离循环再利用[6]。已报道的超顺磁纳米颗粒/壳聚糖复合材料通常采用交联改性法制备,工艺较繁琐,制备过程中通常需使用联胺等有毒交联剂,易造成二次污染[7-8]。因此,评价超顺磁纳米复合材料作为环境修复材料的优劣时,需兼顾其吸附性能、制备方法及所带来的二次污染问题。
透射电镜、扫描电镜等电子显微技术是表征纳米材料结构的通用手段,可用于测量可视化颗粒的结构和定量颗粒的尺寸分布,但这类测试技术要求将样品进行干燥处理。对于液态胶体样品,干燥过程易受外界的物理作用而改变聚集结构,无法获得胶体在液相中的尺寸及结构信息。动态光散射(dynamic light scattering,DLS)、小角 X 射线散射(small-angle X-ray scattering, SAXS)等光散射技术可对液态胶体进行原位测试,能有效获取胶体在液相环境中的真实信息,测量数据具有实时性和统计性[9]。至今,光散射技术用于表征胶体材料与重金属离子相互作用的研究报道较少[10]。
针对用于重金属去除研究的改性超顺磁纳米复合材料的制备方法及原位表征手段的不足,本文利用天然有机高分子壳聚糖(低分子量)对γ-Fe2O3超顺磁性纳米颗粒进行改性,制备得到软团聚的胶体,利用动态光散射、小角X射线散射技术对胶体结构进行了原位表征,并研究了该胶体对重金属Pb(Ⅱ)的吸附性能。
1 实验部分
1.1 试剂与仪器
FeCl2·4H2O、FeCl3·H2O 购于天津大茂化学试剂有限公司,氨水、HNO3、Fe(NO3)3·9H2O、37% 浓盐酸、冰醋酸、丙酮、低分子量壳聚糖购于成都科隆试剂厂,所有试剂均为分析纯。重金属样品由国家有色金属及电子材料分析中心提供;实验用水为实验室自制超纯水(电阻率18.24 MΩ/cm,四川优普超纯水仪)。
采用振动样品磁强计(BKT-4500,北京泽天伟业科技有限公司)测试样品的磁学性质;采用小角X射线散射仪(SAXSpace,奥地利安东帕公司)和动态光散射仪 (Nanobrook Elite Sizer Omni,美国布鲁克海文仪器公司,光源为640 nm的半导体红光激光器)测试样品的流体力学直径;采用恒温振荡器(SHZ-82A,常州江南实验仪器厂)及电感耦合等离子体光谱仪(ICP-6300,美国热电公司)研究复合胶体体系对Pb(Ⅱ)的吸附性能。
1.2 实验方法
1.2.1 γ-Fe2O3超顺磁纳米颗粒的制备
采用共沉淀法制备γ-Fe2O3超顺磁纳米颗粒,其制备过程如图1所示[11]。将10 mL 37%盐酸加入50 mL超纯水中稀释制备盐酸稀溶液,称取18.0 g FeCl2·4H2O加入盐酸稀溶液溶解。称取 19.3 g FeCl3·6H2O 加入 70 mL 超纯水溶解,将 FeCl3·6H2O水溶液加入FeCl2·4H2O盐酸稀溶液中,25℃条件下搅拌反应30 min。反应结束后用超纯水反复洗涤,用外磁场分离出磁性Fe3O4。再向上述Fe3O4中加入 36 mL 浓硝酸和 32.0 g Fe(NO3)3·9H2O,在80 ℃ 水浴反应 60 min,将 Fe3O4进一步氧化得到 γ-Fe2O3分散液。通过沉淀分散法在外磁场中梯度分层得到分散性小、尺寸均一的纳米颗粒胶体。最后用丙酮洗涤胶体中残余硝酸,40 ℃水浴恒温12 h使丙酮完全挥发,用20%的稀硝酸调节pH为2后置于冰箱备用。
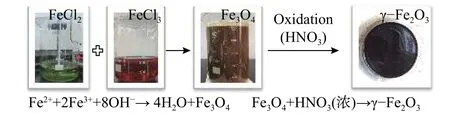
图1 γ-Fe2O3超顺磁纳米颗粒的制备过程示意图
1.2.2 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的制备
称取0.5 g壳聚糖溶于500 mL超纯水中,调节pH为2.5使壳聚糖充分溶解,量取50 mL质量分数1%的γ-Fe2O3分散液,将γ-Fe2O3分散液滴加到壳聚糖水溶液中,25℃条件下搅拌反应3 h。调节体系pH至6.0,外磁场分离除去未被缠绕的壳聚糖。加入超纯水并调节pH至2.5,制备得到准团聚的胶体。按照上述方法,令超顺磁纳米颗粒的浓度为1%,调整壳聚糖质量分数为0.05%,0.1%,0.2%,0.3%,分别制备得到 005CTS-NPs,01CTS-NPs,02CTSNPs,03CTS-NPs不同配比的准团聚胶体备用。
1.2.3 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体对Pb(Ⅱ)的吸附性能考察
取质量分数为1%的CTS-NPs复合胶体10 mL置于 50 mL 离心管中,加入 100 mg/L 的 Pb(Ⅱ)标准溶液10 mL,将离心管置于恒温振荡器上以200 r/min的速度震荡120 min后。取出用外磁场进行磁分离,取上层清液通过电感耦合等离子体光谱仪测定复合胶体吸附后溶液中Pb(Ⅱ)的含量,并通过式(1)计算吸附平衡常数,评价胶体对Pb(Ⅱ)的吸附性能。
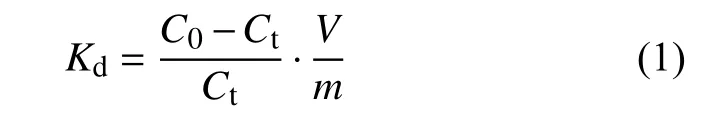
式中:Kd——吸附平衡常数,mL/g;
C0、Ct——溶液中重金属的初始浓度和达到吸附平衡时的浓度,mg/L;
V——吸附体系的体积,mL;
m——吸附剂的质量,g。
按照此实验方法进行单因素吸附实验,具体如下:1)在室温下,分别调节体系pH为2~7,振荡12 h使其达到吸附平衡,外磁场作用3 h后测上清液剩余Pb(Ⅱ)含量,计算不同pH条件下胶体吸附Pb(Ⅱ)的吸附平衡常数Kd,获得最佳pH;2)在室温和最佳pH条件下,研究不同壳聚糖浓度(0.00%,0.05%,0.10%,0.20%,0.30%)条件下胶体吸附Pb(Ⅱ)的吸附平衡常数Kd,获得最佳壳聚糖浓度;3)在室温下、最佳pH及最佳壳聚糖浓度条件下,研究不同振荡时间 (10 ,20,30,40,50,60,120 min)条件下胶体吸附Pb(Ⅱ)的吸附平衡常数Kd。上述单因素实验均经8000 r/min 离心 10 min 后取上清液测试剩余 Pb(Ⅱ)含量,评价吸附条件对吸附平衡常数Kd的影响。
2 结果与讨论
2.1 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的表征
图2所示为γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的室温磁滞回线。复合胶体的磁化饱和强度(M)随着外磁场(H)的增强而迅速增强,在200 kA/m 附近就达到了 40 A·m2/kg。磁化与退磁过程没有出现磁滞现象,在外磁场为0附近时复合胶体的剩磁为0,且矫顽力小到可以忽略不计,表明γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体仍保留了超顺磁性。
在超顺磁纳米颗粒的制备过程中,pH值降低会使纳米颗粒被质子化的程度增加,从而可通过调节体系pH值来破坏颗粒的静电平衡以实现分离。外磁场作用能将溶液中较大的颗粒优先沉积聚集,经多次逐步磁分离可得到如图3所示含分布均一、多分散性较小的超顺磁纳米颗粒的分散液。将分散液用pH为2的硝酸稀释200倍,再经0.2 µm微孔过滤器过滤之后上机测得纳米颗粒的水合直径D0为 (16 ± 1) nm,分布系数s= 0.089。
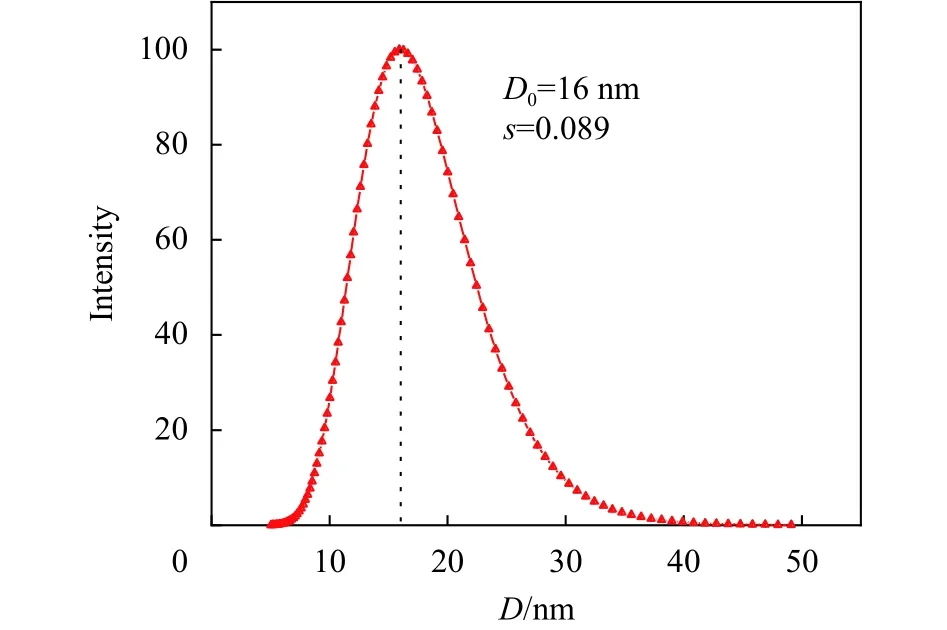
图3 γ-Fe2O3超顺磁纳米颗粒的粒径分布图
图4为γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体随着壳聚糖浓度变化的粒径分布、DLS及pH为3.0时的Zeta电位图。相比于图3,图4(a)是以0.1%的壳聚糖与1%的纳米颗粒复合得到的胶体,其水合直径较纯超顺磁纳米颗粒明显增大,为(35 ±4) nm,分布系数也有所增大,为0.168。这是由于超顺磁纳米颗粒附着在呈无规线团状的壳聚糖上,限制了纳米颗粒在溶液中的扩散,而导致水合直径增大。此外,由于纳米颗粒与壳聚糖分子在数量上是不对等的,体系中仍然存在未与壳聚糖结合的颗粒,而使得分布系数有所增加。图4(b)为壳聚糖浓度对超顺磁纳米颗粒复合胶体粒径及Zeta电位的影响,可以看出准团聚胶体尺寸及Zeta电位均随着壳聚糖浓度的增加而增加。这是由于体系内壳聚糖浓度增加,线性分子结构的壳聚糖相互缠绕几率变大,聚集的颗粒变多,导致胶体的相对尺寸逐步增大。壳聚糖浓度从0.2%增加到0.3%,胶体的水合直径剧烈增加,表明壳聚糖分子链间的相互缠绕起了主要作用,壳聚糖浓度也达到了体系壳聚糖浓度的极限值。此外,壳聚糖浓度增加到0.3%、Zeta电位增加到(43±3) mV后不再继续增大,表明此时胶体体系达到最大稳定程度,壳聚糖分子链上含有的-NH2、-OH等与纳米颗粒形成了较稳定配位和静电平衡。壳聚糖浓度继续增加,体系中游离的纳米颗粒均与壳聚糖复合在一起,胶体粒子与粒子间形成竞争关系,壳聚糖浓度不再成为对胶体稳定性的直接影响因素。
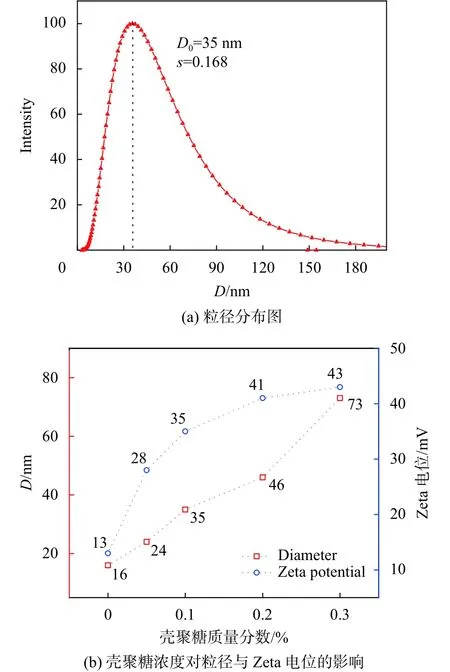
图4 壳聚糖浓度对γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体粒径及Zeta电位的影响
由于DLS表征的是胶体粒子的水合直径,无法精确获得纳米颗粒和复合胶体的尺寸信息,因此进一步采用SAXS对体系进行辅助表征。由于超顺磁性纳米颗粒、复合胶体粒子之间不存在相互作用,而散射强度等于所有粒子散射信号的叠加,故可采用多分散粒子模型对数据进行分析处理[12-13]。对于纳米颗粒及胶体粒子,散射强度可表达为下式:
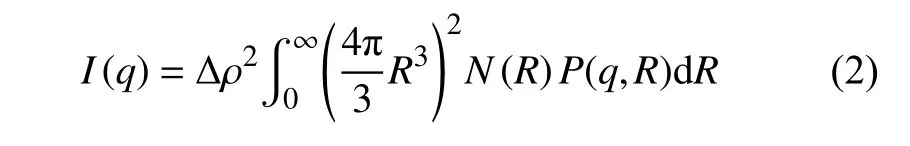
式中:Δρ——粒子与基体的散射长度密度差;
P(q,R)——半径为R的球形孔洞的形状因子;
N(R)——尺寸分布函数;
N(R)dR——单位体积内尺寸介于R与R+dR之间的粒子数量。
通过多分散粒子模型拟合得到SAXS曲线如图5(a)所示,可以发现散射点与拟合曲线几乎完全重合。图5(b)为拟合得到的超顺磁纳米颗粒的粒径分布图,颗粒半径约为 4.5 nm (直径约为 9.0 nm),比DLS得到的粒子流体力学直径小,更贴合真实尺寸。
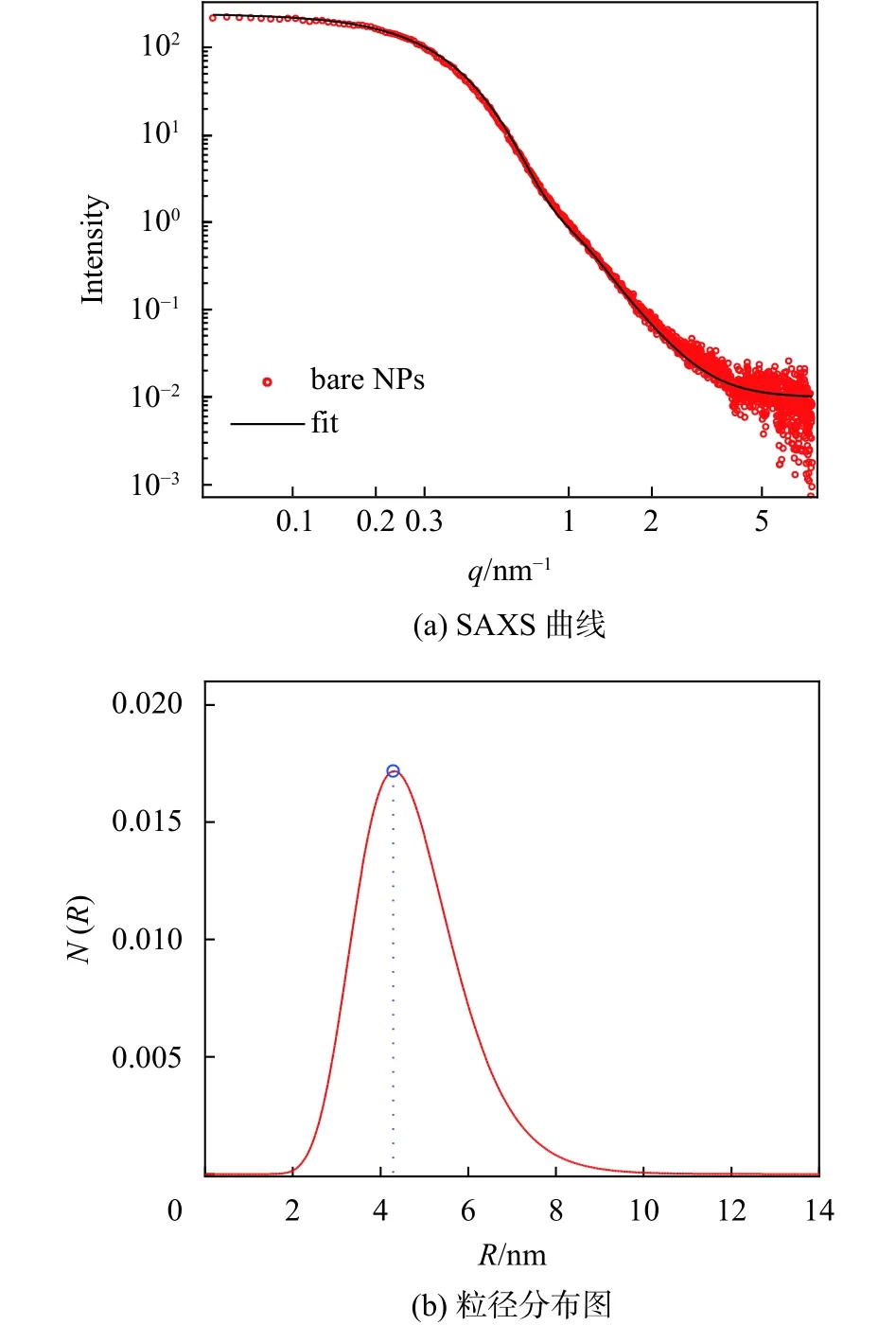
图5 γ-Fe2O3超顺磁纳米颗粒的 SAXS曲线及粒径分布图
图6(a)为 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的SAXS曲线图,图6(b)中拟合得到的复合胶体颗粒平均半径仍约为4.0 nm,即壳聚糖的加入没有改变体系中粒子的尺寸。SAXS的X射线能穿透壳聚糖有机高分子,说明少量壳聚糖的加入未能使超顺磁纳米颗粒真正聚集并形成团聚体。由于壳聚糖的加入使得散射矢量在q<0.3 nm–1的区域有明显的上翘趋势,说明体系中出现了软团聚现象。γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体示意图如图7所示。
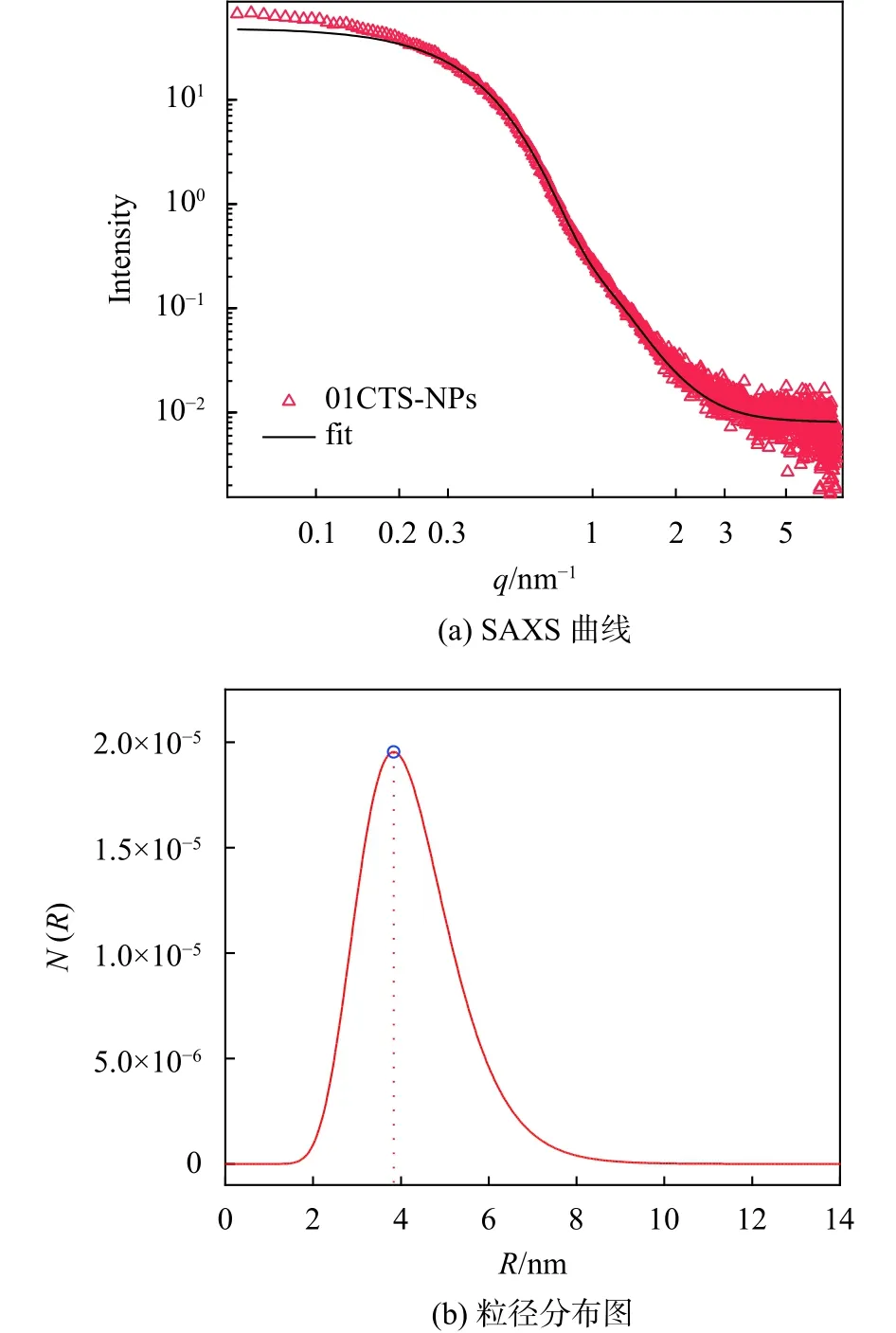
图6 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体的SAXS曲线及粒径分布图
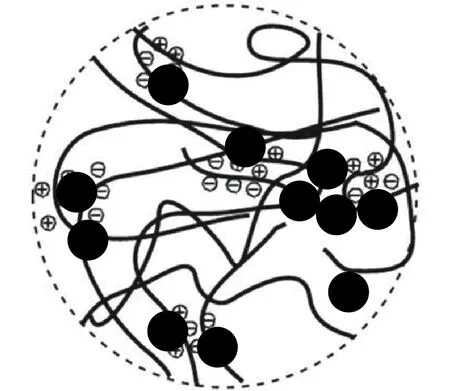
图7 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体示意图
为了研究壳聚糖浓度对复合胶体体系粒子尺寸分布的影响,采用同样的方法对不同浓度壳聚糖与超顺磁纳米颗粒复合之后进行SAXS表征,结果如图8所示。随着壳聚糖浓度的增加,在散射矢量q<0.3 nm–1的区域,散射强度与拟合曲线的偏差明显增大。在该区域使用Guinier定理结合多分散粒子模型,可以拟合得到团聚体的尺寸[14]。Guinier定理表达如下:
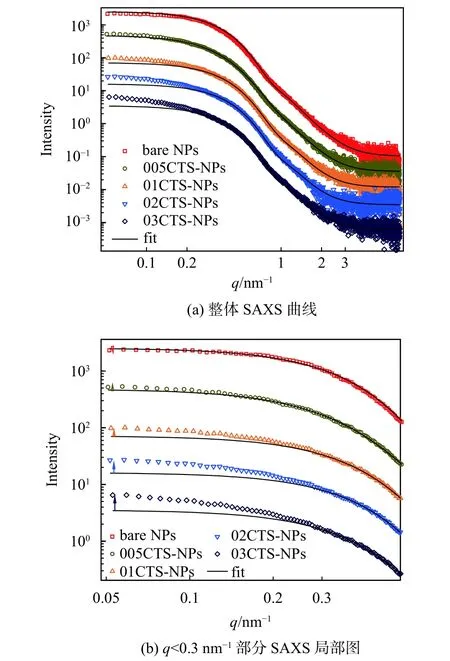
图8 超顺磁纳米准团聚复合胶体的SAXS曲线拟合图
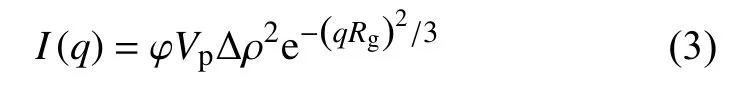
式中:Rg——散射粒子的回转半径,nm;
q——散射适量数值,nm–1;
Δρ——散射粒子与基体的散射长度密度差,cm–1;
φ——粒子的体积浓度;
Vp——一个粒子的体积,cm3。
通过拟合得到团聚体005CTS-NPs、01CTS-NPs、02CTS-NPs和 03CTS-NPs的半径分别为 12.0 nm、15.0 nm、19.0 nm 和 25.0 nm,说明壳聚糖分子链上大量的-NH2、-OH等官能团与γ-Fe2O3的静电作用成功促使纳米颗粒团聚而形成了软团聚胶体。
2.2 γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体对Pb(Ⅱ)的吸附性能
图9绿色曲线(方形符号)为γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体在不同pH值条件下对Pb(Ⅱ)的吸附平衡常数Kd曲线。随着pH值的增加,复合胶体对Pb(Ⅱ)的吸附平衡常数呈先增大后减小的趋势,并在 pH 6.0 时达到最大值 5.1×103mL/g。可能的原因是当pH<6.0时,壳聚糖分子链在强酸中易被水解,使得吸附效果不佳;此时的超顺磁性纳米颗粒表面被质子化程度较高,在溶液中多呈现为游离的纳米颗粒从而使得分离受限,残留在上清液的Pb(Ⅱ)较多。而当pH>6.0时,壳聚糖的溶解度下降,在溶液中分子链呈蜷缩状态,分子链上的官能团与Pb(Ⅱ)接触概率降低,导致吸附性能下降。由图9中可看出当pH从5.5左右开始其分配吸附系数Kd已达到 4.6×103mL/g,则能实现对 Pb(Ⅱ)有效吸附的pH范围为5.5~7.0,pH 6.0为最佳吸附的pH值。
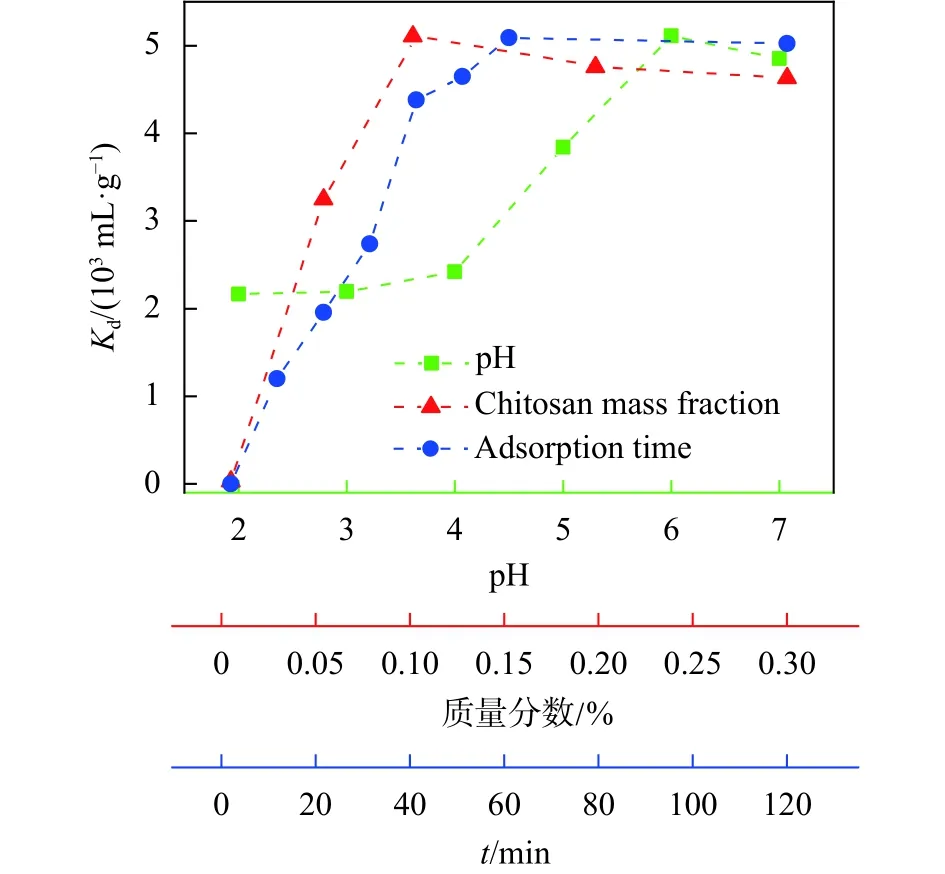
图9 pH值、壳聚糖质量分数及吸附时间对吸附平衡常数的影响
图9中红色曲线(三角符号)为壳聚糖浓度对复合胶体吸附性能的影响。随着壳聚糖在复合胶体中比例的增加,对Pb(Ⅱ)吸附性能呈先增加再减小的趋势。壳聚糖质量分数为0即裸颗粒时,Kd值为 29.0 mL/g,说明超顺磁纳米裸颗粒对Pb(Ⅱ)几乎没有吸附性能。壳聚糖质量分数为0.05%时,复合胶体对Pb(Ⅱ)的吸附性能明显增加,此时Kd达到3.2×103mL/g。表明壳聚糖的加入使得胶体体系含较多-NH,-OH等官能团,对Pb(Ⅱ)的吸附性能提高。当壳聚糖浓度增加到0.1%时,吸附能力成倍增加,表明对Pb(Ⅱ)的吸附过程中占主导作用的是壳聚糖。继续增加壳聚糖的浓度,Kd有所减小,可能原因在于壳聚糖浓度增加,体系粘度增大,在磁分离过程中外磁场不能满足分离需要的磁力,导致残留在上清液中的Pb(Ⅱ)较多,Kd降低。
吸附速率是评价吸附剂吸附性能的重要参数。图9中蓝色曲线(圆形符号)为吸附时间对Pb(Ⅱ)吸附平衡常数的影响曲线,在0~60 min内胶体的Kd逐渐增加,10 min 时Kd=1198.1 mL/g,60 min 时达到吸附平衡,说明复合胶体对Pb(Ⅱ)的吸附平衡时间约为 60 min,此时Kd=5089.2 mL/g。
为了进一步判别γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体对Pb(Ⅱ)的吸附是以物理吸附还是化学吸附为主,借助准一级、准二级吸附动力学模型对吸附数据进行拟合[15],并评估吸附过程的性质。以下公式分别为准一级、准二级动力学吸附模型公式:
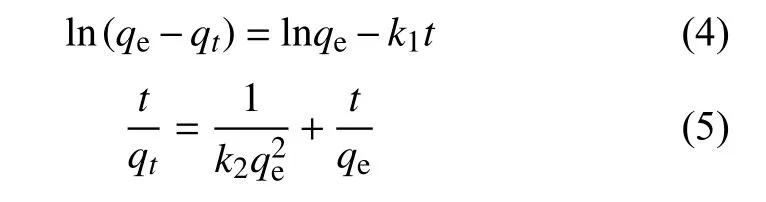
式中:t——吸附时间,min;
qt——单位吸附剂t时刻吸附Pb(Ⅱ)的量,mg/g;
qe——吸附平衡时单位吸附剂吸附Pb(Ⅱ)的量,mg/g;
k1——准一级动力学模型的速率常数,1/min;
k2——准二级动力学模型的速率常数,g/(mg·min)。
图10为准一级和准二级动力学吸附模型公式对实验数据的非线性拟合曲线,拟合参数列于表1中。由线性关系r2(0.99734>0.99008)可知,γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体对Pb(Ⅱ)的吸附更符合准二级动力学模型,表明复合胶体对Pb(Ⅱ)的吸附以化学吸附为主,其拟合的最大吸附容量qmax=42.9 mg/g,与真实吸附容量良好吻合。
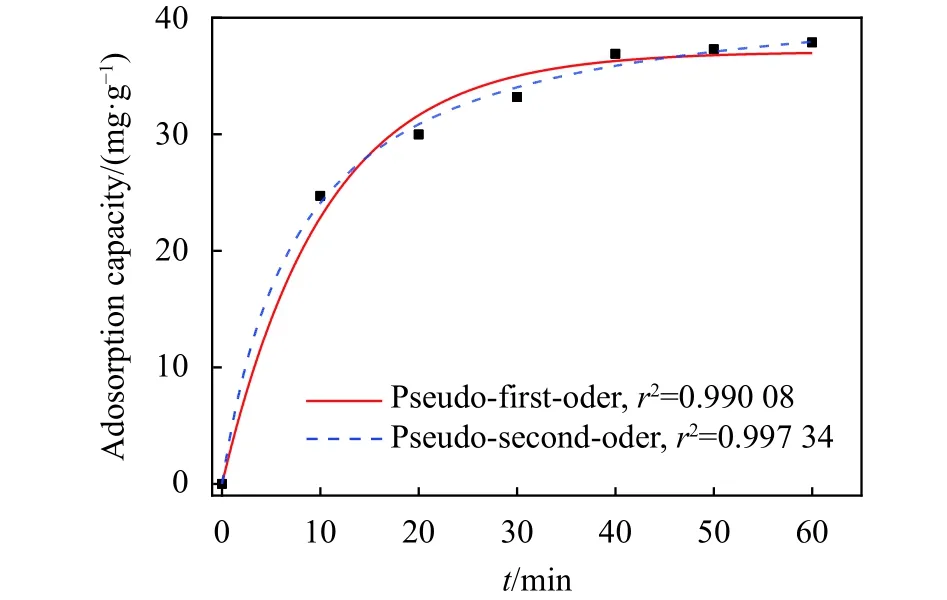
图10 准一级、准二级动力学吸附模型拟合曲线

表1 准一级和准二级动力学吸附模型拟合参数
3 结束语
本研究将γ-Fe2O3超顺磁纳米颗粒的磁性和天然有机高分子壳聚糖对重金属Pb(Ⅱ)的吸附性能相结合,通过相对简单且无二次污染的方法制备了γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体。利用DLS与SAXS技术对胶体粒径及结构进行表征,γ-Fe2O3超顺磁纳米颗粒呈分布均一的单分散体系,与壳聚糖复合后呈软团聚的胶体结构,其对Pb(II)具有优异的吸附性能,吸附过程以化学吸附为主,符合准二级吸附动力学模型,最大吸附容量为42.9 mg/g。能实现对Pb(Ⅱ)实现有效吸附的pH范围为5.5~7.0,pH为6时,吸附平衡时间为60 min,吸附平衡常数Kd= 5.1 × 103mL/g。综上可知,本研究制备的γ-Fe2O3超顺磁纳米颗粒/壳聚糖复合胶体对Pb(Ⅱ)有优异的吸附性能,可为水环境中类似重金属离子吸附材料的制备提供参考,在环境修复领域具有良好的应用前景。

