miR-875-5p通过靶向USF2抑制胃癌细胞的增殖、迁移和侵袭
高慎硕,张智凯,尹国庆,张红霞,王绪斌,马岩,刘洪俊,李乐平,郭晓波(.山东大学附属省立医院 胃肠外科,山东 济南 500;.山东第一医科大学附属青州医院 胃肠外科,山东 青州 6500;.山东第一医科大学 临床医学院,山东 济南 507)
胃癌是消化道最常见的恶性肿瘤之一[1]。在世界范围内胃癌的发病率和病死率分别排名第六位和第二位,每年新发病例超过100 万例,死亡72.3 万例[2]。2020年中国胃癌新发病例47.8万(占全球新发病例的43.9%),死亡37.3 万例(占全球死亡病例的48.5%)[3]。由于缺乏有效的早期诊断生物标志物,胃癌确诊时往往已经发展到晚期,而晚期或转移性胃癌患者的5 年生存率仅为5%~20%。为改善胃癌患者的预后,需要更加有效的早期诊断生物标志物。miRNA 是一类小型、高度保守的由内源基因编码的非编码单链RNA分子,长度为19~25个核苷酸,在细胞增殖、迁移、分化、凋亡等过程中起重要作用[4-5]。miR-875-5p 在许多疾病中均表达异常,包括妊娠期糖尿病、肝纤维化、肺癌、食管癌、肝细胞癌和甲状腺癌等[6-11]。上述研究结果表明,miR-875-5p 在肿瘤的发生发展中起重要作用。上游刺激因子2(upstream stimulatory factor 2,USF2)在多种恶性肿瘤中异常高表达。目前,miR-875-5p 通过调控USF2 对胃癌的作用及其机制尚少见文献报道。因此,本研究过表达或抑制miR-875-5p 后,检测胃癌细胞生物学特性及USF2 蛋白的改变,探讨miR-875-5p 对胃癌细胞增殖、迁移和侵袭的影响及其潜在的作用机制,旨在为胃癌的早期诊断与治疗提供新的生物标志物与靶标。
1 材料与方法
1.1 细胞、实验动物及主要试剂
人胃癌细胞BGC-823、HGC-27、MGC-803、SGC-7901、MKN-45、AGS 和人胃黏膜细胞GES-1 购自中国科学院上海生物化学与细胞生物学研究所。雄性、4~6 周龄、16~20 g 的BALB/c 无胸腺裸鼠购自北京维通利华公司(实验动物合格证号:No.110011211102374973)。
RPMI 1640培养基、Opti-MEM减血清培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)均购自美国Gibco公司,青、链霉素购自上海碧云天公司,RNA抽提试剂TRIzol、逆转录试剂盒、SYBR Green PCR Master Mix 购自日本TaKaRa,miR-875-5p模拟物(mimic)和抑制剂(inhibitor)购自上海吉玛生物公司,U6及miR-875-5p引物购自锐博生物公司,苯甲基磺酰氟(PMSF)购自北京索莱宝科技有限公司,ECL发光试剂盒购自美国Millipore 公司,RIPA 蛋白裂解液、BCA 蛋白质测定试剂盒、SDS-PAGE 凝胶配制试剂盒均购自上海碧云天生物技术有限公司,USF2 抗体、LipofectamineTM3000 转染试剂购自Invitrogen 公司,兔抗人GAPDH抗体和HRP标记的山羊抗兔二抗购自武汉三鹰公司,Transwell 小室和基质胶购自美国Corning公司,CCK-8试剂盒购自美国MCE公司。
1.2 细胞培养、转染与分组
细胞用含10%FBS、100 U/mL青霉素和100 mg/mL链霉素的RPMI 1640 培养基常规培养。当细胞汇合度达到50%~70%时,参照LipofectamineTM3000 转染试剂说明书的方法进行转染,将miR-875-5p mimic及阴性对照(miR-NC)、miR-875-5p inhibitor 及阴性对照(Anti-miR-NC)分别转染至AGS 细胞或MKN-45细胞中,空白对照组(Control 组)不转染。实验分为Control 组、miR-875-5p mimic 组、miR-NC 组、miR-875-5p inhibitor组和Anti-miR-NC组。
1.3 qPCR法检测胃癌细胞中miR-875-5p的表达水平
细胞转染48 h 后,用TRIzol 试剂提取培养细胞的RNA,用紫外分光光度计测定RNA 浓度及纯度,并将RNA逆转录为cDNA,进行qPCR扩增,U6 用作内参照。另外,解链曲线用于评估非特异性扩增。引物序列(5'-3'):miR-875-5p上游为GCGGGC GGTATACCTCAGTTTTAT,下游为ATCCAGTGC AGGGTCCGAGG;U6上游为GGAACGATACAG AGAAGATTAGC,下游为TGGAACGCTTCACGA ATTTGCG。qPCR 反应条件:95 ℃持续30 s;95°C 5 s,60°C 30 s,共进行40 个循环。使用2-ΔΔCt方法计算目的基因miRNA的相对表达量。
1.4 双荧光素酶报告基因实验验证miR-875-5p 与USF2的靶向关系
通过TargetScan(http://www.targetscan.org/vert_71)、miRmap(https://mirmap.ezlab.org/)和Starbase(https://starbase.sysu.edu.cn/)数据库预测miR-875-5p的靶基因,分析miR-875-5p与USF2 mRNA之间的互补结合位点。在含10%FBS的RPMI 1640培养基中培养AGS细胞,按照LipofectamineTM3000转染试剂说明书方法,将含psiCHECK2-hUSF2-3′UTR的野生型(WT)和突变型(MUT)报告基因质粒与miR-875-5p mimic或miR-NC共转染至细胞中,培养48 h后,用双荧光素酶活性检测试剂盒检测转染细胞中荧光素酶活性。
1.5 WB法检测AGS 和MKN-45细胞中USF2 蛋白表达水平
细胞转染72 h 后,用BCA 蛋白质测定试剂盒测定蛋白质浓度,用10%SDS-PAGE 分离蛋白质(每个样品20 μg),将蛋白质转移到NC 膜上。在5%脱脂牛奶中封闭印迹膜30 min 后,加入抗USF2(1∶1 000)、抗GADPH(1∶10 000)一抗,4 ℃过夜。TBST洗膜后,室温下加入HRP标记的山羊抗兔二抗(1∶5 000)中处理1 h。采用增强的化学发光法对蛋白质条带进行曝光,以GADPH 用作内参照,使用ImageJ软件分析蛋白条带的灰度值。
1.6 克隆形成实验检测AGS和MKN-45细胞的增殖能力
将各组转染后细胞用胰蛋白酶消化,计数并以1×103细胞的密度重新铺板。每3 d更换一次培养基。10 d 后,用PBS 洗涤细胞,4%多聚甲醛固定30 min,后用1%结晶紫溶液染色30 min 以进行可视化和计数,计算克隆形成率[(克隆数/接种细胞数)×100%]。
1.7 CCK-8法检测AGS和MKN-45细胞的增殖能力
细胞转染24 h后,按CCK-8试剂盒说明方法,将AGS 和MKN-45 细胞接种到96 孔板(2.0×103个/孔)中,每孔中加入10 μL CCK-8试剂,1 h后上酶标仪检测波长在450 nm 处每孔的光密度(D)值,以D值表示细胞增殖能力。
1.8 Transwell 实验检测AGS 和MKN-45 细胞的迁移和侵袭能力
细胞转染24 h 后,通过胰蛋白酶消化,收集细胞。将Transwell 小室置于24 孔培养板孔中,将上室和下室分开。在Transwell 下室中添加600 μL 含20%FBS 的RPMI 1640 培养基,将250 μL 含5×104个细胞的无血清培养基添加到Transwell 上室,进行细胞迁移实验。进行细胞侵袭实验时,使用加入预铺基质胶的上室。在37 ℃、5%CO2条件下培养24 h 后,用棉签除去上室中残留的细胞。侵袭小室基膜的细胞在4%多聚甲醛中固定20 min,1%结晶紫染色20 min后PBS 冲洗、封片,在光学显微镜下随机选取5 个视野进行观察、计数迁移或侵袭细胞数并拍照。
1.9 裸鼠MKN-45细胞移植瘤模型的构建及观察
转 染miR-875-5p mimic 和miR-NC 至MKN-45细胞,将处于对数生长期的5×105个细胞悬浮在100 μL的PBS中,随后接种到裸鼠的右腋部皮下,实验分为空白对照组、miR-NC 组和miR-875-5p mimic 组,每组3 只。每4 d 通过用游标卡尺测量长度(L)和宽度(W)来测量移植瘤的大小,并按照公式(L×W2)/2计算移植瘤的体积。28 d后处死裸鼠并剥离移植瘤,测量移植瘤体积。
1.10 统计学处理
以上所有实验均独立重复3次。采用SPSS 19.0软件进行数据分析,符合正态分布的计量数据以表示,两组间数据比较采用t检验,多组间比较采用单因素方差分析,以P<0.05 或P<0.01 表示差异有统计学意义。
2 结果
2.1 miR-875-5p在胃癌细胞中呈低表达
qPCR 法检测结果(图1)显示,与GES-1 细胞相 比,BGC-823、HGC-27、SGC-7901、MGC-803、MKN-45和AGS细胞中miR-875-5p的表达均显著降低(均P<0.01)。结果表明,miR-875-5p 在胃癌细胞中呈低表达,以在AGS细胞中表达最低,MKN-45细胞中表达最高,因此,后续实验选择AGS 细胞转染miR-875-5p mimic 构建过表达细胞,MKN-45 细胞转染miR-875-5p inhibitor构建抑制细胞。
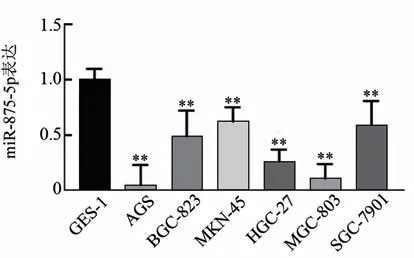
图1 miR-875-5p在胃癌细胞和胃黏膜上皮细胞GES-1中的表达
2.2 成功构建miR-875-5p 过表达或抑制的AGS 细胞或MKN-45细胞
转染miR-875-5p mimic 或inhibitor 后,qPCR 法检测结果(图2)表明,与Control 组和miR-NC 组相比,miR-875-5p mimic 组AGS 细胞中miR-875-5p 的表达水平显著升高(均P<0.01);与Control组和AntimiR-NC 组相比,miR-875-5p inhibitor 组MKN-45 细胞中miR-875-5p 的表达水平显著降低(均P<0.01)。结果表明,成功构建miR-875-5p 过表达或抑制的胃癌细胞,可以进行后续实验。
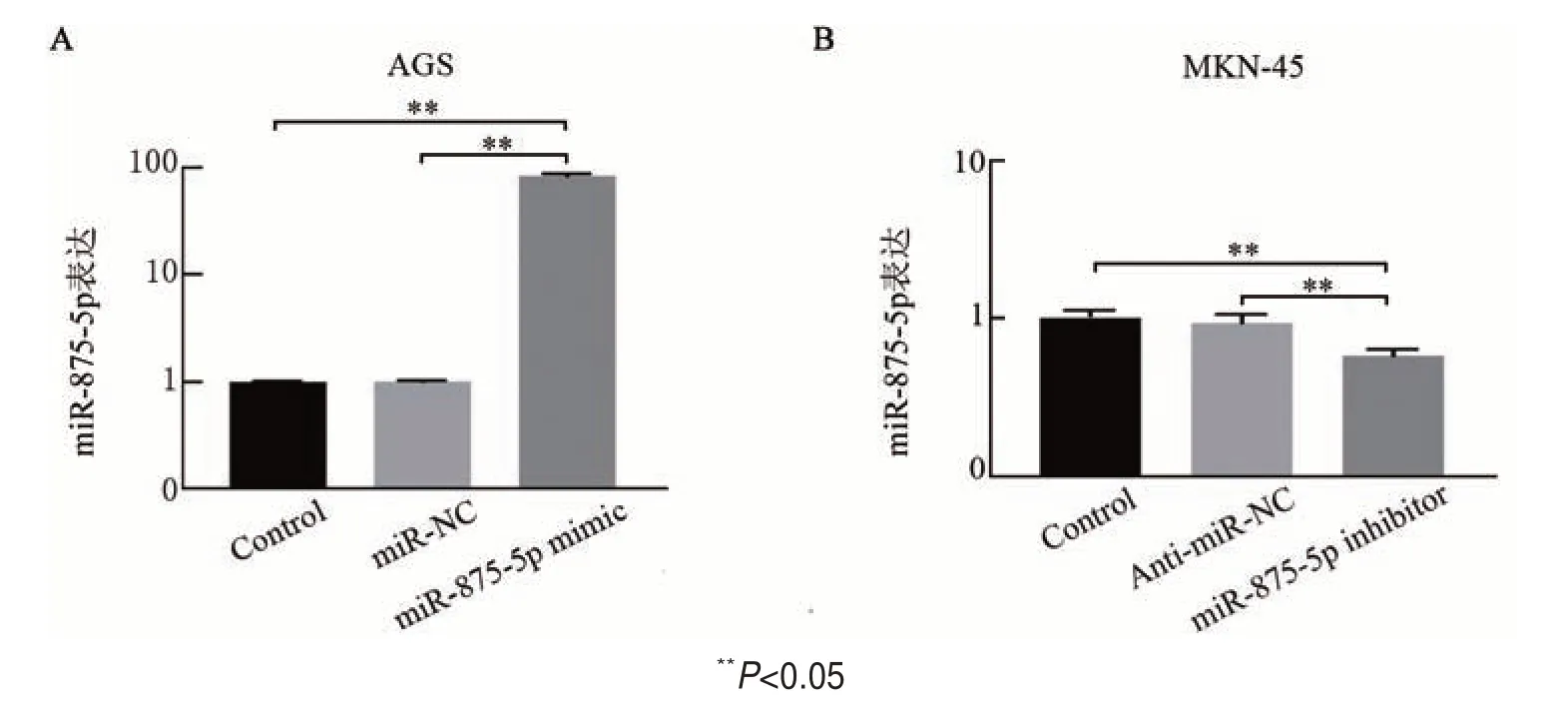
图2 转染miR-875-5p mimic(A)或inhibitor(B)后胃癌细胞中miR-875-5p表达水平
2.3 miR-875-5p靶向USF2基因并抑制其表达
TargetScan、miRmap 和Starbase 数据库分析结果(图3A)显示,USF2 是miR-875-5p 的靶基因,其序列中包含一个保守的miR-875-5p mRNA 同源位点。双荧光素酶报告基因实验结果(图3B)显示,与miR-NC 组相比,miR-875-5p mimic 与USF2 WT共转染组细胞的荧光素酶活性明显降低(P<0.01),而miR-875-5p mimic 与USF2 MUT 共转染组细胞的荧光素酶活性无变化(P>0.05)。WB 法检测结果(图3C)显示,miR-875-5p mimic 组AGS细胞中USF2 蛋白表达显著低于Control 组和miR-NC 组(均P<0.01);miR-875-5p inhibitor组MKN-45细胞中USF2 蛋白表达显著高于Control 组和Anti-miR-NC组(均P<0.05)。结果表明,miR-875-5p 直接靶向USF2基因并抑制其表达。

图3 miR-875-5p靶向抑制USF2表达
2.4 miR-875-5p表达变化对胃癌细胞增殖的影响
CCK-8实验结果(图4A)显示,在转染第4天时miR-875-5p mimic组AGS细胞的增殖水平显著低于Control组和miR-NC 组(均P<0.01);miR-875-5p inhibitor 组MKN-45 细胞中的增殖水平显著高于Control 组和Anti-miR-NC 组(均P<0.01)。克隆形成实验结果(图4B)显示,miR-875-5p mimic 组AGS 细胞的克隆形成率显著低于Control 组和miR-NC 组(均P<0.01);miR-875-5p inhibitor 组MKN-45 细胞的克隆形成率显著高于Control 组和Anti-miR-NC 组细胞(均P<0.01)。结果表明,miR-875-5p过表达显著抑制胃癌细胞增殖和克隆形成能力。
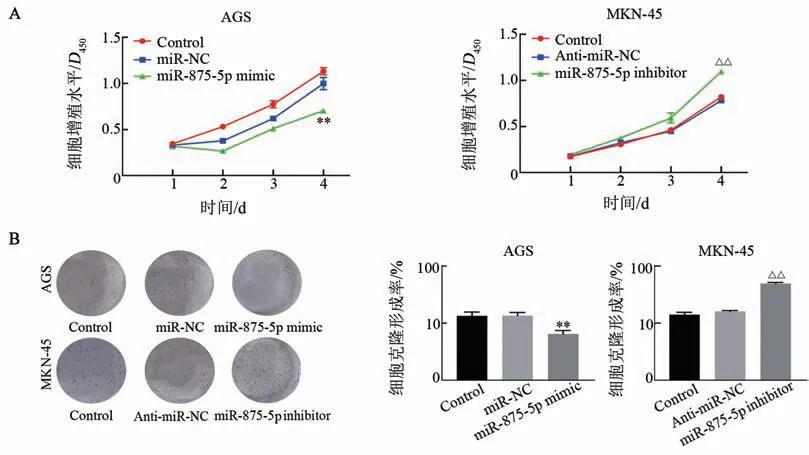
图4 miR-875-5p的过表达或抑制对AGS和MKN-45细胞增殖(A)和克隆形成(B)的影响
2.5 miR-875-5p表达变化对胃癌细胞迁移和侵袭的影响
Transwell 实验结果(图5)显示,与Control 组和miR-NC 组相比,miR-875-5p mimic组AGS细胞的迁移和侵袭细胞数均显著减少(均P<0.01);而miR-875-5p inhibitor 组MKN-45 细胞的迁移和侵袭细胞数较Control 组和Anti-miR-NC 组均显著增多(P<0.05或P<0.01)。结果表明,过表达miR-875-5p降低胃癌细胞的迁移与侵袭能力,抑制miR-875-5p 表达则提高胃癌细胞的迁移与侵袭能力。
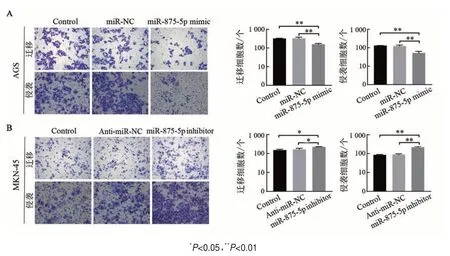
图5 miR-875-5p的过表达或抑制对AGS细胞(A)和MKN-45细胞(B)迁移和侵袭的影响(结晶紫染色,×200)
2.6 miR-875-5p过表达显著抑制裸鼠MKN-45细胞移植瘤的生长
裸鼠成瘤实验结果(图6)显示,miR-875-5p mimic 组裸鼠移植瘤的体积显著小于Control 组和miR-NC组(均P<0.01),表明miR-875-5p过表达可显著抑制裸鼠MKN-45细胞移植瘤的生长。

图6 过表达miR-875-5p抑制裸鼠成瘤
3 讨论
中国胃癌病死率位列恶性肿瘤的第二位,主要是由于胃癌确诊时往往已进展到晚期,失去了早期诊断与疾病治愈的机会。胃癌的生长和转移是一个多基因、多阶段的序贯级联过程,迄今为止,关于胃癌进展的分子机制研究报道仍然很少。因此,对涉及肿瘤形成和发展的分子机制的更好理解将有助于研发新的治疗策略和靶标来治疗胃癌。在肿瘤的发生和发展过程中,发挥作用的基因分为癌基因和抑癌基因,当这些基因失调时,很可能导致肿瘤的发生。miRNA参与机体的一系列重要的生物学活动,例如早期胚胎发育、细胞增殖、凋亡和分化等。细胞增殖和凋亡通常在肿瘤中发生异常改变,推测miRNA 的异常缺失、突变或过表达与恶性肿瘤的发生有关[12-14],miRNA可能是肿瘤诊断的重要生物标志物与治疗靶标。
大量研究结果表明,miR-875-5p参与了肿瘤的发生和发展。如WANG等[8]的研究结果显示,miR-875-5p在肺癌中高表达,同时其能调控SATB2(stabilin-2)的表达而发挥促癌作用;KANG 等[9]的研究结果表明,miR-875-5p通过靶向CAPZA1(capping protein of muscle Z-line alpha 2 subunit)促进食管鳞状细胞癌细胞的增殖和迁移;BEZAWY 等[15]的研究结果表明,miR-875-5p 通过抑制EGFR-ZEB1 轴而阻断上皮细胞向间充质细胞的转化,增强前列腺癌细胞的放疗反应。有研究结果[16]发现,miR-875-5p过表达可影响胃癌细胞中Notch3 的表达从而影响胃癌细胞的增殖。本课题首先检测了miR-875-5p在人胃癌细胞中的表达情况,发现miR-875-5p在胃癌细胞BGC-823、HGC-27、SGC-7901、MGC-803、MKN-45和AGS中的表达水平显著低于正常胃黏膜上皮细胞GES-1。在6 种胃癌细胞中,miR-875-5p 在AGS 细胞中表达最低,而在MKN-45 细胞中表达最高,因此,选择AGS和MKN-45细胞进行深入的功能研究。为探讨miR-875-5p对胃癌细胞增殖的影响,进行CCK-8和克隆形成实验,结果表明,miR-875-5p 表达的降低提高了胃癌细胞的增殖和集落形成能力,而miR-875-5p过表达则显著抑制细胞增殖和集落形成能力;通过Transwell实验检测miR-875-5p对胃癌细胞侵袭和迁移的作用,结果表明miR-875-5p 表达的降低促进细胞的侵袭和迁移,而miR-875-5p 过表达显著抑制细胞的侵袭和迁移。
USF2是基本螺旋-环-螺旋-亮氨酸拉链转录因子家族的成员之一,其编码的蛋白质可以参与调节多种细胞过程。作为一个转录因子,USF2 已经被报道有大量的靶基因,涉及细胞增殖、葡萄糖和脂质代谢[17]。有研究结果[18-19]证实USF2 在多种肿瘤中高表达,且敲低USF2 后肿瘤细胞的增殖和迁移能力明显减弱[20]。此外,USF2 也受到miRNA 的调控,从而影响肿瘤细胞的增殖、侵袭和迁移能力,例如miR-362-3p 通过靶向USF2 而抑制结肠癌细胞迁移[21]。本课题组在前期研究[22]中发现,miR-875-5p和USF2基因之间存在一定的调控关系。本研究的结果证实,miR-875-5p靶向下调USF2的表达进而抑制胃癌细胞的增殖、迁移和侵袭。既往的研究结果[23]显示,单个miRNA可以同时影响多个靶基因,在miR-875-5p 的预测靶基因中,本课题组发现USF2 充当miR-875-5p的关键效应靶基因,双荧光素酶报告基因实验和WB 实验结果表明,miR-875-5p 直接与USF2 mRNA 中3'-UTR 的靶向位点结合并负向调节USF2 表达。miR-875-5p 的增殖抑制作用可能归因于miR-875-5p 靶向USF2 mRNA 的3'-UTR,并抑制胃癌细胞中USF2 的表达。此外,裸鼠成瘤实验结果证明,过表达miR-875-5p 显著抑制MKN-45 细胞的成瘤,这进一步明确了miR-875-5p 抑制胃癌细胞增殖的作用。
综上所述,本研究通过使用miR-875-5p mimic和inhibitor转染胃癌细胞,证实了miR-875-5p 表达变化可以影响胃癌细胞增殖、迁移和侵袭,过表达miR-875-5p 通过靶向下调USF2 发挥抑制胃癌生长的作用。本研究结果表明,miR-875-5p 可能是胃癌潜在的诊断生物标志物和治疗靶点。

