miR-502-3p通过靶向GTPBP2基因调控结直肠癌干细胞增殖与凋亡
柯超,周红见,蒋斌,谢兴旺,张超(武汉市第三医院 胃肠腹壁与疝外科,湖北 武汉 430061)
结直肠癌是常见的消化道恶性肿瘤之一。关于结直肠癌的治疗方法以外科手术、放疗等为主,虽然提高了患者5 年生存率,但是其远处转移、复发等仍影响患者的治疗效果[1-2]。肿瘤干细胞具有自我更新、多向分化、耐药、高度致瘤等特性,被认为是肿瘤发生、转移和复发的种子细胞[3]。目前,众多学者致力于研究肿瘤干细胞和miRNA 调控作用,包括如何有效地抑制肿瘤干细胞的发展,以达到治疗肿瘤的目的[4-5]。研究结果[6]显示,miRNA(如miR-19、miR-501-5p和miR-744)与肿瘤干细胞发展有关。miR-502-3p在胃癌、肺癌等肿瘤中表达失调,与肿瘤细胞增殖、凋亡等有关[7-8],但是对结直肠癌干细胞(colorectal cancer stem cell,CCSC)的研究报道尚不清楚。GTP结合蛋白2(GTP-binding protein 2,GTPBP2)是蛋白质合成GTP酶超家族成员,广泛存在于人体的胰腺、胃、小肠等,且表达水平较高[9],关于GTPBP2 对CCSC的作用机制尚不明确。鉴于此,本课题用免疫磁珠实验从结直肠癌HCT116 细胞中分选出CCSC,探讨miR-502-3p 是否通过调控GTPBP2 基因影响CCSC 增殖、周期和凋亡的分子机制,旨在为结直肠癌诊断和治疗提供参考依据。
1 材料与方法
1.1 细胞和主要试剂
结直肠癌细胞HCT116购于中科院上海细胞库。胎牛血清、RPMI 1640培养基购于上海联硕生物科技有限公司,表皮生长因子(bFGF)、碱性成纤维细胞生长因子(bFGF)购于美国Pepro Tech公司,小鼠抗人CD133和CD44 抗体购于德国Miltenyi 公司,Lipofectamine 2000 试剂盒购于上海研卉生物科技有限公司,miR-NC、miR-502-3p、si-miR-NC、si-miR-502-3p、空载体vector、GTPBP2 过表达载体和引物由上海生工公司设计合成,TRIzol试剂盒、逆转录试剂盒、荧光定量PCR(qPCR)试剂盒购于日本TaKaRa 公司,MTT试剂盒、BCA试剂盒、电化学发光液购于北京索莱宝公司,细胞凋亡检测试剂盒和细胞周期检测试剂盒购于江苏凯基生物公司,Ki67抗体、CDK1抗体、Bcl2抗体、BAX 抗体、GTPBP2 抗体、GAPDH 抗体购于美国Abcam 公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgG、荧光素酶报告基因检测试剂盒购于艾美捷科技有限公司。
1.2 细胞培养和分选
结直肠癌HCT116 细胞在37 ℃、5%CO2培养箱中培养。当细胞生长汇合度达85%时,加入胰酶进行消化并制备细胞悬液。将结直肠癌细胞接种于含有2%B27、20 µg/L EGF、20 µg/L bFGF、不含血清的完全培养基中进行培养,观察细胞成球情况,用第3代细胞与小鼠抗人CD133 和CD44 抗体包被的磁珠进行培养,采用流式细胞术分选出双阳性细胞(CD133+CD44+)和双阴性细胞(CD133-CD44-)。并检测CD133+CD44+细胞的表达率。
1.3 细胞转染及分组
将CD133+CD44+细胞接种至6 孔板中(2×105个/孔),参照Lipofectamine 2000试剂盒说明书的方法将miR-NC、miR-502-3p、si-miR-NC、si-miR-502-3p、miR-502-3p+vector 和miR-502-3p+GTPBP2 转 染 至CD133+CD44+细胞中,分别记为miR-NC组、miR-502-3p组、si-miR-NC 组、si-miR-502-3p 组、miR-502-3p+vector组和miR-502-3p+GTPBP2组。转染6 h后更换细胞培养液,培养48 h后进行后续实验。
1.4 qPCR法检测CCSC 中miR-502-3p 和GTPBP2 mRNA的表达
取CD133-CD44-细胞和CD133+CD44+细胞,以及转染成功的各组细胞按照TRIzol法提取细胞中总RNA,检测浓度和纯度后,逆转录合成cDNA,将cDNA 根据qPCR 试剂盒说明书步骤进行PCR 扩增反应。引物序列:miR-502-3p 上游为5′-ACACTC CAGCTGGGAATGCACCTGGGCAAGG-3′,下游为5′-CTCAACTGGTGTCGTGGA-3′;U6上游为5′-CTCGCTTCGGCAGCACA-3′,下游为5′-AACGCT TCACGAATTTGCGT-3′ ;GTPBP2上游为5′-CTG GCTGAGGAGGAAATG-3′,下游为5′-CACACG GAGGTCTAGGAAC-3′;GAPDH上游为5′-GAA GGTGAAGGTCGGAGT-3′,下游为5′-GAAGAT GGTGATGGGATTTC-3′。PCR反应条件:预变性95℃30 s;95 ℃5 s,60 ℃30 s,共循环35次。以U6、GAPDH作为内参基因,采用2-ΔΔCt法计算miR-502-3p和GTPBP2 mRNA的相对表达量。
1.5 MTT法检测CCSC的增殖率
将各组CD133+CD44+细胞接种至96孔板中(5×103个/孔),继续培养48 h,每孔加入10 μL MTT试剂,继续培养4 h,清除培养液,每孔加入150 μL DMSO试剂。酶标仪检测波长490 nm处每孔光密度(D)值,计算细胞增殖率(实验组D值/对照组D值×100%)。
1.6 流式细胞术检测CCSC细胞周期和凋亡水平
细胞周期实验:将miR-NC 组、miR-502-3p 组、miR-502-3p+vector 组、miR-502-3p+GTPBP2 组CD133+CD44+细胞接种至6孔板中(5×105个/孔),PBS清洗后,1 200×g离心5 min后收集上清液,加入乙醇溶液,固定过夜。弃去乙醇溶液,加入PI和RNA酶,避光反应15~30 min,上流式细胞仪检测细胞周期变化。
细胞凋亡实验:取各组CD133+CD44+细胞(同细胞周期实验),离心后弃去上清液,采用预冷PBS 进行清洗,加入PBS重悬细胞,然后与各5 μL的Annexin Ⅴ-FITC和PI染液混匀,避光反应15~30 min,置于流式细胞仪检测细胞凋亡水平。
1.7 WB 法检测CCSC 中Ki67、CDK1、Bcl2、BAX 和GTPBP2蛋白的表达
取各组CD133+CD44+细胞用蛋白裂解液提取细胞中总蛋白,BCA 法检测蛋白浓度,水浴煮沸反应5 min,以每孔35 μg蛋白上样,行SDS-PAGE,用半干法转移分离的蛋白质至PVDF 膜上,在含5%脱脂奶粉溶液中封闭2 h,在均以1∶1 000 稀释的Ki67、CDK1、Bcl2、BAX、GTPBP2和GAPDH一抗中4 ℃过夜。次日在1∶2 500稀释的HRP标记的山羊抗兔IgG二抗室温下处理2 h,加入电化学发光液显色,曝光。以GAPDH 作为内参,应用凝胶成像软件扫描,分析蛋白条带的灰度值。
1.8 双荧光素酶报告基因实验验证miR-502-3p 与GTPBP2的靶向关系
通过TargetScan 软件预测miR-502-3p 和GTPBP2 之间是否存在互补核苷酸序列。将含有miR-502-3p 结合位点的GTPBP2 3′UTR 序列克隆至荧光素酶报告基因质粒中,构建GTPBP2 野生型(GTPBP2 3′UTR WT)和GTPBP2 突变型(GTPBP2 3′UTR MUT)载体。按照Lipofectamine 2000试剂盒说明书步骤与miR-NC 或miR-502-3p 共转染至CD133+CD44+细胞中,6 h后更换细胞培养液,继续培养48 h,按照荧光素酶试剂盒说明书步骤检测转染细胞的荧光素酶活性。
1.9 统计学处理
以上主要实验均重复3次。采用SPSS 22.0统计学软件分析实验数据,符合正态分布的计量数据以表示,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析,以P<0.05 或P<0.01 表示差异有统计学意义。
2 结果
2.1 miR-502-3p在CCSC中低表达
利用免疫磁珠分选技术,成功从结直肠癌HCT116细胞中获得CD133-CD44-和CD133+CD44+细胞,CD133+CD44+细胞阳性率为94.35%。qPCR 法检测结果显示,CD133+CD44+细胞中miR-502-3p表达水平显著低于CD133-CD44-细胞(0.36±0.05vs0.99±0.09,t=18.357,P<0.01),因此,后续实验选择CD133+CD44+细胞。
2.2 转染miR-502-3p对CCSC增殖、周期、凋亡及相关蛋白表达的影响
转染miR-502-3p 后,qPCR 法检测结果显示,miR-502-3p 组CD133+CD44+细胞中miR-502-3p 表达水平显著高于miR-NC 组细胞(2.87±0.30vs1.00±0.07,t=18.211,P<0.01),表明成功建立miR-502-3p过表达细胞,可以进行后续实验。
MTT 法、流式细胞术和WB 法检测结果(表1、图1)显示,与miR-NC 组比较,miR-502-3p 组细胞增殖率、S 期细胞比例均显著降低(均P<0.01),Ki67、CDK1 蛋白表达显著降低(均P<0.01);细胞凋亡率、G0/G1期细胞比例均显著升高(均P<0.01),Bcl2蛋白表达显著降低(P<0.01),BAX 蛋白表达显著升高(P<0.01)。结果表明,上调miR-502-3p 可显著抑制CCSC增殖、周期进展并诱导细胞凋亡。

表1 上调miR-502-3p对CCSC增殖、周期和凋亡的影响
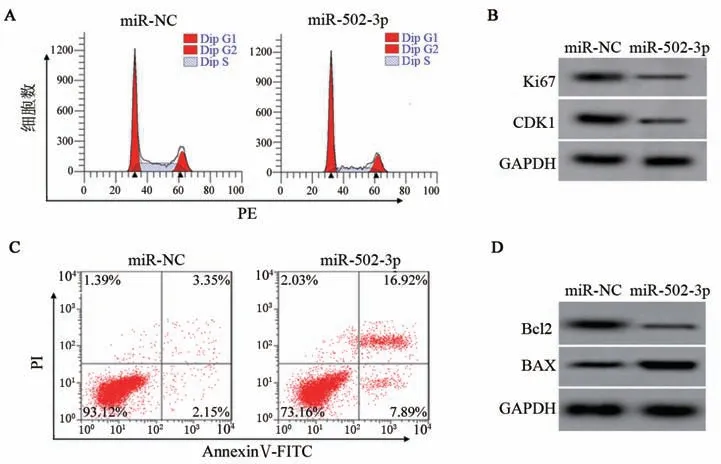
图1 上调miR-502-3p对CCSC细胞周期及Ki67、CDK1、Bcl2和BAX蛋白表达的影响
2.3 miR-502-3p靶向负调控GTPBP2表达
TargetScan软件预测结果显示,miR-502-3p 和GTPBP2 mRNA之间存在互补结合位点(图2A)。双荧光素酶实验报告基因实验结果显示,与miR-NC组相比,miR-502-3p 与GTPBP2 3′UTR WT 载体共转染细胞的荧光素酶活性显著降低(0.41±0.06vs0.99±0.07,t=18.873,P<0.01),而与GTPBP2 3′UTR MUT载体共转染细胞的荧光素酶活性无显著改变(1.01±0.05vs0.98±0.06,t=1.152,P>0.05)。qPCR 和WB 实验检测结果(图2B、C)显示,与miR-NC 组比较,miR-502-3p 组细胞中GTPBP2 mRNA 和蛋白表达水平均显著降低(t=25.378、17.819,均P<0.01);与si-miR-NC 组比较,si-miR-502-3p 组细胞中GTPBP2 mRNA 和蛋白表达水平均显著升高(t=29.601、12.348,均P<0.01)。结果表明,miR-502-3p靶向负调控GTPBP2表达。

图2 miR-502-3p靶向负调控GTPBP2的表达
2.4 过表达GTPBP2可逆转上调miR-502-3p对CCSC增殖、周期和凋亡的作用
转染GTPBP2 后,qPCR、MTT、WB 和流式细胞术实验结果(图3、表2)显示,与miR-502-3p+vector组比较,miR-502-3p+GTPBP2组细胞中GTPBP2 mRNA和蛋白的表达水平均显著升高(均P<0.01),细胞增殖率、S 期细胞比例均显著升高(均P<0.01),细胞凋亡率、G0/G1期细胞比例均显著降低(均P<0.01),细胞中Ki67、CDK1、Bcl2蛋白表达均显著升高(均P<0.01)、BAX 蛋白表达显著降低(P<0.01)。实验结果表明,过表达GTPBP2 可逆转上调miR-502-3p 对CCSC 增殖、细胞周期和凋亡的作用。

表2 过表达GTPBP2可逆转上调miR-502-3p对CCSC增殖、周期和凋亡的影响

图3 过表达GTPBP2可逆转上调miR-502-3p对CCSC的作用
3 讨论
肿瘤干细胞是一群独特的细胞亚群,因其具有高度致瘤性而参与肿瘤的发展,对肿瘤细胞分化、增殖、转移等有重要的作用[10-12]。有研究结果[13]显示,miRNA 与CCSC 发展有关,如miR-451a 在结直肠癌细胞中表达水平较低,过表达miR-451a降低了CCSC中Ki-67、cyclin D1的表达,抑制CCSC增殖。VILLANOVA 等[14]通过对CCSC 的功能研究发现,miR-1285 通过靶向调控细胞凋亡相关蛋白酶2 表达抑制细胞增殖和阻滞周期,诱导细胞凋亡。阎立昆等[15]研究发现,miR-1231 在CCSC 中表达水平降低,过表达miR-1231抑制结直肠癌细胞增殖、迁移,并促进细胞凋亡。关于miR-502-3p的研究主要集中在胃癌,如miR-502-3p 在胃癌细胞中低表达,过表达miR-502-3p 能抑制胃癌细胞增殖、迁移和侵袭并诱导细胞凋亡[16],但是对CCSC的作用尚不清楚。本研究利用免疫磁珠分选技术,从结直肠癌HCT116细胞中分选出双阴性细胞(CD133-CD44-)和双阳性细胞(CD133+CD44+),qPCR法检测结果发现,miR-502-3p在CD133+CD44+细胞中表达水平显著低于CD133-CD44-细胞,说明miR-502-3p 与CCSC发展有关。将miR-502-3p 过表达质粒转染CD133+CD44+细胞后,结果发现细胞增殖率、S期细胞比例显著降低,细胞凋亡率、G0/G1 期细胞比例显著升高,细胞中Ki67、CDK1、Bcl2 蛋白表达下调、BAX 蛋白表达上调,说明上调miR-502-3p 抑制CCSC 增殖、阻滞细胞周期并诱导细胞凋亡,这与上述研究结果相似。
GTPBP2 是GTPase 家族四个家族成员之一,其存在于所有真核细胞中,位于人类染色体6p21-12区域,与蛋白合成、细胞信号转导、骨架调节等密切相关,在人体卵巢、脑、胰腺、骨骼肌等组织中均有表达[10,17-18]。关于GTPBP2与肿瘤的研究相对较少,主要在人类遗传学中研究较多[19]。最近的研究结果[20]显示,GTPBP2 在非小细胞肺癌组织和细胞中表达上调,其高表达与患者TNM分期和淋巴结转移相关;敲低GTPBP2抑制非小细胞癌肺癌细胞的增殖、迁移和侵袭。但是GTPBP2 在结直肠癌中的作用尚不清楚。本研究通过在线数据库预测发现,GTPBP2是miR-502-3p 靶基因,通过双荧光素报告基因实验和qPCR实验验证二者的关系,结果发现miR-502-3p调控GTPBP2 的表达。上调miR-502-3p 降低CCSC中GTPBP2 mRNA和蛋白表达水平,下调miR-502-3p则上调GTPBP2 mRNA 和蛋白表达水平,结果表明miR-502-3p 靶向负调控GTPBP2 的表达。进一步实验的结果显示,过表达GTPBP2 可以部分逆转上调miR-502-3p对CCSC增殖、细胞周期和凋亡的作用。
综上所述,miR-502-3p 在CCSC 中表达下调,miR-502-3p 靶向负调控GTPBP2 的表达,从而抑制CCSC 的增殖和阻滞细胞周期并促进细胞凋亡。关于GTPBP2对CCSC作用的具体机制有待深入研究。

