苯磺酸氨氯地平片有关物质的分析方法研究和改进
张大勇

摘要:根据国家药品一致性评价指导原则和英国药典2020版苯磺酸氨氯地地平片有关物质检查要求,本文通过采用原研工艺制备的多批次样品进行分析研究,最终结果确定了一个新的适用于苯磺酸氨氯地平片一致性评价有关物质检查的分析方法。
Abstract: According to the national drug consistency evaluation guidelines and British pharmacopoeia 2020 edition of benzene sulfonic acid ammonium chloride to horizontal slice material inspection requirements, more than the original preparation process through the use of batch sample analysis, the final result to determine the a new suitable for benzene sulfonic acid amlodipine consistency evaluation related substances examination analysis method.
关键词:苯磺酸氨氯地平;一致性评价;高效液相色谱;有关物质
Key words: Amlodipine besylate;Aonsistency evaluation;HPMC;Impurity
【中图分类号】TL271+.99 【文献标识码】A 【文章编号】1673-9026(2022)04--02
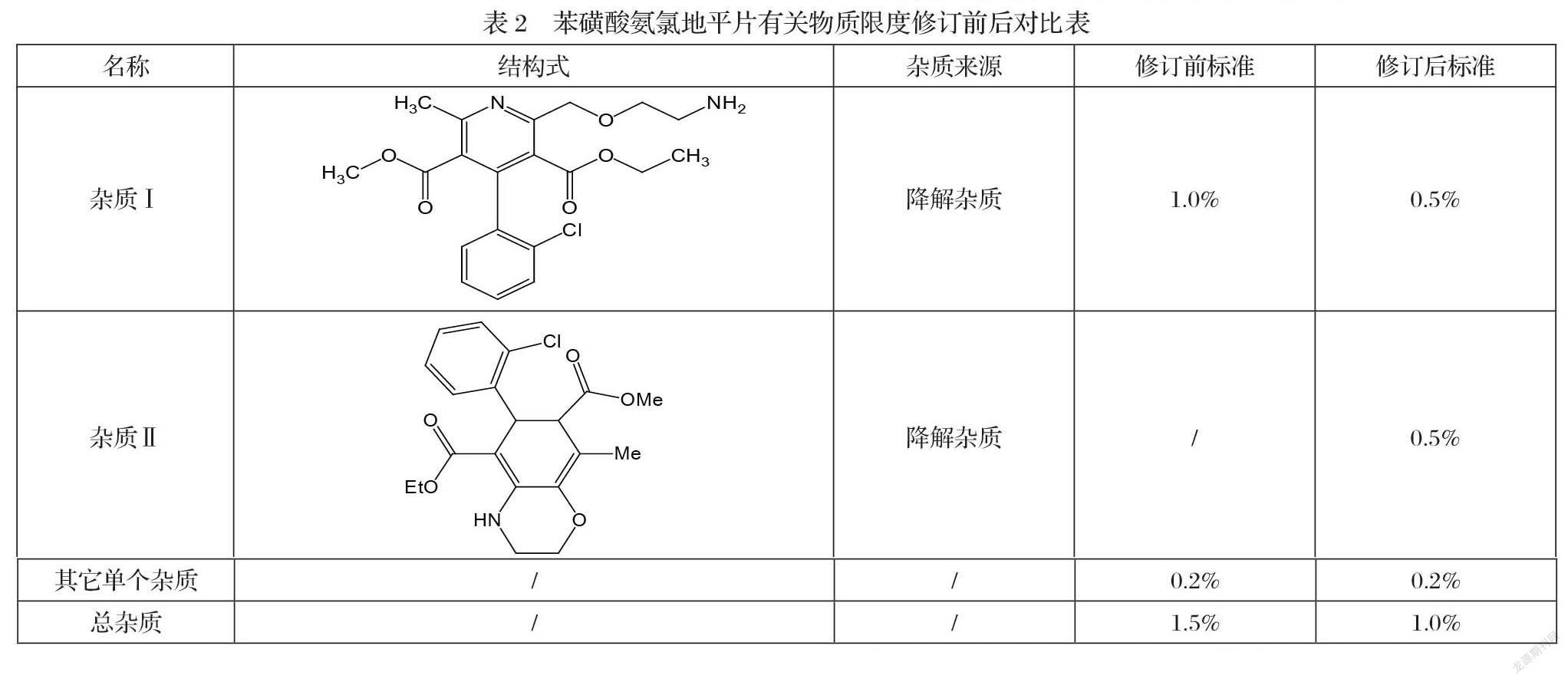
5-乙基-7-甲基-6-(2-氯苯基)-8-甲基-3,4,6,7-四氢-2H-苯并[b][1,4]恶嗪-5,7-二羧酸酯(以下简称“杂质II”)是苯磺酸氨氯地平在生产过程中的一个降解杂质。由于该结构存在氮氧杂环、羰基、卤代基等较多不稳定基团,极易发生变化产生潜在基因毒杂质,所以有必要对其进行分析研究。目前杂质II已经被英国药典2020版收载,但国内研究较少,2020年最新版的中国药典只收载了2-[(2-氨基乙氧基)甲基]-4-(2-氯苯基)-6-甲基-3,5-吡啶二甲酸3-乙酯(以下简称“杂质I”)及相关检验方法[1],且杂质I的检验方法并不适用于杂质II的分析,于是针对该问题我们根据原研工艺制备了三批样品并针对两个不同杂质开发了一种检验方法。
1.处方及工艺
首先我们制备了三批样品,每批的处方及工艺均参照原研药品信息进行了相同处理。方法为称取693g苯磺酸氨氯地平(Cadila、印度)、130g微晶纤维素(安徽山河)、60g磷酸氢钙(Sudeep、美国)、4g羧甲淀粉钠(湖州展望)、2g硬脂酸镁(曲阜天利),为了最大限度减少工艺因素导致质量可能发生变化,我们采用干法混合压片的工艺,以等量递加的混合方式将上述原辅料混合均匀,再用直径为8mm浅圆型冲模压片,用铝塑包装后分别得到三批待检样品。
2.检验分析
我们结合英国药典2020版的检查和限度范围开发了一种检验方法,并对中国药典2020版中苯磺酸氨氯地平片检查项中有关物质的检验方法和质量标准进行了修订。
2.1分析方法
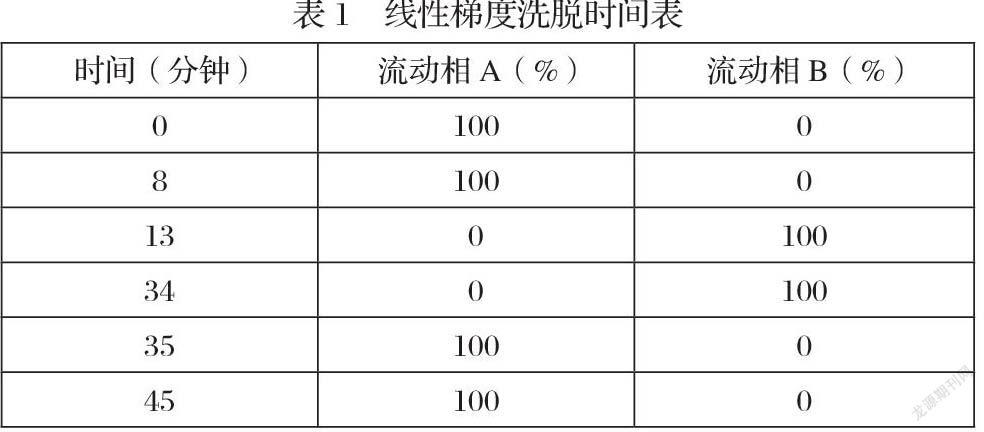
取本品细粉适量(约相当于氨氯地平10mg),置20ml量瓶中,加溶剂(流动相A)超声溶解并稀释至刻度,摇匀,离心,取上清液作为供试品溶液;精密量取供试品溶液1ml,置50ml量瓶中,加溶剂稀释至刻度,摇匀,精密量取1ml,置10ml量瓶中,用溶剂稀释至刻度,摇匀,作为对照溶液。照高效液相色谱法(中国药典2020年版第四部通则0512)试验[2]。以十八烷基硅烷键合硅胶为填充剂[Kinetex C18(4.6×100mm,2.6μm)或效能相当的色谱柱],柱温为30℃,流动相A为0.03mol/L磷酸二氢钾溶液(用磷酸溶液调节pH值至3.0±0.1)-甲醇(45∶55),流动相B为0.03mol/L磷酸二氢钾溶液(用磷酸溶液调节pH值至3.0±0.1)-甲醇(30∶70),按“表1”进行线性梯度洗脱,流速为每分钟0.6ml,检测波长为238nm。
称取苯磺酸氨氯地平、杂质Ⅰ和杂质Ⅱ对照品各适量,加溶剂溶解并稀释制成每1ml中含氨氯地平约0.5mg,各杂质2μg的混合溶液,作为系统适用性溶液。精密量取系统适用性溶液10μl,注入液相色谱仪,记录色谱图,杂质Ⅰ、氨氯地平、杂质Ⅱ依次流出,分离度应符合要求;精密对照溶液10μl,注入液相色谱仪,主成分峰高的信噪比应不低于20。精密量取供试品溶液及对照溶液各10μl,注入液相色谱仪,记录色谱图。扣除溶剂峰、苯磺酸峰(相对保留时间约0.25),供试品溶液色谱图中如有杂质峰,杂质Ⅰ和杂质Ⅱ峰的峰面积分别乘以校正因子2.9后均不得大于对照溶液主峰面积的2.5倍(0.5%),其他单个杂质峰面积不得大于对照溶液的主峰面积(0.2%),各杂质含量之和不得过1.0%。供试品溶液色谱图中小于对照溶液主峰面积0.5倍的色谱峰忽略不计。苯磺酸氨氯地平片有关物质质量标准限度范围修訂前后对比见“表2”。
2.2检验结果
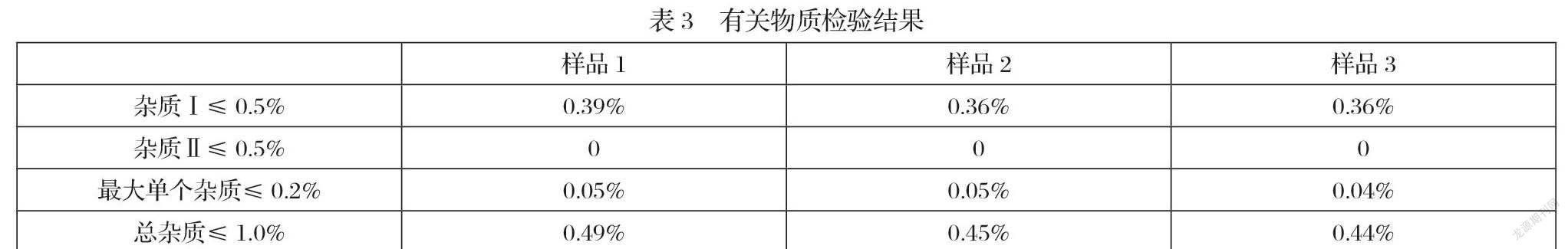
采用修订后的检验方法对上述的三批样品分别进行了有关物质的检验,根据“表3”的检验结果表明,各项检测结果良好,均符合标准限定范围,初步判断该品种原料药生产企业对杂质II做了严格的控制,现有的处方及工艺也很好的保护了药物的质量稳定性,整个药品制备过程中没有产生降解杂质。
3.方法验证
为了确认该方法的可靠性,对此我们进行了相同色谱条件下的专属性验证。
3.1色谱条件确认
仪器:高效液相色谱仪Agilent(DAD检测器)/Waters2695(DAD检测器)
色谱柱:Phenomenex,Kinetex C18(100mm×4.6mm,2.6μm)
流动相A:甲醇-0.03M磷酸二氢钾溶液(pH3.0±0.1)(55∶45)
流动相B:甲醇-0.03M磷酸二氢钾溶液(pH3.0±0.1)(70∶30)
检测波长:238nm
流速:0.6ml/min
进样量:10μl
柱温:室温
按表1进行线性梯度洗脱。
3.2实验部分
首先精密称定了杂质I和杂质II以及其它苯磺酸氨氯地平片中可能潜在的其它相关杂质,依法用溶剂溶解稀释配制成不同浓度的定位检测溶液,然后又精密称取苯磺酸氨氯地平对照品、杂质Ⅰ及杂质Ⅱ适量依法配制成混合溶液,最后用流动相A作为空白溶液,并制备了空白辅料溶液,照上述方法中描述的色谱条件,精密量取上述溶液各10μl,依次用同样的方法进样,在上述色谱条件下所得的分析图谱见“图1”。
3.3实验结果
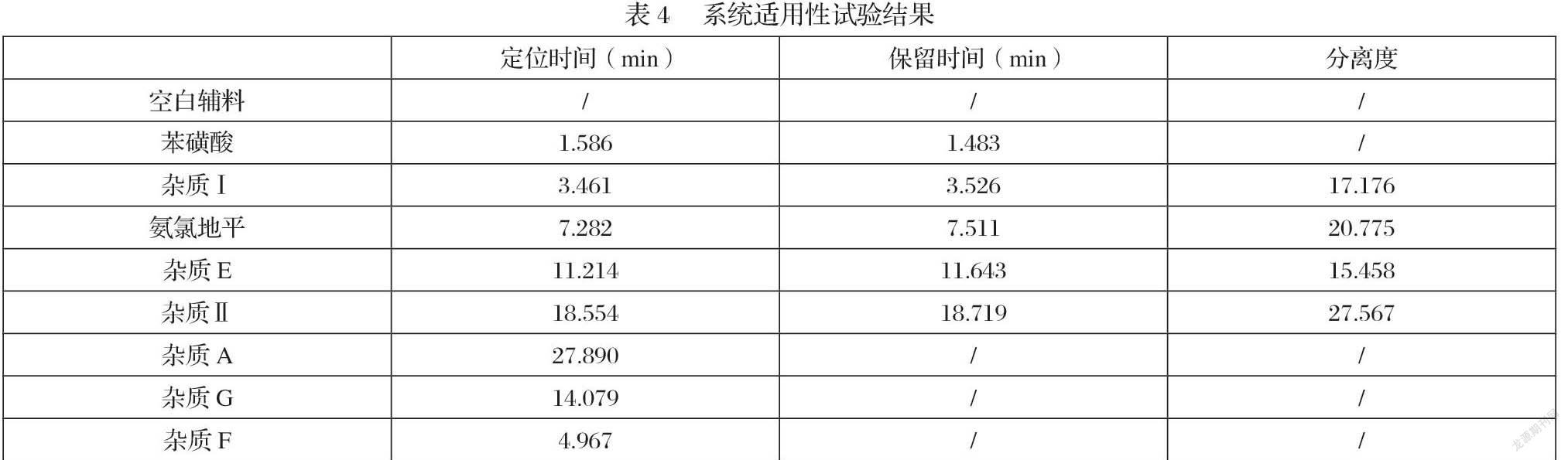
根据“表4”统计的实验数据证明,在该色谱条件下,杂质Ⅰ保留时间为3.526分钟,杂质Ⅱ保留时间为18.719分钟,峰型较好,理论塔板数大于3000,其他工艺杂质(杂质A、E、F、G)和溶剂均不干扰降解杂质Ⅰ及杂质Ⅱ检出,即本方法专属性良好。
4.结论
通过以上实验可以证明以原研处方和工艺为基础,本方法可以准确、有效的对药物中的有关物质进行定性区分和定量分析,并且具有一定的专属性,与中国药典目前收载的检验方法和判定标准相比,有关物质检查项更为全面,限度范围更为严格,在目前一致性评价的政策背景下,该方法会得到更为广泛的应用,也有助于进一步提高上市药品的质量水平。
参考文献:
[1]国家药典委员会.中华人民共和国药典2020年版.二部.中国医药科技出版社.2020:766-769
[2]国家药典委员会.中华人民共和国药典2020年版.四部.中国医药科技出版社.2020:61-65

