血清4型禽腺病毒Fiber蛋白在杆状病毒中的表达及其在抗体检测中的应用
隆玉兰, 谢松桦 , 谢 泉, 张 伟, 王伟康, 张建军, 万志敏, 李拓凡, 邵红霞, 秦爱建, 叶建强*
(1.扬州大学兽医学院 禽类预防医学教育部重点实验室 江苏省动物预防医学重点实验室,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3.扬州大学 农业科技发展研究院,江苏 扬州 225009;4.教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;5.国药集团扬州威克生物工程有限公司,江苏 扬州 225127)
禽腺病毒(Fowl Adenovirus, FAdV)在病毒分类中为腺病毒科禽腺病毒属,为无囊膜的双链DNA病毒。根据限制性内切酶消化活性可分为5个基因型(A~E),根据血清交叉中和反应性可进一步分为12个血清型(1~7、8a、8b、9~11)[1-2]。FAdV-Ⅰ呈世界性分布,在临床上引发的病症主要包括包涵体肝炎(Inclusion body hepatitis,IBH)、肝炎-心包积液综合征(Hepatitis-hydropericardium syndrome,HPS)以及肌胃糜烂(Gizzard erosion,GE)等。其中,引起肝炎-心包积液综合征的主要病原体是由属于基因C型的血清4型禽腺病毒(FAdV-4)。肝炎-心包积液综合征最先于1987年在巴基斯坦报道,随后蔓延到日本、韩国等亚洲国家[3-6]。FAdV-4引起的肝炎-心包积液综合征在2013年前病例报道较少,自2015年6月起在我国山东、安徽、河南等家禽密集养殖地区大范围爆发,鸡群死亡率可达20%~80%,给国内养鸡业造成了严重的经济损失[7-10]。目前国内缺乏商品化的针对FAdV-4抗体检测的特异性诊断技术。Fiber蛋白位于病毒粒子的表面,不仅含禽腺病毒重要抗原表位决定簇,且在结合宿主细胞天然受体、刺激机体产生保护性抗体方面具有重要作用[11]。因此,本研究拟以FAdV-4的两个纤突蛋白Fiber-1及Fiber-2为靶点,利用杆状病毒表达平台和蛋白纯化技术大量表达纯化Fiber-1及Fiber-2蛋白的基础上,创制高效特异的检测FAdV-4抗体的间接ELISA技术。
1 材料与方法
1.1 材料
1.1.1 质粒、细胞及抗体 质粒pcDNA3.1-Fiber-1及pcDNA3.1-Fiber-2,感受态细胞EscherichacoliDH5α及E.coliDH10Bac,Sf9昆虫细胞,LMH细胞及pFastBacHT A载体均由扬州大学江苏省动物预防医学重点实验室保存;抗Ⅰ群FAdV标准鸡阳性血清由中国兽医药品监察所李俊平研究员惠赠;抗NDV、EDS、H9N2、ALV-J、CAV、IBV鸡阳性血清及SPF鸡血清、抗Fiber-1及Fiber-2蛋白的单克隆抗体均由扬州大学江苏省动物预防医学重点实验室制备保存[12-13]。
1.1.2 主要试剂与仪器设备 羊抗鼠FITC购自KPL公司;HRP标记的羊抗鼠IgG和兔抗鸡IgG购自Jackson ImmunoResearch;Phanta Super-Fidelity DNA聚合酶、Gene 1 kb Super Marker、2×TaqMaster Mix以及Exnase TMII连接酶购自南京诺唯赞公司;LipofectamineTM3000 转染试剂、Sf-900 II培养基购自Gibco公司;His标签蛋白纯化试剂盒(His-tag Protein Purification Kit)购自碧云天公司;FAdV抗体检测试剂盒购自荷兰Biochek公司。IX2-SLP倒置荧光显微镜购自NIKON公司;BB-50二氧化碳细胞培养箱购自Thermo Fisher Scientific公司。
1.2 方法
1.2.1 重组穿梭载体和杆状病毒表达质粒的构建 以真核表达质粒pcDNA3.1-Fiber-1及pcDNA3.1-Fiber-2为模板,将Fiber-1及Fiber-2基因通过一步克隆法克隆至pFastBacHT A载体中,构建pFast-Fiber-1及pFast-Fiber-2重组穿梭载体并转化E.coliDH5α感受态细胞,随后涂布抗性平板筛选阳性菌落,摇菌提取质粒后经苏州金唯智生物科技有限公司测序。经测序正确的重组穿梭载体质粒转座E.coliDH10Bac感受态细胞,涂布含50 μg/mL卡那霉素、7 μg/mL 庆大霉素、10 μg/mL四环素的LA-Bac平板进行蓝白斑筛选,挑取阳性白色菌落摇菌提取质粒,测序鉴定。测序准确的含Fiber-1及Fiber-2的重组杆状病毒质粒分别命名为rBacmid-Fiber-1和rBacmid-Fiber-2。
1.2.2 重组蛋白的表达与鉴定 利用LipofectamineTM3000转染试剂将rBacmid-Fiber-1及rBacmid-Fiber-2重组杆状病毒质粒分别转染Sf9细胞,27 ℃培养4 d后分别收获培养液进行传代,连续传代3次后收获重组杆状病毒rBv-Fiber-1及rBv-Fiber-2。以适量的病毒上清接种6孔板中的Sf9细胞,27 ℃培养4 d后固定细胞,以抗Fiber-1、Fiber-2单克隆抗体为一抗,FITC标记的羊抗鼠IgG为二抗进行间接免疫荧光(IFA)鉴定。
1.2.3 重组蛋白的纯化与鉴定 以适量的rBv-Fiber-1及rBv-Fiber-2病毒上清接种T75细胞瓶中Sf9细胞,27 ℃培养4 d,5 000 r/min离心5 min后收集细胞沉淀,利用His标签蛋白纯化试剂盒进行细胞裂解和蛋白纯化。为得到纯度高、产量大的目的蛋白,分别对裂解液与细胞沉淀的比例、裂解液与Ni亲和介质的比例、蛋白结合时间、洗脱Buffer的pH及咪唑浓度等进行条件优化,并通过SDS-PAGE检测纯化效果。为了检验纯化产物的免疫原性,分别以抗FAdV-4阳性鸡血清及商品化Anti-His tag单抗为一抗,HRP标记的兔抗鸡IgG及羊抗鼠IgG为二抗进行Western blot鉴定。
1.2.4 间接ELISA方法的建立 采用方阵滴定法,优化包被蛋白浓度(8、4、2、1 μg/mL)、一抗血清稀释度(1∶800、1∶400、1∶200、1∶100)、一抗作用时间(120、90、60、30 min)、二抗HRP标记兔抗鸡IgG稀释度(1∶100 000、1∶50 000、1∶25 000、1∶12 500)、二抗作用时间(120、90、60、30 min)。包被液、封闭液、样品稀释液和酶稀释液为扬州大学江苏省动物预防医学重点实验室常规配套试剂,其余条件参照常规试剂盒反应条件。通过计算S/P值判定ELISA检测结果,公式为S/P=(样品OD450值-阴性对照OD450平均值)/(阳性对照OD450平均值-阴性对照OD450平均值)。
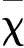
1.2.6 间接ELISA方法的特异性检测 分别取抗FAdV-1、FAdV-2、FAdV-3、FAdV-4、FAdV-5、FAdV-6、FAdV-7、FAdV-8a、FAdV-8b、FAdV-9和FAdV-11阳性鸡血清及抗NDV、EDS、H9N2、ALV-J、CAV和IBV阳性鸡血清同步进行ELISA检测,从而评价该方法对FAdV-4的特异性。
1.2.7 间接ELISA方法的灵敏度检测 取4份抗FAdV-4阳性鸡血清进行倍比稀释(1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600)后按优化好的方法进行ELISA检测。同时,以感染FAdV-4的LMH细胞为抗原的IFA法作为对照试验,同样检测上述不同稀释度的血清。对比两者的检测结果,从而评价该方法的灵敏度。
1.2.8 重复性试验 选择阳性和阴性血清各4份,每份血清4个重复,分别以同一批次不同时间、不同批次同一时间包被的酶标板检测,评价ELISA方法的批内重复性及批间重复性。
1.2.9 符合率试验 选取FAdV-4感染鸡血清,FAdV-4灭活疫苗免疫血清及SPF鸡血清各20份进行ELISA检测,以Biochek FAdV商品化试剂盒同时与上述血清反应,评价所建ELISA方法检测FAdV-4抗体结果的可靠性。
1.2.10 感染鸡群抗体水平变化检测 为探究机体感染FAdV-4后的血清Fiber抗体水平变化及其与中和抗体的关系,以建立的ELISA以及病毒中和试验分别对低剂量感染FAdV-4的鸡在不同时间段(感染后0、7、14、21、28 d,n=5)采集的血清进行检测,数据以Graphpad Prism 9.0绘制折线图。中和试验步骤参考Wang等[12]进行,当中和抗体滴度Log2≥3,视为阳性。
2 结果与分析
2.1 重组杆状病毒表达体系获得
分别将pcDNA3.1-Fiber-1及pcDNA3.1-Fiber-2质粒中携带的Fiber-1及Fiber-2基因通过一步克隆法分别克隆至pFastBacHT A载体中。重组载体经PCR鉴定表明,成功在载体相应位点分别插入大小为1 296 bp的Fiber-1基因和大小为1 440 bp的Fiber-2基因(图1)。测序结果进一步表明插入序列无突变无缺失,证明获得了正确的pFast-Fiber-1及pFast-Fiber-2重组穿梭载体质粒。重组穿梭载体质粒经转座、抗性平皿筛选、摇菌提取得到重组杆状病毒表达质粒rBacmid-Fiber-1及rBacmid-Fiber-2,经PCR(M13通用引物)鉴定出现符合预期的约4 000 bp大小条带(图2),而空载体杆粒的PCR产物大小仅为2 500 bp。测序结果进一步表明插入序列无突变和缺失。以上结果表明本研究成功构建了分别携带FAdV-4的Fiber-1及Fiber-2基因的两个重组杆粒rBacmid-Fiber-1及rBacmid-Fiber-2。
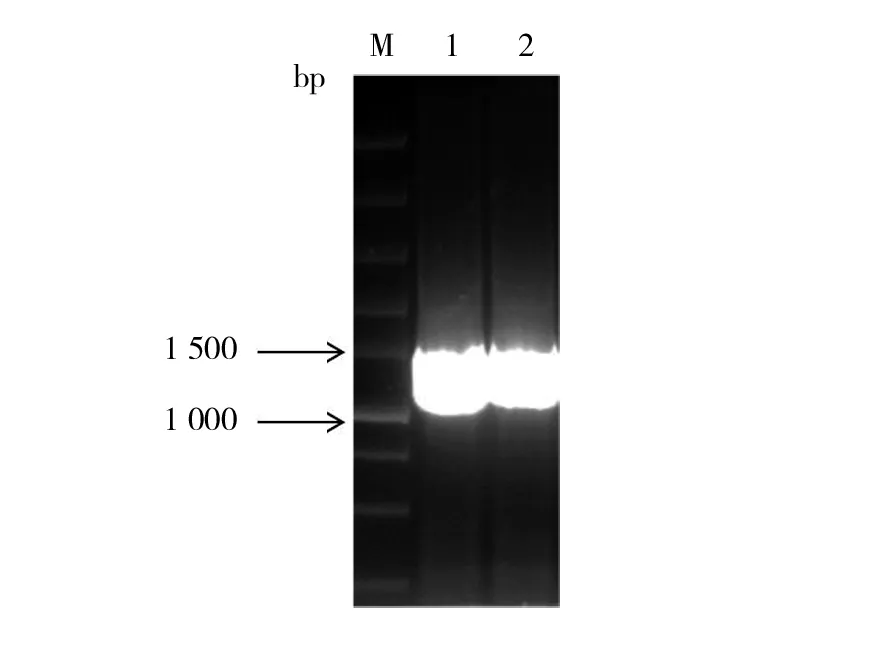
图1 PCR鉴定重组载体中Fiber基因Fig.1 PCR identification of Fiber genes in recombinant plasmidM:Super DNA Marker;1:Fiber-1;2:Fiber-2M:Super DNA Marker;1: Fiber-1;2: Fiber-2
2.2 重组蛋白在杆状病毒中表达
将构建正确的重组杆粒分别转染Sf9细胞后,获得重组杆状病毒rBv-Fiber-1及rBv-Fiber-2,分别接种Sf9细胞后经IFA检测。结果显示,rBv-Fiber-1及rBv-Fiber-2感染的Sf9细胞可与抗Fiber-1及Fiber-2单抗进行反应,经FITC标记二抗染色后荧光显微镜下可激发特异性亮绿色荧光;而野生杆状病毒感染的Sf9细胞和正常Sf9细胞对照则均不激发荧光(图3)。结果证明Fiber-1、Fiber-2蛋白在Sf9细胞中得到了正确表达。
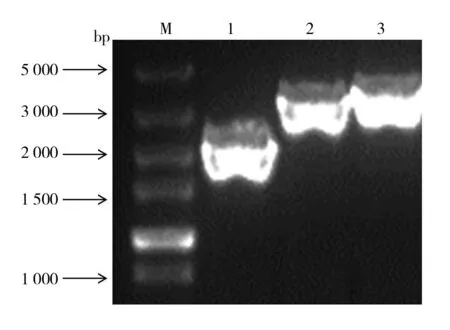
图2 重组杆粒的PCR鉴定Fig.2 PCR identification of recombinant bacmidM: Super DNA Marker;1:阴性对照;2:rBacmid-Fiber-1;3:rBacmid-Fiber-2M:Super DNA Marker; 1:Negative control;2:rBacmid-Fiber-1;3:rBacmid-Fiber-2
图3 IFA鉴定重组杆状病毒中Fiber蛋白的表达Fig.3 IFA analysis of Fiber protein expressed by recombinant baculovirus
2.3 重组Fiber蛋白的纯化与鉴定
为获得纯化的蛋白,重组杆状病毒感染Sf9细胞4 d后收获细胞,充分裂解后10 000r/min离心10 min取上清,经Ni介质亲和纯化。经过摸索,得到纯化的最佳条件:裂解液与细胞沉淀的比例为6 mL裂解液对应含10 mL培养基的T75细胞大方瓶中的细胞沉淀;裂解液与Ni亲和介质的比例为10∶1;蛋白结合时间为3 h(适用于Fiber-1蛋白)或12 h(适用于Fiber-2蛋白);洗脱Buffer的pH及咪唑浓度分别为7.4及300 mmol/L。按照优化好的条件进行蛋白纯化,并对纯化产物进行SDS-PAGE检测和Western blot鉴定。SDS-PAGE结果表明,纯化的Fiber-1和Fiber-2蛋白大小分别约为55 kDa和70 kDa(图4A、图5A),与预期分子量相符。Western blot 结果表明,目的条带可分别在55 kDa和70 kDa处被相应的抗FAdV-4阳性鸡血清及抗His单克隆抗体识别(图4B、图5B)。以上结果表明获得了纯化的Fiber-1及Fiber-2蛋白, 为构建抗体检测技术提供了良好抗原。
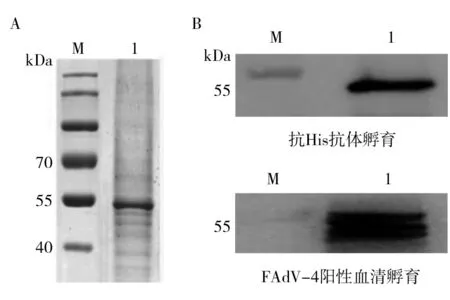
图4 纯化的Fiber-1蛋白的SDS-PAGE分析(A)和Western blot鉴定(B)Fig.4 SDS-PAGE (A) and Western blot (B) analysis of purified Fiber-1 proteinM:蛋白Marker;1:纯化后Fiber-1蛋白M: Protein Marker;1: Purified Fiber-1 protein
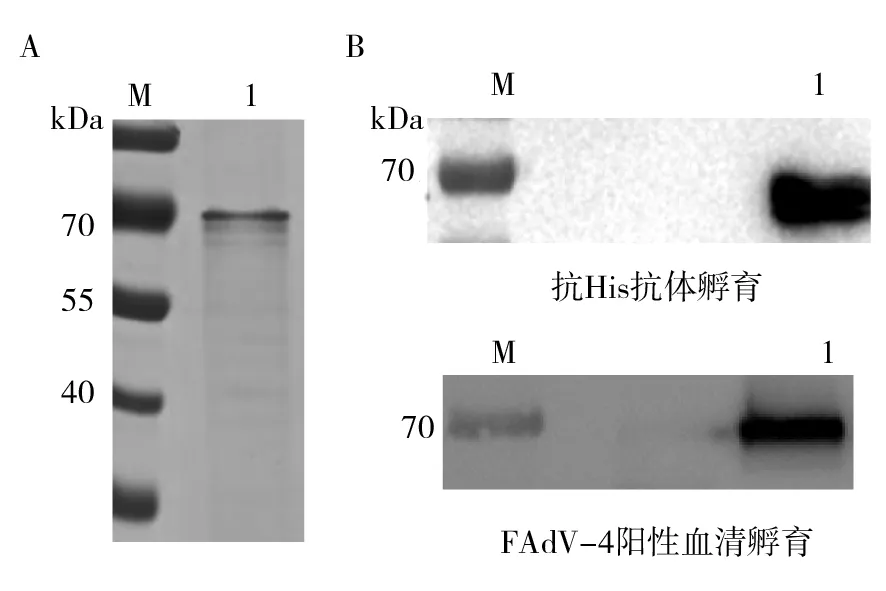
图5 纯化的Fiber-2蛋白的SDS-PAGE分析(A)和Western blot鉴定(B) Fig.5 SDS-PAGE (A) and Western blot (B) analysis of purified Fiber-2 proteinM:蛋白Marker;1:纯化后Fiber-2蛋白M: Protein Marker; 1: Purified Fiber-2 protein
2.4 间接ELISA方法的建立
将以上纯化的Fiber-1及Fiber-2蛋白分别作为包被用抗原,建立了检测Fiber-1及Fiber-2抗体的Fiber-1_ELISA以及 Fiber-2_ELISA。经方阵滴定法,依据阴阳性血清OD450比值,同时考虑实际操作时间、经济成本和可操作性确定了ELISA最终反应条件:抗原包被量均为0.2 μg/孔,一抗(血清)稀释度为1∶400, 37 ℃孵育 1 h,HRP酶标二抗稀释度为1∶50 000, 37 ℃孵育 1 h,显色10 min。根据80份阴性血清的S/P值确定Fiber-1_ELISA的Cut-off值为0.085 1,Fiber-2_ELISA的Cut-off值为0.067 2。考虑到操作误差,在确保检测结果的前提下,确定血清的S/P值大于0.1判定为阳性,小于或等于0.1判为阴性。
2.5 间接ELISA具有良好的FAdV-4特异性及敏感性
特异性检测结果发现,本研究建立的Fiber-1_ELISA以及 Fiber-2_ELISA均只能够检测出抗FAdV-4的阳性血清,而与所检测的FAdV-1、FAdV-2、FAdV-3、FAdV-5、FAdV-6、FAdV-7、FAdV-8a、FAdV-8b、FAdV-9以及FAdV-11阳性鸡血清及抗NDV、EDS、H9-AIV、ALV-J、CAV和IBV阳性鸡血清均不反应(图6、图7)。与IFA方法进行的灵敏度比较检测表明,本研究建立ELISA方法对同一份检测血清的阳性稀释度为IFA检测血清阳性稀释度的4~16倍(表1)。以上结果表明,本研究建立的Fiber-1_ELISA以及 Fiber-2_ELISA具有良好的FAdV-4特异性,且具有比IFA更高灵敏度。

图6 Fiber-1_ELISA特异性试验Fig.6 Specificity test of Fiber-1_ELISA

图7 Fiber-2_ELISA特异性试验Fig.7 Specificity test of Fiber-2_ELISA
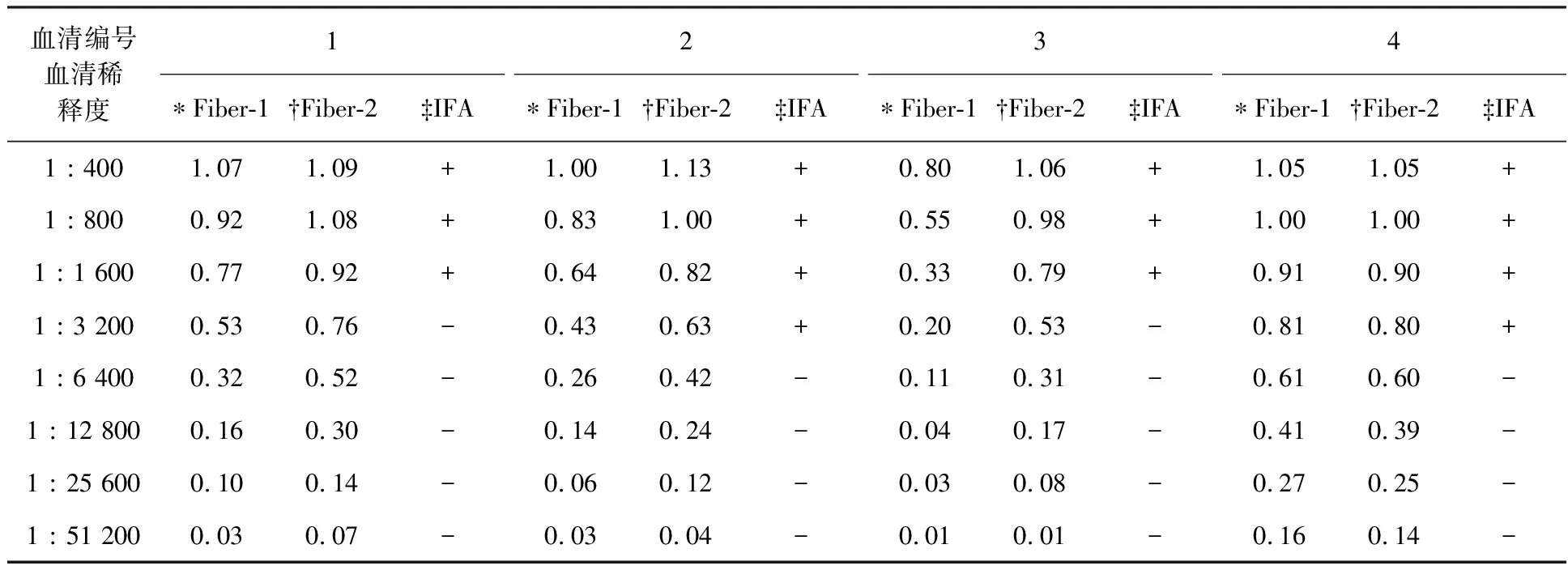
表1 Fiber-1_ELISA以及 Fiber-2_ELISA灵敏度试验结果
2.6 间接ELISA具有良好的重复性及稳定性
统计学分析显示,Fiber-1_ELISA及Fiber-2_ELISA在同一批次包被的三块酶标板中进行批内重复试验,批内变异系数分别为3.97%~9.71%和2.33%~8.70%;在三个不同批次包被的酶标板中进行批间重复试验,批间变异系数分别为2.12%~8.93%和2.70%~8.70%,均小于10%(表2、表3),表明所建立的ELISA方法结果稳定、重复性好。
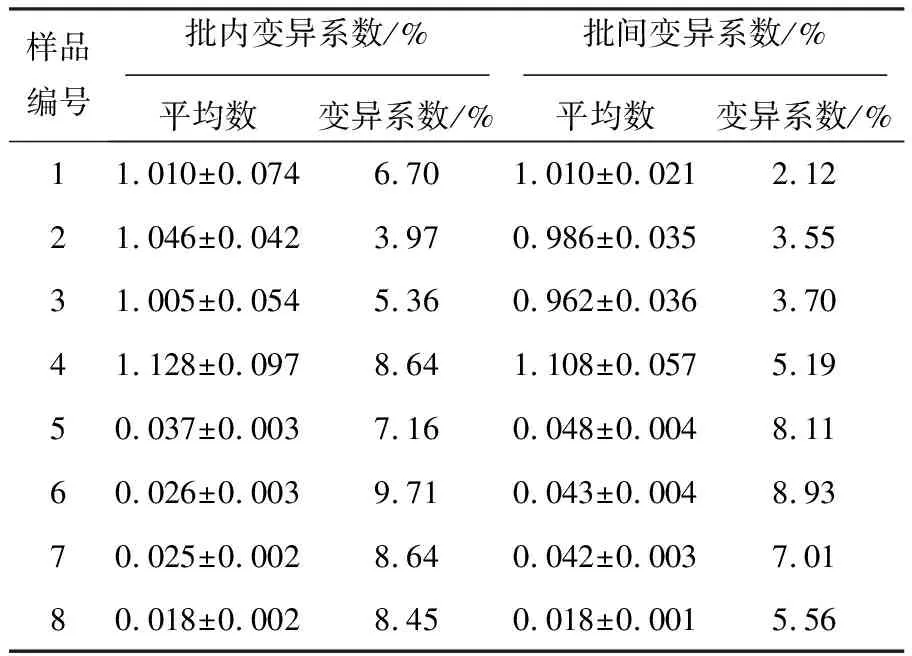
表2 Fiber-1_ELISA的重复性试验
2.7 间接ELISA与其他检测方法比较
利用本研究建立的Fiber-1_ELISA、Fiber-2_ELISA方法与荷兰Biochek FAdV抗体检测试剂盒对20份FAdV-4感染鸡群血清,20份FAdV-4灭活疫苗免疫血清及20份SPF鸡血清同步进行检测。结果显示,本研究建立的Fiber-1_ELISA、Fiber-2_ELISA方法与荷兰Biochek FAdV抗体检测试剂盒检测结果一致,即对感染或免疫血清均检出阳性而SPF血清均为阴性,符合率为100%(图8)。为比较感染FAdV-4后,鸡体产生的抗Fiber抗体与中和抗体的关系,对感染FAdV-4的鸡在不同时间段采集的鸡血清进行了比较检测。结果发现,Fiber-1、Fiber-2抗体以及中和抗体在FAdV-4感染后7 d即被检测到,随后一直上升至21 d时达到顶峰,并在28 d后均开始下降(图9A、9B)。感染鸡体内Fiber抗体水平和中和抗体水平呈现一致的变化规律,说明两者具有很强的相关性。以上结果表明所建立的Fiber-1_ELISA及Fiber-2_ELISA方法可靠性高,可用于FAdV-4的感染预警诊断及免疫水平评价。
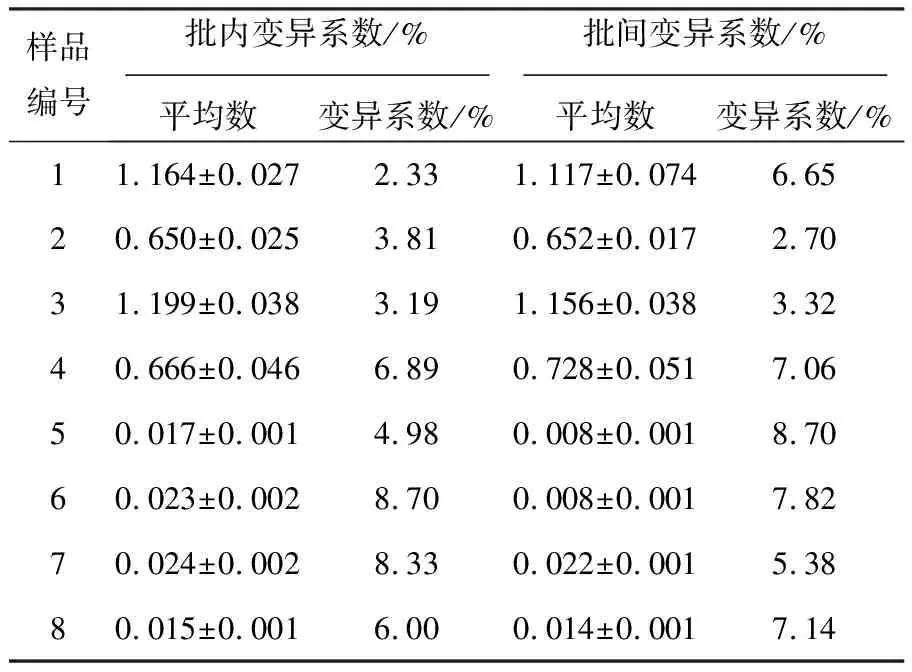
表3 Fiber-2_ELISA的重复性试验
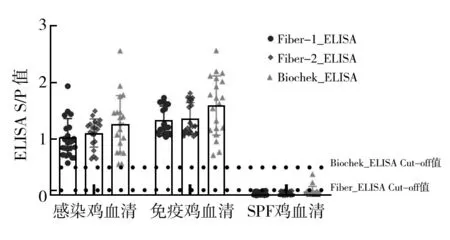
图8 Fiber-1_ELISA、Fiber-2_ELISA以及Biochek_ELISA检测不同鸡群血清Fig.8 Detection of serum form different flocks by Fiber-1 ELISA, Fiber-2 ELISA and Biochek_ELISA
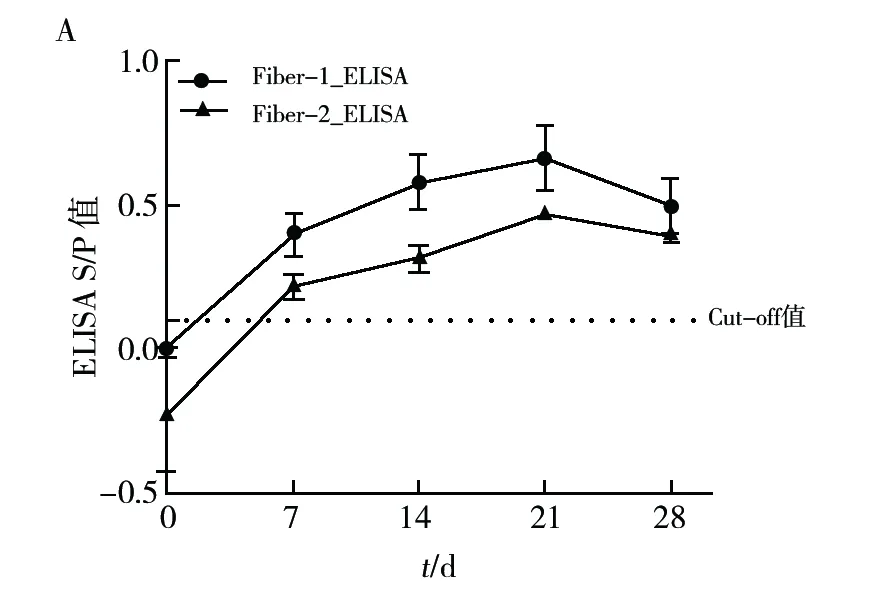

图9 Fiber_1 ELISA、Fiber_2 ELISA(A)以及中和试验(B)检测感染鸡群抗体水平变化Fig.9 Detection of serum from infected chicken flocks in different dpiby Fiber_1 ELISA, Fiber_2 ELISA (A) and Neutralization test (B)
3 讨 论
近年来,禽腺病毒的爆发严重危害家禽养殖业的健康发展。在腺病毒感染致病过程中,腺病毒基因组编码的主要表面结构蛋白六邻体,五邻体以及纤突蛋白均发挥极其重要的作用。其中纤突蛋白不仅含腺病毒中和性表位、血清型特异性抗原决定簇,并且在决定病毒组织嗜性、介导腺病毒感染与致病中也具有重大意义[11]。在禽腺病毒12个血清型中,近年来暴发的FAdV-4的致病性最强、危害性最大,是我国优势流行血清型禽腺病毒。值得注意的是,与大部分哺乳动物属腺病毒仅有一种纤突蛋白不同,禽腺病毒FAdV-1、FAdV-4以及FAdV-10具有非常独特的抗原模式,即具有两种纤突蛋白(Fiber-1与Fiber-2)。目前,研究发现FAdV-4的Fiber-1通过头部和杆部介导病毒的感染入侵[12-13],并且可有效诱导机体产生中和抗体;而Fiber-2则主要影响FAdV-4的复制和致病性[16-17],这些结果提示Fiber-1和Fiber-2是监测FAdV-4感染及其免疫状态极其重要靶点。
目前,中国尚无获批的FAdV-4特异性血清学检测技术,而荷兰Biochek公司生产的FAdV商品化ELISA试剂盒不仅价格高昂,且是以FAdV-1(CELO)全灭活病毒作为抗原包被,在评估FAdV-4疫苗产生的抗体水平中难免造成误差。Pan等[18]及罗思思等[19]分别以FAdV-4灭活病毒及纯化的Penton重组原核蛋白作为包被抗原,建立了针对Ⅰ群多种血清型FAdV的两种不同间接ELISA方法,但均不具有FAdV-4特异性。He等[20]以纯化的原核Fiber-2蛋白建立的ELISA方法则兼具良好的FAdV-4特异性和检出效果。昆虫杆状病毒表达系统的优势在于更强的翻译后修饰能力,如保留蛋白的天然糖基化修饰等,Feichtner等[21]在昆虫细胞中表达了加FAdV-4非致病性毒株KR5的纤突蛋白并应用于ELISA抗体检测,取得良好效果。然而我国流行的高致病性FAdV-4纤突蛋白在氨基酸水平上与国外毒株相比有相当程度的差异,目前国内采用的FAdV-4灭活候选疫苗也大多以流行株制备而得。因此,本研究拟通过靶向纤突蛋白,利用昆虫表达系统,建立特异性针对于当下国内流行的FAdV-4的纤突蛋白抗体的ELISA检测方法。
本研究首先靶向Fiber-1和Fiber-2蛋白进行杆状病毒系统表达,通过优化纯化条件得到了大量的、纯度高的纤突蛋白作为包被抗原,并对基于纤突蛋白ELISA方法的特异性、重复性、灵敏度等各种检测性能进行了评估。特异性试验显示ELISA方法仅特异针对FAdV-4,而不与Ⅰ群其他血清型禽腺病毒及其他禽源病毒阳性血清反应。两种ELISA批内和批间重复试验的变异系数均小于10%,表明本方法稳定性强、结果可靠。血清对比检测进一步发现,ELISA方法与商品化BioChek ELISA检测效果一致,表明本方法可有效检出免疫或感染鸡群中抗FAdV-4抗体。此外,本研究发现临床鸡血清中Fiber抗体水平与中和抗体水平呈现一致的变化规律和良好的相关性,表明本方法可有效评估针对FAdV-4的中和抗体水平。值得注意的是,市面上的FAdV-4疫苗主要为灭活疫苗和Fiber-2亚单位疫苗,评估疫苗效果时可根据实际需要选择Fiber-1_ELISA或Fiber-2_ELISA进行针对性检测,具有良好的应用价值。
综上所述,本研究所构建的FAdV-4特异性间接ELISA方法不仅较进口试剂盒成本低廉,且具有良好的检测效果,可广泛应用于FAdV-4的感染预警诊断及免疫水平评价,为持续监测鸡群中FAdV-4的感染状况、以及检测FAdV-4中国流行株制备的疫苗免疫后的抗体水平提供有力的工具。

