HDAC9通过下调PDE4b表达参与调控小鼠心肌肥厚
曹腾飞 孙中新 张俊
(1.成都市第一人民医院心内科,四川 成都 610016;2.成都市第三人民医院,四川 成都 610012)
心室肥厚性重构是心力衰竭病理进展中的重要环节之一[1-2],诸多信号通路及分子蛋白参与其中。β肾上腺素能受体通路在心脏生理及病理中均发挥重要作用[3],其通过激活第二信使cAMP促进PKA活性增加[4],进而磷酸化其下游底物,直接影响心肌舒缩力[5]。磷酸二酯酶(Phosphodiesterases, PDEs)能够直接降解cAMP而参与心脏功能调控[6]。现已发现PDEs共有11个亚型,其广泛参与机体生理功能调控,其中PED3和PDE4为心脏主要亚型[7]。PDE4活性被抑制与心律失常、心肌肥厚均有相关性[8]。有文献报道PDE4b基因敲除可致模型动物出现心律失常、心肌细胞肥厚及心力衰竭[9]。PDE4b在心衰心肌细胞中存在低表达情况[8-9]。然而其在心肌肥厚中的具体调控机制仍不完全清楚。基因启动子区域组蛋白乙酰化影响染色质构象,其是调控基因转录的重要方式[10-11]。乙酰化修饰由组蛋白乙酰化酶(Histone acetylase, HATs)和组蛋白去乙酰化酶(Histone deacetylase, HDACs)共同参与,动态调控基因转录[12],HDACs酶影响靶基因启动子区域组蛋白乙酰化水平,进而抑制基因转录。心脏HDAC4、5、9为心脏中最为重要的几种组HDAC亚型[13]。已有心衰研究提示心脏总体HDACs表达及活性均有升高[13],结合PDE4b在心衰中表达下调,因此本研究推测PDE4b的下调可能由HDACs调控介导。本研究以组蛋乙酰化调控为切入点,探讨其是否通过影响PDE4b,参与心肌重构(肥厚)的调控,为抗心室重构提供潜在治疗靶点。
1 材料与方法
1.1 实验动物 8周龄清洁级雄性C57小鼠18只,体重25~28 g,购于四川大学华西基础医学院动物中心,SCXK(川)2015-030。本实验小鼠的处理符合动物伦理要求,并经医院伦理委员会审核同意。
1.2 主要试剂 抗HDAC9抗体(ChIP级),工作浓度1∶2 000;抗PDE4b,工作浓度1∶2 000;抗β-actin抗体,工作浓度1∶2 000;ChIP试剂盒(Abcam 英国);HDAC酶活性试剂盒(HDAC Activity Fluorometric Assay kit, BioVision);山羊抗兔及山羊抗小鼠带HRP标记的IgG(北京中杉金桥生物技术有限公司);BCA蛋白测定试剂盒(Pierce公司);总RNA提取试剂盒(北京百泰克生物技术有限公司);反转录试剂盒(TaKaRa公司);实时定量PCR试剂盒(天根生化技术有限公司)。
1.3 方法
1.3.1 小鼠分组及处理 利用耳标形式将其编号,将编号录入SPSS软件中,利用软件将编号随机分为TAC组和对照组(SHAM组),每组9只。TAC组给予主动脉弓缩窄术(Transverse aortic constriction,TAC术)。予以4%戊巴比妥钠腹腔注射麻醉。小鼠取仰卧位。清洁手术区域,经胸骨正中切口,暴露胸腔,分离主动脉弓,6.0丝线打活结备用,将外径0.4 mm的27-G的平头针与动脉平行放置,穿入活结内,缝合丝线扎紧后移去针头。关闭胸腔。术中有2只小鼠出现死亡。SHAM组给予假手术,将丝线放置于相同位置,但不做结扎。术后4周利用二氧化碳处死小鼠,取心脏组织备用。
1.3.2 检测小鼠心脏/体重指数 术后4周利用METTLER TOLEDO电子秤进行体重称重,单位以克(g)计;利用二氧化碳窒息处死小鼠后,立刻开胸取心脏组织,PBS溶液中充分挤压,将心腔内血液排出。剔除心房组织,将心室置于干燥灭菌纱布上,来回滚动至无水印后对心室进行称重,单位以毫克(mg)计。心脏体重指数即为心室重量/体重(mg/g)。
1.3.3 H&E染色 心脏组织取出后放入4%多聚甲醛中固定过夜,冲水后利用梯度乙醇进行脱水,石蜡包埋后进行切片,切片厚度5 μm。切片后进行H&E染色。染色封片后在光学显微镜下进行拍照。H&E染色详细实验方法参照马恒辉等[14]文献报道。
1.3.4 实时定量PCR 按照RNA提取试剂盒说明书操作进行RNA提取,逆转录得到cDNA。后进行实时定量PCR检测。BNP的上游引物序列为5′-AC TCTTGGCTAACTG-3′,下游引物序列为5′-CAGTT AGCCAAGAGT-3′,产物长度为116 bp;PDE4b的上游引物序列为5′-TAACCTTCCCTGGGTAGC-3′,下游引物序列为5′-GCTACCCAGGGAAGGTTA-3′,产物长度为152 bp;HDAC4的上游引物序列为5′-T ACCGCCTCTCCAAGACA-3′,下游引物序列为5′-T GTCTTGGAGAGGCGGTA-3′,产物长度为139 bp;HDAC5的上游引物序列为5′-AATCGTCTGGGTA GATTCG-3′,下游引物序列为5′-CGAATCTACCC AGACGATT-3′,产物长度144 bp;HDAC9的上游引物序列为5′-CCGTAGATTGGCCATTGC-3′, 下游引物序列为5′-GCAATGGCCAATCTACGG-3′,产物长度124 bp;选取β-actin作为内参基因。所得数据用Bio-RadCFX96 荧光定量PCR 仪自带基于Pfaffl 原理的相对定量数据分析软件分析。
1.3.5 检测HDAC酶活性 利用BioVision的HDAC酶活性检测试剂盒对HDACs总体活性进行检测,操作按说明书进行。
1.3.6 Western blot检测PDE4b和HDAC9蛋白 小鼠冰浴下迅速取出胎盘组织,放入PBS中清洗,尽量除去残留血液,存于液氮中备用。收集胎盘组织后,利用全蛋白提取试剂盒,24 h内提取全蛋白,BCA蛋白浓度测定后调整上样量为40 μg,点样在10%的SDS-聚丙酰胺凝胶上进行电泳后电转至0.22 μm的PVDF膜上,用封闭液稀释Ⅰ抗(1∶500)后4℃过夜,洗膜后再孵育Ⅱ抗(1∶2000稀释),室温下孵育2 h后再洗膜后用化学发光成像,将条带输入Quantity one软件获得其吸光度,以目的蛋白/β-actin(吸光度值)来反映蛋白的相对表达量。
1.3.7 染色质免疫共沉淀(Chromatin immunoprecipitation,ChIP)实验 按照ChIP试剂盒操作进行染色质免疫共沉淀操作。
1.3.8 ChIP-qPCR检测HDAC9与PDE4b启动子结合水平 选取PDE4b 基因外显子5′端前1000 bp 序列,针对该序列设计特异性引物。引物用Primer Premier 5.0软件设计,由宝生物公司合成。PDE4b的上游引物序列为5′-ATGGTACGACGCTTCACTT CGCA-3′,下游引物序列为5′-TGCGAAGTGAAGC GTCGTACCTA-3′,产物大小为139 bp。所得数据用Bio-RadCFX96 荧光定量PCR 仪自带基于Pfaffl 原理的相对定量数据分析软件分析。

2 结果
2.1 小鼠心室/体质量比 分别称取小鼠心室重量及体重后,计算心室/体质量比(mg/g)。TAC组术后4周小鼠心室/体质量比(5.50±0.23)明显高于SHAM组(4.48±0.18),两组比较差异具有统计学意义(P<0.01)。见图1。
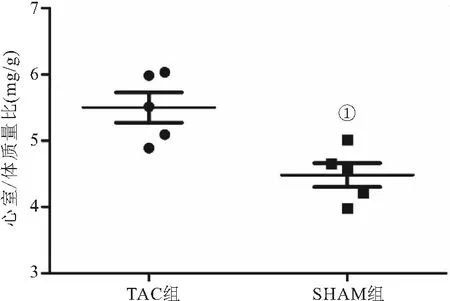
图1 TAC组与SHAM组小鼠心室/体质量比(n =5)
2.2 心脏组织结构 利用H&E染色后对比TAC术及SHAM术后4周心脏大体形态。左室后壁、室间隔明显增厚(图2A、2B)。200倍视野下,心肌细胞明显肥大,见图2C、2D。

图2 TAC及SHAM术后小鼠心肌细胞出现肥大
2.3 HDACs酶活性检测 HDACs酶总活性在TAC组(5.03±0.58)中明显高于SHAM组(3.24±0.32)(P<0.05),见图3。
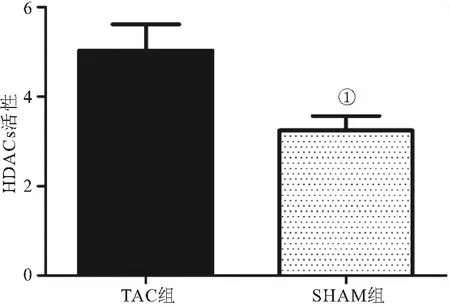
图3 TAC及SHAM组心脏组织中HDACs总体活性(n=5)
2.4 MYH7、PDE4b、HDAC4、HDAC5及HDAC9 mRNA 表达水平 q-PCR检测显示,与SHAM组比较,TAC组术后4周心肌肥厚标志物MYH7表达明显升高(0.91±0.04vs1.44±0.07 )(P<0.05,图4A);PDE4b表达明显下降(0.75±0.09vs0.27±0.06)(P<0.01,图4B);HDAC9明显升高( 0.85±0.08vs1.35±0.07)(P<0.05,图4C);HDAC4(1.29±0.12vs1.29±0.17)及HDAC5(1.92±0.33vs2.02±0.36 ) mRNA水平两组间差异无统计学意义(P>0.05),见图4D、4E。

图4 TAC组及SHAM组心脏组织中各基因表达(n=5)
2.5 HDAC9和PDE4b蛋白表达水平 Western blot检测显示,与SHAM组比较,TAC组心脏中HDAC9蛋白显著升高(0.77±0.10vs1.25±0.05)(P<0.05,图5A);PDE4b蛋白明显降低(0.67±0.11vsTAC 0.34±0.05)(P<0.05),见图5B。
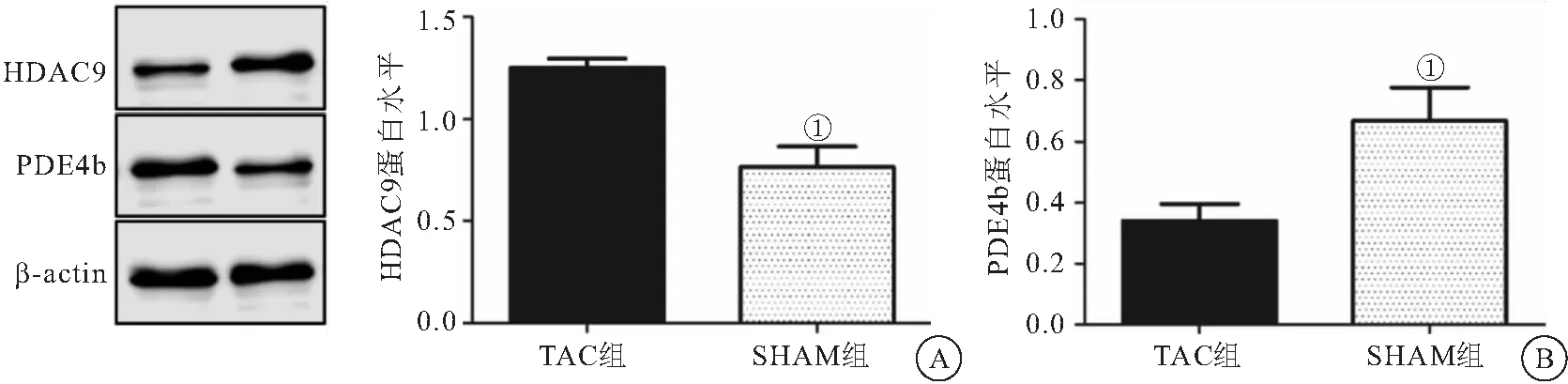
图5 TAC及SHAM组心脏组织中HDAC9及PDE4b蛋白表达量(n=5)
2.6 HDAC9与PDE4b启动子结合水平 与SHAM组比较,HDAC9与PDE4b启动子结合区域水平在TAC组中显著升高(1.67±0.1vs2.47±0.20,P<0.05),见图6。
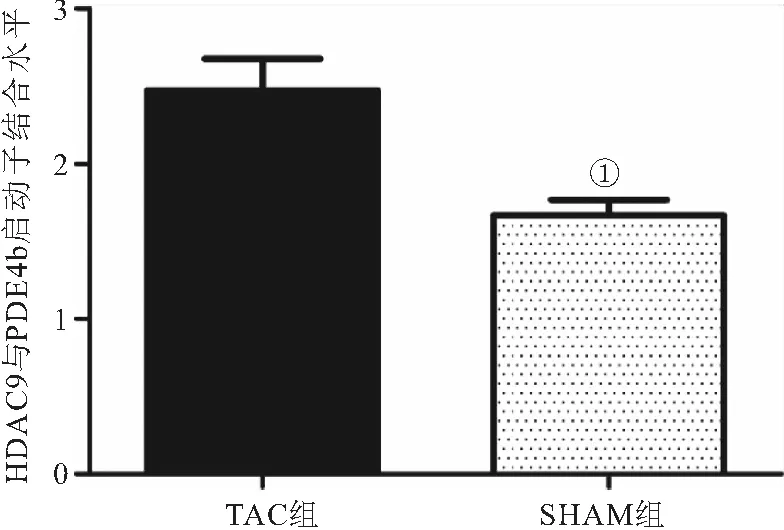
图6 HDAC9与PDE4b启动子结合水平(n=5)
3 讨论
心肌肥厚是心室肌重构的重要表现,其涉及众多信号通路紊乱及分子蛋白表达异常[15],为心力衰竭的重要病理过程之一。其显著特点为心室,尤其是左室后壁及室间隔增厚,心肌细胞肥大。TAC是构建心肌肥厚及心力衰竭模式动物的常用技术方法,本研究结果与经典TAC小鼠术后数据相似,术后4周心脏出现明显肥厚[16],心室/体质量指数也出现明显升高,同时心肌肥厚的重要标志物MYH7也出现表达上调[17],提示模型构建成功。
PDE在心脏生理及病理中均发挥重要作用,由于其不同亚型的底物有所不同,因此对PDE的研究应尽可能细化。西地那非,即为PDE5抑制剂,其已经被FDA批准用于部分心血管疾病的治疗[18]。然而PDE4b作为心脏中PDE的另一个重要亚型,其在病理状态下表达与PDE5有着显著区别,有研究发现PDE4b在心肌肥厚及心衰小鼠心肌细胞中均出现表达下调[19],最近研究在心力衰竭的人体心脏组织中也发现了其表达下降[20]。然而其在心肌肥厚及心衰中低表达的机制尚不清楚。本研究也发现在肥厚的小鼠心肌组织中,PDE4b表达明显下降。接下来,本研究将切入点放在了组蛋白乙酰化修饰上面。
作为影响基因转录表达重要表观遗传调控手段,组蛋白乙酰化调控已经为学者所熟知[21]。同时近些年不断有研究发现HDAC酶在心肌肥厚、心力衰竭发生、发展中的重要作用[22-23]。因此,本研究首先检测了HDACs酶在肥厚心肌组织中的总体活性,本研究发现HDACs酶总体活性明显升高。利用q-PCR本研究进一步发现,在肥厚心肌组织中HDAC9显著上调。提示其参与心肌肥厚发生。本研究继续利用染色质免疫共沉淀技术,探讨HDAC9上调是否参与PDE4b表达的下调。数据提示,心肌肥厚中HDAC9可直接结合于PDE4b启动子区域,进而下调其表达,然而并没有进一步利用荧光素酶报告系统设计细胞实验,探讨HDAC9与PDE4b启动子结合的具体区域,以及是否具有特异性,此为研究的局限性之一。
本研究解释了心肌肥厚中PDE4b下调的可能分子机制。组蛋白乙酰化修饰是一个可逆的过程,目前HDAC抑制剂也是心血管疾病研究的热点之一。因此,本研究结果将为心肌肥厚的干预提供潜在干预靶点。然而在这一病理过程中,是否伴随其他如PDE4a、PDE4d等亚型的变化,以及利用HDAC酶抑制剂是否能实现以PDE4b为靶点的挽救实验,仍值得我们后续关注。
4 结论
在心脏后负荷应激增加诱导的心肌肥厚中,组蛋白去乙酰化酶HDAC9可能通过调控PDE4b启动子组蛋白乙酰化水平,可能参与调控其转录表达,进而参与心肌肥厚病理进展。

