盐碱胁迫对巨菌草根际土壤微生物多样性及酶活性的影响
严少娟 刘怡萌 孙艳丽 林兴生 罗海凌 林辉 林占熺 孙红英







摘 要:為探明盐碱胁迫对巨菌草根际土壤微生物多样性及酶活性的影响,该文设置了7个盐碱梯度,利用SPSS和Illumina高通量测序分析巨菌草根际土壤生理指标和微生物多样性。结果表明:(1)各处理间,巨菌草根际土壤真菌和细菌结构均存在差异;12‰盐碱浓度下,真菌优势菌纲为粪壳菌纲(68.5%)、散囊菌纲(16.3%),细菌优势菌纲为绿弯菌纲(8.5%)、拟杆菌纲(13.5%)、芽单胞菌纲(5.6%)和δ-变形菌纲(3.7%);6‰盐碱浓度时,真菌优势菌纲为座囊菌纲(27.7%),细菌优势菌纲为厌氧绳菌纲(2.4%),当盐碱浓度提高至12‰时,该优势菌群的相对丰度分别降至2.5%和0.007%;真菌和细菌群落Chao指数和Shannon指数随着盐碱浓度的升高而降低,且与土壤盐碱浓度显著相关(P<0.01)。(2)低浓度盐碱胁迫对巨菌草根际土壤脲酶、多酚氧化酶、碱性磷酸酶活性均有促进作用,当盐碱浓度超过8‰时,土壤多酚氧化酶、碱性磷酸酶、蔗糖酶活性受到抑制;种植巨菌草后,土壤有机质含量显著提高(P<0.05)且盐碱浓度显著降低(P<0.05);种植巨菌草对土壤盐碱度的中和能力在中高浓度下较弱;盐碱浓度为6‰时,巨菌草产量最高,且土壤中的速效养分和有机质含量均高于其他盐碱浓度。该研究表明,巨菌草能通过调节酶的浓度来适应中低浓度盐碱环境,且在不同浓度的盐碱土壤中,产生相应的优势菌群来适应该环境,种植巨菌草对中低浓度盐碱土壤有一定改良作用。
关键词: 盐碱胁迫, 土壤微生物, 理化性质, 土壤肥力, 耐盐植物
中图分类号:Q948.12
文献标识码:A
文章编号:1000-3142(2022)03-0491-10
Analysis of microbial diversities and enzyme activities of
rhizosphere soil of Pennisetum giganteum (giant juncao)
under different degrees of saline-alkali stress
YAN Shaojuan1,2, LIU Yimeng2,3, SUN Yanli4, LIN Xinsheng2, LUO Hailing2,
LIN Hui2, LIN Zhanxi2, SUN Hongying1,2*
( 1. College of Resource and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. National Engineering Research Center of Juncao, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 3. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 4. Lanshan Forest Bureau of Linyi, Shandong Province, Linyi 276001, Shandong, China )
Abstract:Salinty and alkali are the serious stress in arid and semiarid area, which has a bad effect on plant growth. It is necessary for us to explore the variety of microbial community and the activity of enzyme in rhizosphere of Pennisetum giganteum(giant juncao) under saline-alkali environment. As a result, we set up the experiment with seven different kinds of saline-alkali concentrations, analyze the difference significance and correlation of physiological data under different saline-alkali concentrations with the method of SPSS, and analyzed the diversities of microbial communities with the method of Illumina high-throughput sequencing. The results were as follows: (1) The composition of microbial communities in rhizosphere soil of giant juncao differed at different saline-alkali stresses; The dominant groups were Sordariomycetes (68.5%), Eurotiomycetes (16.3%), Chloroflexia (8.5%), Bacteroidia (13.5%), Gemmatimonadetes (5.6%) and δ-Proteobacteria (3.7%) at the 12‰ saline-alkali concentration; The relative abundance of the Dothideomycetes (27.7%)and Anaerolineae (2.4%) was sharply reduced to 2.5% and 0.007% when the saline-alkali concentration increased from 6‰ to 12‰; The Chao and Shannon indexes of the rhizosphere microbial community of giant juncao decreased with increasing saline-alkali concentration, and were significantly correlated with soil saline-alkali concentration (P<0.01). (2) The low concentration of saline-alkali stress had a positive effect on activities of urease, polyphenol oxidase and alkaline phosphatase in rhizophere soil of giant juncao, but activities of polyphenol oxidase, alkaline phosphatase and sucrase were inhibited when the saline-alkali concentration of soil exceeded 8‰; After planting giant juncao, the content of soil organic matter increased significantly (P<0.05) and the saline-alkali concentration were reduced significantly (P<0.05); The neutralizing ability to soil alkalinity gradually weakened with the increasing saline-alkali concentration, and the neutralizing ability of soil salinity gradually weakened when the concentration exceeded to 8‰; When the saline-alkali concentration was 6‰, the production of giant juncao was the highest and the soil had higher contents of available nutrients and organic matter. The research indicates that growing giant juncao is beneficial to improving the fertility of saline-alkali soil by adjusting the enzyme concentration to better adapt to the medium and low concentration saline-alkali soil environment, and producing the corresponding dominant flora to adapt to the environment in different degrees of saline-alkali soil.
Key words: saline-alkali stress, soil microorganisms, physical and chemical properties, soil fertility, salt-tolerant plant
盐碱地由盐土和碱土组成,可溶性盐浓度达0.6%及以上的土壤叫做盐土,pH值超过9,交换性钠离子浓度达到阳离子总代换量20%及以上的土壤叫做碱土(张鹏辉等,2017)。根据联合国教科文组织及世界粮农组织的统计显示,当前全球的盐碱地主要分布在欧亚大陆、非洲和美洲西部,总面积约为9.54×108 hm2。我国的盐碱地總面积已经多达9 913×104 hm2,分布于我国23个省(自治区)和市,已经占据了我国国土总面积的10%(王景立等,2018),该现状已严重威胁到我国的生态环境与粮食安全,研究出一种合适且具有生态效益的改良方法已迫在眉睫。
土壤根际微环境是土壤中的特殊微域之一,也是植物获取养分的主要区域。在这块区域里,植物、微生物、土壤相互作用(Ma et al., 2015)。研究发现,土壤酶和微生物是土壤根际微环境中的活跃组分,对自然或人为因素造成的变化响应比较敏感(Xie et al., 2007)。土壤酶包括微生物细胞和动植物残体的胞内酶以及土壤溶液和吸附在土壤颗粒表面的酶(关松荫等,1986)。土壤肥力、理化性质、植被和微生物种类与数量是影响土壤酶活性的主要因素。土壤盐碱化可以改变土壤的一些理化性质,可直接影响微生物的生存(Mo et al., 2016),也可间接影响土壤微生物的生境,使微生物的种群、数量和活性以及土壤酶活性等方面受到损害,导致土壤微生态失衡,从而影响作物生产(Chen et al., 2004)。因此,研究土壤酶活性和微生物的影响因素对植物更好地生长具有重要意义。
菌草是指适合作为食用菌、药用菌培养基并有综合开发利用价值的草本植物(林占熺,2013)。1989年,菌草开始应用于生态改良,主要用于砒砂、崩岗和沙地的治理(林占熺等,2019)。彭露等(2014)利用菌草耐盐碱的特性,将其作为改良和利用盐碱土地的作物并进行了初步的研究,发现巨菌草能在盐碱土地等生态脆弱地区种植并能快速成为优势种,对当地土壤生态环境起到一定的改良作用。林兴生等(2013a,b)、潘羿壅等(2018)初步研究了盐碱胁迫对菌草生理指标的影响,筛选出了抗性较好的巨菌草(Pennisetum giganteum),同时发现巨菌草可以通过抗氧化酶的作用来降低氧化伤害,使植株维持正常的生理代谢。林占熺等(2015)通过对巨菌草在不同类型盐碱土地的生物学特性研究,发现其在治理盐碱地方面具有可行性,尤其是在砂化盐碱地上,表现出生物量大且能很好地固定土壤的优点。利用该特点,巨菌草已广泛应用于内蒙古阿拉善等地区,用以防风固沙和改良盐碱土壤。然而,盐碱对巨菌草根际土壤微生物多样性及酶活性的影响还未见报道。本研究通过设置不同盐碱梯度实验,研究盐碱胁迫对巨菌草根际土壤微生物和酶活性的影响。
1 材料与方法
1.1 材料
本实验于2019年3—10月在福建农林大学(旗山校区)国家菌草工程技术研究中心育苗基地进行。选取抗盐碱能力强的巨菌草为材料,进行土培盆栽实验。每盆(高25 cm,直径30 cm)装取土壤4.5 kg,扦插2根巨菌草扦插杆,出苗后间苗到1株。该实验基础土壤为自然土,土壤理化性质:pH值7.42、含盐量0.667 g·kg-1、碱解氮含量0.133 1 g·kg-1、速效磷含量0.335 3 g·kg-1。
1.2 方法
巨菌草生长1个月后进行盐碱胁迫实验。预实验结果表明,当盐碱浓度达到14‰时,巨菌草无法存活,因此,本实验设置7个盐碱胁迫梯度[土壤盐碱浓度:0(CK)、2‰、4‰、6‰、8‰、10‰、12‰],每个梯度设置三个重复。所用盐碱成分为Na2CO3和NaHCO3,按照摩尔比1∶1混合。胁迫完成后全生育期充足供水。
盐碱胁迫90 d后,取根际土壤2份,1份立即存于-80 ℃冰箱,用于测定土壤微生物多样性,1份自然风干,用于测定土壤多酚氧化酶、蔗糖酶、脲酶、碱性磷酸酶活性和碱解氮、速效磷、速效钾、有机质含量。土壤酶活性参考严昶升(1988)和林先贵(2010)的方法测定;土壤养分参考鲁如坤(2000)和鲍士旦(2000)的方法测定。
微生物多样性测定采用Illumina高通量测序分析。采用福州麦力公司快速无毒通用 DNA提取试剂盒,分别提取真菌和细菌 DNA;利用1%琼脂糖凝胶电泳检测抽提的基因组DNA,进行PCR扩增,在ITS1F_ITS2R和338F_806R测序区域合成带有barcode的特异引物。PCR扩增步骤: 首先95 ℃预变性 2 min;然后98 ℃变性10 s,62 ℃退火30 s,68 ℃延伸30 s,共27个循环;最后延伸68 ℃ 10 min。接着进行荧光定量,参照电泳初步定量结果,将PCR产物用QuantiFluor-ST蓝色荧光定量系统(Promega公司)进行检测定量,选择符合测序要求的样品,由美吉生物公司完成测序。按照每个样本的测序量要求,进行相应比例的混合。最后进行Miseq文库的构建与测序。
1.3 数据处理
测定结果统计与分析采用Excel 2007软件和SPSS 19.0软件进行处理,土壤理化性质指标为平行样均值±标准差,对各处理间各类指标的差异进行差异显著性检验(P<0.05)以及Pearson相关性分析。
使用Usearch、Mothur软件计算97%的相似度分类单位(operational taxonomic units,OTU)数量、高级信息OTU丰度、Alpha多样性及聚类等(Paul et al., 2004; Susan et al., 2010)。
2 结果与分析
2.1 不同盐碱胁迫下巨菌草根际土壤酶活性的变化
如图1所示,随着土壤盐碱浓度的增加,巨菌草根际土壤多酚氧化酶活性呈先升高后降低趋势(图1:A),土壤盐碱浓度在6‰~10‰时,显著高于对照组(P<0.05);根际土壤蔗糖酶活性呈逐渐降低趋势(图1:B),土壤盐碱浓度在2‰~12‰时,显著低于对照组(P<0.05);根际土壤脲酶活性,随盐碱浓度呈逐渐升高趋势(图1:C),在6‰~12‰盐碱浓度区间时,显著高于对照组 (P<0.05);根际土壤碱性磷酸酶活性,随土壤盐碱浓度的增加,呈先升高后降低趋势(图1:D),但在土壤盐碱浓度超过6‰时,活性逐渐降低,且与对照组差异显著(P<0.05)。
2.2 巨菌草根際土壤微生物对盐碱胁迫的响应
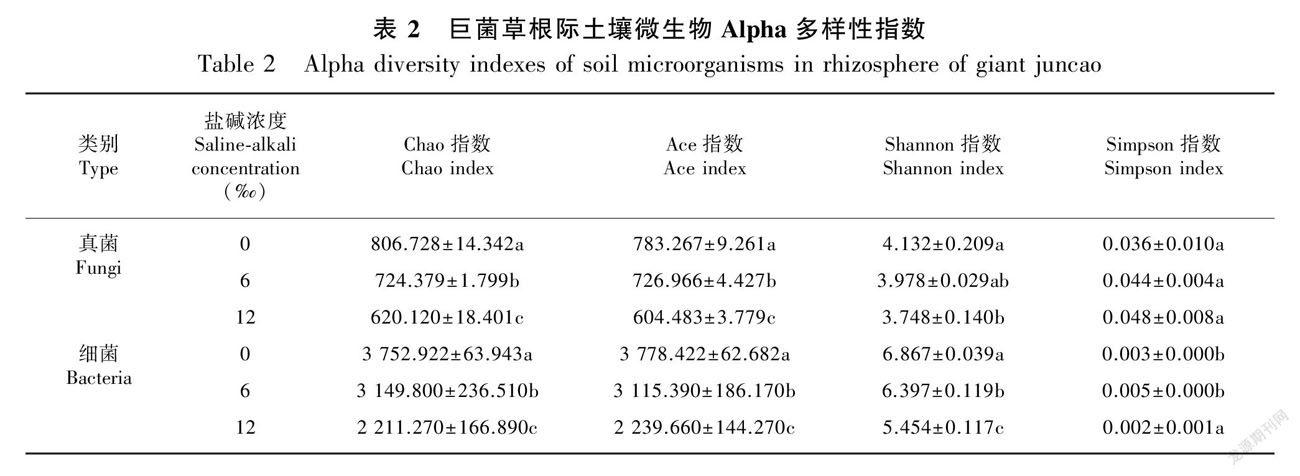
2.2.1 盐碱胁迫下巨菌草根际土壤微生物的多样性指数分析 对巨菌草产量有显著差异的处理(0‰、6‰和12‰)(图2)进行微生物多样性分析。如表1所示,各梯度间的真菌有效序列有显著差异,与6‰相比,12‰的真菌有效序列减少了3.33%(P<0.05); 进行OTU聚类后,真菌OTU数量在土壤盐碱浓度为12‰ 时最低,比6‰和0‰分别减少了19.7%和27.2%。细菌有效序列在各处理间均有显著差异,其中土壤盐碱浓度为6‰时最高(P<0.05);细菌OTU 数量在土壤盐碱浓度为12‰时,与 6‰和0‰时相比,分别减少了20.7%和26.9%。
如表2所示,根际土壤中真菌和细菌的Chao指数和Ace指数均会随着盐碱浓度的升高而降低,且不同处理之间差异显著,Shannon指数也随盐碱浓度的升高而降低。通过Chao指数和Ace指数可以看出,巨菌草的根际土壤真菌和细菌群落丰富度与OTUs变化基本一致。本研究中细菌、真菌的Simpson优势度指数均值随盐碱浓度的升高而升高,但变化不显著。
2.2.2 盐碱胁迫下巨菌草根际土壤真菌群落组成分析 根据测序分类的结果,以物种至少在一个样本中的相对丰度达到0.1%以上为标准,测得的真菌可以归属为4门8纲14目24科32属。如图3所示,根际土壤真菌在纲水平上的相对丰度差异情况如下:粪壳菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)和unclassified_p_Ascomycota的相对丰度在土壤盐碱浓度为12‰时分别为68.5%、16.3%、8.1%,均高于其他两种处理;座囊菌纲(Dothideomycetes)的相对丰度在土壤盐碱浓度为12‰时,急剧减少,只有2.5%。
2.2.3 盐碱胁迫下巨菌草根际土壤细菌群落组成分析 如图4所示,土壤细菌在纲水平上的相对丰度差异情况如下:盐碱浓度为12‰时,巨菌草根际土壤中,绿弯菌纲(Chloroflexia)、拟杆菌纲(Bacteroidia)、芽单胞菌纲(Gemmatimonadetes)和δ-变形菌纲(δ-Proteobacteria)的相对丰度分别为8.5%、13.5%、5.6%和3.7%,均高于其他两种土壤生境;α-变形菌纲(α-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria)的相对丰度在土壤盐碱浓度为6‰时,占比分别为23.03%和8.8%,大于土壤盐碱浓度为12‰和0‰时的土壤生境;厌氧绳菌纲(Anaerolineae)的相对丰度随土壤盐碱浓度升高而减少,在12‰盐碱土壤中仅有0.007%。
2.3 种植巨菌草前后土壤盐碱及营养元素的变化
如表3所示,种植巨菌草后的土壤盐碱度均有降低。种植巨菌草对土壤碱度的中和能力随盐碱浓度的升高逐渐减弱,对土壤盐度的中和能力在中低盐碱浓度随盐碱浓度的升高而升高,但浓度超过8‰时逐渐减弱。
如表4所示,种植巨菌草后土壤碱解氮、速效磷和速效钾含量均显著小于未种植巨菌草的土壤(P<0.05),且盐碱浓度为6‰时的碱解氮、速效磷和速效钾含量均显著大于盐碱浓度为12‰的土壤(P<0.05)。土壤有机质含量随盐碱浓度的升高显著减少(P<0.05)。种植巨菌草后的土壤有机质含量显著高于未种植巨菌草的土壤(P<0.05)。
3 讨论与结论
3.1 盐碱胁迫对巨菌草根际土壤酶活性的影响
土壤酶在土壤环境中通过不同微生物类群生理代谢产生(Baldrian, 2009),是反映土壤肥力的重要指标(Petric et al., 2011; You et al., 2014)。土壤酶活性的变化反映了土壤微生物对环境改变的响应机制(Cusack et al., 2011)。土壤多酚氧化酶是抗氧化酶的一种,本研究中,在盐碱浓度为6‰~10‰时,显著升高68.5%~122.4%(P<0.05)。潘羿壅等(2018)发现植物通过抗氧化酶作用降低氧化伤害,维持其正常生理代谢,本研究巨菌草在中低程度盐碱土壤中,多酚氧化酶浓度较高,说明巨菌草可以较好地适应盐碱环境。蔗糖酶可以将碳水化合物水解成微生物繁殖所需要的养分,其活性可以用来表征土壤生物学活性,作为评价土壤熟化程度的指标(耿玉清和王冬梅,2010)。陈孔飞等(2020)研究发现沙枣林土壤中蔗糖酶活性随盐碱浓度升高而降低,与本文研究结果蔗糖酶在2‰~12‰盐碱浓度时显著降低6.9%~77.8%(P<0.05)相一致,说明巨菌草根际土壤微生物活性随盐碱浓度的升高显著降低。脲酶在土壤中很活跃,直接参与到土壤中有机氮的转化过程中,土壤中脲酶活性的提高有助于将有机氮转化为可被植物直接利用的有效氮(薛冬等,2005)。颜路明和郭详泉(2017)研究发现,经过盐碱处理的香樟幼苗根际土壤中的脲酶活性,在一定浓度的盐碱胁迫下有升高趋势,与本研究结果基本一致,说明巨菌草在中高浓度盐碱土壤环境中仍有较强的氮素转化能力,对盐碱土壤环境有较好的适应性。土壤磷酸酶活性有酸性、中性和碱性3种(Frankenberger et al., 1983),其活性大小影响土壤中有机磷的循环速度且活性易受pH影响(王涵等,2008)。本研究中,碱性磷酸酶在盐碱浓度为2‰~10‰时,显著升高15.0%~68.9% (P<0.05)。刘磊(2017)研究发现,两种甜菜根际土壤的碱性磷酸酶随处理水平的增加呈“中-高-低”的趋势,与本研究结果一致,这充分印证了巨菌草在中低浓度盐碱环境中能较好生长。也有不同观点,如杨晓娟等(2013)和唐健等(2016)的研究表明,林地土壤的磷酸酶与pH值正相关,其原因可能是土壤酶活性受到林龄的影响显著,受pH的影响不大。综上所述,本研究发现,中度盐碱胁迫对巨菌草的根际土壤脲酶、多酚氧化酶、碱性磷酸酶活性有促进作用,而当土壤盐碱浓度超过8‰时,巨菌草的根际土壤多酚氧化酶、碱性磷酸酶和蔗糖酶会受到抑制,这说明巨菌草在中低盐碱土壤中,能较好地维持正常生理代谢。
3.2 盐碱胁迫对巨菌草根际土壤微生物的影响
Lauber等(2009)认为盐碱程度是影响土壤微生物群落结构的主要因素之一。在极端盐碱土壤中,分布着大量的喜盐碱菌类,而非耐盐碱菌类则不占有优势(石伟,2011;李新,2015;李新等,2016)。在不同程度盐碱土壤中,耐盐碱的菌株为主要组分,本研究详细描述了巨菌草根际土壤真菌、细菌在纲水平上的表现。在真菌群落内,纲水平下的粪壳菌纲、散囊菌纲和unclassified_P_Ascomycota,均与土壤盐碱浓度正相关,逐渐成为优势菌群;纲水平下的座囊菌纲相对丰度均与土壤盐碱浓度负相关,逐渐成为劣势菌群。在细菌群落内,纲水平下的绿弯菌纲、拟杆菌纲、芽单胞菌纲和δ-变形菌纲丰度随土壤盐碱浓度升高而提高,逐渐成为优势菌群,其耐盐碱性比其他菌群更强;纲水平下的放线菌纲和γ-变形菌纲丰度,均随土壤盐碱浓度增加而减少,逐渐成为劣势菌群,以上结论与李新(2015)在不同程度盐碱胁迫的条件下得到的土壤微生物优势菌群高度一致。
结合巨菌草地上部产量,分析根际土壤微生物群落结构发现,真菌、细菌的有效序列数与巨菌草的产量正相关(P<0.05),真菌OTUs和细菌OTUs与土壤盐碱浓度负相关(P<0.01)。根际土壤微生物Chao指数、Ace指数、Shannon指数均会随盐碱浓度升高而降低,表明土壤盐碱浓度越高,其根际土壤中的细菌类群越少,与前人研究结果基本一致(Karen & Pamela, 2006)。范俊岗等(1995)的研究还证实,根系分泌物中含有助于植物生长的植物生长素及氨基酸,可促进产量的提高,由此推测微生物结构发生变化,也可能是受植物根系分泌物的影响,根系分泌物为根际土壤微生物系统提供所需要的碳源和能源等充足的营养条件,还影响着根际微生物的多样性(田晴等,2020)。本研究中,座囊菌纲在盐碱浓度6‰时为优势菌纲,而在12‰盐碱浓度时数量减少,可能为巨菌草的促生菌类,这与叶文雨等(2020)的研究长势良好的巨菌草根际土壤优势菌纲为座囊菌纲等相一致,说明巨菌草根际土壤微生物群落数量会随盐碱浓度升高而减少,但是会出现相应的优势菌群来维持土壤微环境的平衡。
3.3 种植巨菌草对土壤盐碱浓度及营养元素的影响
土壤pH值是反应土壤酸碱化程度的主要指标,也是影响土壤肥力的重要因素之一(陈苗苗,2017)。种植巨菌草后的土壤pH值减小,可解释为植物死去的根叶在腐解过程中,形成大量的有机酸类加上植物根系分泌的有机酸,对碱性盐类起到了中和作用(涂书新等,2000)。减小幅度随着土壤盐碱梯度的升高而逐渐降低, 说明巨菌草对高浓度盐碱胁迫的调节能力较为一般,吴振振等(2016)研究发现,盐碱土壤的pH随甘草种植时间的增加呈下降趋势, 与本研究结果一致。导致土壤理化性质恶化的一个重要原因是土壤盐分浓度过高,土壤盐分的变化情况是衡量盐土改良效果的关键指标(陈琴,2012)。本研究中,各个盐碱梯度的土壤种植巨菌草后,含盐量均有一定程度减小,这可能是因为巨菌草生长发育需从土壤中吸收一定的盐分。李瑞利(2010)研究发现,种植五种耐盐植物后,土壤含盐量明显下降,尤其是在表层的根系层,这与本研究结果保持一致。土壤含盐量减小幅度随土壤盐碱梯度的升高呈先升高后降低趋势,这说明一定程度的含盐量可能会促进巨菌草生长发育及对土壤盐分的吸收,但在土壤含盐量过高时,巨菌草生长发育受到抑制,对土壤盐度的改善能力也随之减弱。种植巨菌草后,盐碱土壤中的碱解氮、速效磷和速效钾含量均显著小于未种植土壤,说明巨菌草能在盐碱环境中较好地吸收土壤中的速效养分,维持正常生长,从而适应该盐碱土壤环境。
综上所述,巨菌草能通过调节酶的浓度来适应中低浓度盐碱环境,且在不同程度的盐碱土壤中,产生相应的优势菌群来适应该环境。种植巨菌草对中低浓度盐碱土壤有一定改良作用,显著提高了土壤有机质含量,且pH值和含盐量会有一定程度减小,其改良能力随盐碱浓度的升高逐渐减弱。
参考文献:
BALDRAIN P, 2009. Microbial enzyme-catalyzed processes in soils and their analysis[J]. Plant Soil Environ, 55(9): 370-378.
BAO SD, 2010. Soil agronomicanalysis [M]. 3rd ed. Beijing: China Agricultural Press: 22-114. [鲍士旦, 2010. 土壤农化分析 [M]. 3版. 北京: 中国农业出版社: 22-114.]
CHEN GC, HE ZL, WANG YJ, 2004. Impact of pH on microbial biomass carbon and microbial biomass phosphorus in red soils[J]. Pedosphere, 14(1): 9-15.
CHEN KF, ZHANG RZ, CAI LQ, et al., 2020. Effects of salinization on soil nutrients and enzyme activities in Elaeagnus angustifolia forest [J]. Territory Nat Res Stud, 4(5): 60-64. [陈孔飞, 张仁陟, 蔡立群, 等, 2020. 盐渍化对沙枣林土壤养分和酶活性的影响[J]. 国土与自然资源研究, 4(5): 60-64.]
CHEN MM, 2017. Evaluation of soil improvement effects of different tree species on coastal saline land in the Yellow River Delta[D]. Tai’an: Shandong Agricultural University: 15-17. [陳苗苗, 2017. 不同树种对黄河三角洲滨海盐碱地的土壤改良效应评价[D]. 泰安: 山东农业大学: 15-17.]
CHEN Q, 2012. Research on the effect of willow on fertilization and improvement of coastal saline soil [D]. Nanjing: Nanjing Forestry University: 33-35. [陈琴, 2012. 柳树对滨海盐土的培肥改良效应研究[D]. 南京: 南京林业大学: 33-35.]
CUSACK DF, SILVER WL, TORN MS, et al., 2011. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 92(3): 621-632.
FANG JG, 1995. Plant root secretion and its significance in forestry[J]. Plant Res, 15(2): 246-251. [范俊岗, 1995. 植物根系分泌及其在林业中的意义[J]. 植物研究, 15(2): 246-251.]
FRANKENBERGER JR, JOHANSON JB, NELSON CO, 1983. Urease activity in sewage sludge amended soils[J]. Soil Biol Biochem, 15(5): 543-549.
GENG YQ, WANG DM, 2010. Research progress on the determination method of soil hydrolase activity[J]. Chin J Eco-Agric, 20(4): 387-394. [耿玉清, 王冬梅, 2010. 土壤水解酶活性測定方法的研究进展[J]. 中国生态农业学报, 20(4): 387-394.]
GUAN SY, 1986. Soil enzymes and their research methods[M]. Beijing: Agricultural Press: 56. [关松荫, 1986. 土壤酶及其研究法[M]. 北京: 农业出版社: 56.]
KAREN MC, PAMELA AM, 2006. The influence of tropical plant diversity and composition on soil microbial communities[J]. Microbial Ecol, 52 (2): 226-238.
LAUBER CL, HAMAMDY M, KNIGHT R, et al., 2009. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Appl Environ Microbiol, 75(15): 5111-5120.
LI RL, 2010. Study on salt tolerance mechanism of two typical halophytes and application of salt tolerant plants to improve saline soil [D]. Tianjin: Nankai University: 56-58. [李瑞利, 2010. 两种典型盐生植物耐盐机理及应用耐盐植物改良盐渍土研究[D]. 天津: 南开大学: 56-58.]
LI X, JIAO Y, DAI G, et al., 2016. Soil bacterial community diversity under different degrees of saline-alkaline in the Hetao Area of Inner Mongolia[J]. Chin Environ Sci, 36(1): 249-260. [李新, 焦燕, 代钢, 等, 2016. 内蒙古河套灌区不同盐碱程度的土壤细菌群落多样性[J]. 中国环境科学, 36(1): 249-260. ]
LI X, 2015. Study on microbial diversity of saline-alkali soils with different salinity levels[D]. Hohhot: Inner Mongolia Normal University: 24-25. [李新, 2015. 不同盐碱程度盐碱土壤微生物多样性研究[D]. 呼和浩特: 内蒙古师范大学: 24-25.]
LIN XG, 2010. Principles and methods of soil microbiology research[M]. Beijing: Higher Education Press: 128. [林先贵, 2010. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社: 128.]
LIN XS, LIN ZX, LIN DM, et al., 2013a. Assessment on salt resistance at seedling stage of 5 species of juncao under NaCl stress[J]. J Fujian Agric Univ(Nat Sci Ed), 42 (2): 195-201. [林兴生, 林占熺, 林冬梅, 等, 2013a. 5种菌草苗期抗盐性的评价[J]. 福建农林大学学报(自然科学版), 42(2): 195-201.]
LIN XS, LIN ZX, LIN H, et al., 2013b. Physiological responses and alkaline-tolerance evaluation on 5 species of juncao under alkaline stress during seeding stage[J]. Plant Physiol J, 49 (2): 167-174. [林兴生, 林占熺, 林辉, 等, 2013b. 五种菌草苗期对碱胁迫的生理响应及抗碱性评价[J]. 植物生理学报, 49(2): 167-174.]
LIN ZX, TONG JF, 2008. Pennisetum sp. Lin planting method and its application as biomass energy power generation: CN200810071521.0[P]. [林占熺, 童金阜, 2008. 巨菌草种植方法及其作为生物质能源发电的应用: CN200810071521.0 [P]. 2008-12-17.]
LIN ZX, 2013. Juncao science [M]. 3rd ed. Beijing: National School of Administration Press: 14-15. [林占熺, 2013. 菌草学[M]. 3版. 北京: 国家行政学院出版社: 14-15.]
LIN ZX, LIN DM, SU DW, et al., 2015. Effect of different salt-affected soils on biological characteristics of Pennisetum sp.[J]. SW Chin J Agric Sci, 28(2): 675-680. [林占熺, 林冬梅, 蘇德伟, 等, 2015. 不同类型盐渍地对巨菌草生物学特性的影响初探[J]. 西南农业学报, 28(2): 675-680.]
LIN ZX, SU DW, LIN H, et al., 2019. Constructing an ecological barrier by juncao along the Yellow River and its industrial application[J]. J Fujian Agric For Univ(Nat Sci Ed), 48(6): 803-812. [林占熺, 苏德伟, 林辉, 等, 2019. 黄河菌草生态安全屏障建设的研究与应用[J]. 福建农林大学学报(自然科学版), 48(6): 803-812.]
LIU L, 2017. Effects of mixed alkaline salts on root enzymes and rhizospheric microorganisms of sugar beet seedlings[D]. Harbin: Northeast Agricultural University: 33-35. [刘磊, 2017. 混合碱性盐对甜菜苗期根系及根际土壤酶和微生物的影响[D]. 哈尔滨: 东北农业大学: 33-35.]
LU RK, 2000. Soil agrochemical analysis methods[M]. Beijing: China Agricultural Science and Technology Press: 34-38. [鲁如坤, 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社: 34-38 ]
MA L, MA K, YANG GL, et al., 2015. Effects of continuous potato cropping on the diversity of soil microorganisms[J]. Chin J Eco-Agric, 23(5): 589-596.
MO JJ, PENG SC, YE CH, et al., 2016. Effects of salt stress on microbial biomass and enzyme activities in rhizospheric soil of sugarcane[J]. Guangdong Agric Sci, 43(6): 103-108.
NIU SQ, JING CH, LIAO SQ, et al., 2013. Bacterial population structure diversity in saline-alkali soil in Hexi corridor[J]. J N Norm Univ(Nat Sci Ed), 49(2): 90-95. [牛世全, 景彩虹, 廖世齐, 等, 2013. 河西走廊盐碱土细菌种群结构多样性的研究[J]. 西北师范大学学报(自然科学版), 49(2): 90-95.]
PAN YY, 2018. Study on the response mechanism of the growth physiological characteristics of Pennisetum giganteum z.x.Lin to salt-alkali mixed stress [D]. Hohhot: Inner Mongolia Agricultural University: 25-29. [潘羿壅, 2018. 巨菌草生长生理特性对盐碱混合胁迫的响应机制研究[D]. 呼和浩特: 内蒙古农业大学: 25-29.]
PAUL FK, JOSEPHINE YA, 2004. Bacterial diversity in aquatic and other environments: what 16s rdna libraries can tell us[J]. Fems Microbiol Ecol, 47(2): 161-177.
PETRIC I, PHILIPPOT L, ABBATE C, et al., 2011. Inter-laboratory evaluation of the ISO standard 11063 “Soil quality-method to directly extract DNA from soil samples” [J]. J Microbiol Method, 84(3): 454-460.
PENG L, YANG YF, HOU YM, et al., 2014.The biosafety assessment of introduced Pennisetum sp. in Fujian Province, China [J]. Fujian J Agric Sci, 29(11): 1132-1137. [彭露, 杨一帆, 侯有明, 等, 2014. 福建省引种巨菌草Pennisetum sp. 的生物安全性评价[J]. 福建农业学报, 29(11): 1132-1137.]
SHI W, 2011. Screening and resistance-analysis of microorganism in extreme saline-alkaline soil [D]. Harbin: Northeast Forestry University: 32-33. [石伟, 2011. 极端盐碱土壤细菌的分离筛选及抗盐特性研究[D]. 哈尔滨: 东北林业大学: 32-33.]
SUSAN MH, DAVID MW, HILARY GM, et al., 2010. Ironing out the wrinkles in therare biosphere through improved OTU clustering[J]. Environ Microbiol, 12(7): 1889-1898.
TANG J, DIAN ZY, WANG HL, et al., 2016. Assessment of soil fertility of continuous plantation of Cunninghamia lanceolata in main producing regions in Guangxi[J]. J For Environ, 36(1): 30-35. [唐健, 覃祚玉, 王会利, 等, 2016. 广西杉木主产区连栽杉木林地土壤肥力综合评价[J]. 森林与环境学报, 36(1): 30-35.]
TIAN Q, GAO DM, LI H, et al., 2020. Effects of wheat root exudates on the structure of fungi community in continuous cropping watermelon soil[J]. Chin Agric Sci, 53(5): 1018-1028. [田晴, 高丹美, 李慧, 等, 2020. 小麦根系分泌物对西瓜连作土壤真菌群落结构的影响[J]. 中国农业科学, 53(5): 1018-1028.]
TU SX, SUN JH, GUO ZF, et al., 2000. On relationship between root exudates and plant nutrition in rhizosphere [J]. Soil Environ Sci, 9(1): 64-67. [涂书新, 孙锦荷, 郭智芬, 等, 2000. 植物根系分泌物与根际营养关系评述[J]. 土壤与环境, 9(1): 64-67.]
WANG H, WANG G, HUANG YY, et al., 2008. Effects of pH changes on enzyme activities in acid soils [J]. Ecol Environ Sci, 17(6): 2401-2406. [王涵, 王果, 黃颖颖, 等, 2008. pH变化对酸性土壤酶活性的影响[J]. 生态环境, 17(6): 2401-2406.]
WANG JL, HAN NN, FENG WZ, et al., 2018. Summary of research on engineering technology and equipment for soda saline-alkali soil remediation in Northeast China[J]. Agric Technol, 38(23): 1-4. [王景立, 韩楠楠, 冯伟志, 等, 2018. 东北苏打盐碱地整治工程技术与装备研究综述[J]. 农业与技术, 38(23): 1-4.]
WU ZZ, MA M, ZHANG XL, et al., 2016. Effects of licorice on soil physical and chemical properties and soil enzyme activities in saline-alkali soils in Xinjiang[J]. J Agric, 6(6): 24-29. [吴振振, 马淼, 张旭龙, 2016. 甘草对新疆盐碱地土壤理化性质及土壤酶活性的影响[J]. 农学学报, 6(6): 24-29.]
XIE XC, ZHANG SH, WANG DS, et al., 2007. Eco-toxlcological effects of abamectin on vegetable-growing soil microorganisms and enzymes activity[J]. Acta Pedol Sin, 44(4): 740-743.
XUE D, YAO HY, HE ZL, et al., 2005. Relationships between red soil enzyme activity and fertility [J]. Chin J Appl Ecol, 16(8): 1455-1458. [薛冬, 姚槐应, 何振立, 等, 2005. 红壤酶活性与肥力的关系[J]. 应用生态学报, 16(8): 1455-1458.]
YAN CS, 1988. Soil fertility research methods [M]. Beijing: Agricultural Press: 234-286. [严昶升, 1988. 土壤肥力研究方法[M]. 北京: 农业出版社: 234-286.]
YAN LM, GUO XQ, 2017. Effects of salt-alkali stress on soil enzyme activities in the rhizosphere of Cinnamomum camphora seedlings [J]. Soils, 49(4): 733-737. [颜路明, 郭祥泉, 2017. 盐碱胁迫对香樟幼苗根际土壤酶活性的影响[J]. 土壤, 49(4): 733-737.]
YANG XJ, LIAO CY, LI XM, et al., 2013. Path analysis of soil enzyme activity and soil chemical properties of Pinus sylvestris forest in Yulin sandy area [J]. J Arid Land Resour Environ, 27(9): 109-112. [杨晓娟, 廖超英, 李晓明, 等, 2013. 榆林沙区樟子松林土壤酶活性与土壤化学性质的通径分析[J]. 干旱区资源与环境, 27(9): 109-112.]
YE WY, XIE XZ, XU YY, et al., 2020. High-throughput sequencing analysis of fungal community in rhizosphere soils of two plants formushroon cultivation (JUNCAO) [J]. Chin J Trop Crop, 41(3): 556-563. [葉文雨, 谢序泽, 许钰滢, 等, 2020. 基于高通量测序技术分析2种菌草根际土壤真菌群落多样性[J]. 热带作物学报, 41(3): 556-563.]
YOU YM,WANG J, HUANG XM, et al., 2014. Relating microbial community structure to functioning in forest soil organic carbon transformation and turnover[J]. Ecol Environ, 4(5): 1-15.
ZHANG PH, HOU XD, WANG J, 2017. Causes and amelioration measures of saline-alkali land in Xinjiang region [J]. Mod Agric Technol, 4(24): 178-180. [张鹏辉, 侯宪东, 王健, 2017. 新疆地区盐碱地成因及治理措施[J]. 现代农业科技, 4(24): 178-180.]
(责任编辑 周翠鸣)
收稿日期:2021-04-21
基金项目:国家自然科学基金(31500265);福建农林大学科技创新专项基金(CXZX2017566, CXZX2019140G) [Supported by National Natural Science Foundation of China (31500265); Special Fund for Science and Technology Innovation of Fujian Agriculture and Forestry University (CXZX2017566, CXZX2019140G)]。
第一作者: 严少娟(1994-),硕士研究生,研究方向为环境生物学,(Email)shaojuan3446@163.com。
通信作者:孙红英,博士,助理研究员,研究方向为环境生态学,(Email)shy198319@126.com。

