南亚热带常绿阔叶林冠层和林下层优势种叶功能性状响应异质生境的差异
孙鹏 韦霄 叶万辉 沈浩


摘 要:植物可以通過改变功能性状适应环境变化,不同类型的植物如何调整表型来适应环境一直是生态学研究的热点。为探究南亚热带森林不同生长型植物对异质生境的生态响应机制,该研究沿广东鼎湖山南亚热带常绿阔叶林20 hm2样地的3条山体选取不同海拔和凹凸度的27个样方(20 m × 20 m)中的5种优势树种(包括2种冠层树种和3种林下层树种),测定每株树的胸径及8种叶功能性状,包括4种结构性状(叶片厚度、长宽比、干物质含量和比叶面积)和4种化学计量性状(δ13C、δ5N、叶片氮含量和叶片磷含量),从叶功能性状角度对比分析两种生长型的优势树种响应海拔和凹凸度等异质生境的差异。结果表明:(1)各树种均存在若干叶功能性状与海拔呈现显著相关关系;在凹凸度方面,仅有厚壳桂的比叶面积与凹凸度呈现正相关,柏拉木的叶片氮含量与凹凸度呈现负相关。(2)比叶面积、叶片厚度与δ15N等性状更普遍地对海拔因素存在响应,而叶长宽比和叶干物质含量响应程度较低。(3)冠层与林下层优势种比叶面积、叶干物质含量和叶片氮含量在各类生境中均存在显著差异;相较冠层树种而言,林下层树种有着相对较低的叶片厚度、叶干物质含量和δ13C;冠层和林下层树种的叶功能性状对海拔和凹凸度的响应程度不同,林下层树种具有更多的功能性状在不同类型生境下存在显著差异。综上认为,鼎湖山南亚热带常绿阔叶林不同层片的优势树种(冠层和林下层优势树种)对异质生境的响应程度存在较大差异,表现在林下层树种在异质生境中表型更易随环境变化以适应更多样的环境条件,比叶面积、叶片厚度与δ15N等是指示南亚热带常绿阔叶林树种响应异质生境的重要且有效的性状。
关键词: 功能性状, 冠层树种, 林下层树种, 海拔梯度, 地形因素
中图分类号:Q948.15
文献标识码:A
文章编号:1000-3142(2022)03-0510-10
Differences in leaf functional trait responses to
heterogeneous habitats between dominant canopy and
understory tree species in a south subtropical
evergreen broad-leaved forest
SUN Peng1,3,4, WEI Xiao2, YE Wanhui1,3,4, SHEN Hao1,3,4*
( 1. Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystems, South China Botanical Garden, Chinese Academy of Sciences,
Guangzhou 510650, China; 2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin
541006, Guangxi, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458,
China; 4. School of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China )
Abstract:Plant species can adapt to heterogeneous habitats through variations in functional traits. For the plants with different growth forms, how to adjust their phenotypes to adapt to the environment has been one of the core topics in ecology. To clarify the response mechanisms of plant species with different growth forms to heterogeneous habitats in south subtropical forests, we measured a total of eight functional traits involving four structural traits (leaf thickness, leaf length/width ratio, leaf dry matter content and specific leaf area) and four stoichiometric traits (leaf nitrogen content, leaf phosphorus content, δ 13C and δ 15N) of five dominant trees (2 canopy species and 3 understory species) and their diameter at breast height, in 27 quadrats (20 m × 20 m) at different elevations and convexity along three mountain ridges within the 20 hm2 south subtropical evergreen broad-leaved forest plot at Dinghu Mountain in Guangdong Province. We analyzed and compared the differences in responses of the canopy and understory species to different elevations and convexity in terms of functional traits. The results were as follows: (1) There existed some leaf functional traits in each tree species that were significantly correlated with altitude, but for convexity, only the leaf area of Cryptocarya chinensis was positively correlated with convexity and the leaf nitrogen content of Blastus cochinchinensis was negatively correlated with convexity. (2) Specific leaf area, leaf thickness and δ 15N were generally more responsive to elevation, while leaf length/width ratio and leaf dry matter content were less responsive. (3) There were significant differences in specific leaf area, leaf dry matter content and leaf nitrogen content between canopy and understory tree species in heterogeneous habitats. Compared with canopy tree species, understory tree species had lower leaf thickness, leaf dry matter content and δ 13C. Moreover, canopy and understory species responded to elevation and convexity to different extents, with understory species having more functional traits with significant differences in different types of habitats. The results indicate that the degree of response to the environment varied greatly between plants with different growth forms, i.e., the dominant understory tree species had greater plasticity in the heterogeneous habitats than the dominant canopy species in the forest plot. In addition, specific leaf area, leaf thickness and δ 15N are important and effective traits indicating plant adaptation and responses to the environment in the south subtropical evergreen broad-leaved forest.
Key words: functional traits, canopy species, understory species, elevation gradient, topographical factors
全球多数生态系统均在经历不同程度的扰动,导致植物种群动态和分布区域发生持续改变(Parmesan, 2006;Zhou et al., 2013)。由于功能性状能够反映物种对环境的适应过程,从不同角度刻画物种生理和生态的信息,因此理解植物-环境关系的生理生态机制需要结合植物功能性状进行研究(Chapin, 2003;Wright et al., 2004;McGill et al., 2006)。然而,功能性状的可塑性以及时空变异还未得出一致性规律,植物在气候及环境改变下的适应机制仍然有待进一步探索(Anderson & Gezon, 2015)。一种典型的研究方式是利用山地的异质生境探索植物性状对不同类型生境的响应和适应。海拔梯度的变化会影响该区域的水、气、热和土壤等多个环境因子,温度、气压以及二氧化碳浓度等均会随海拔梯度升高而下降(Kao & Chang, 2001),而海拔和凹凸度升高会导致光照强度增加(Schindler, 2003;Enoki & Abe, 2004)。综合风化及土壤淋溶等因素,上述地形因子也同样影响了土壤水分和养分(Poorter et al., 2008;McEwan et al., 2011)。研究发现,在异质生境中,部分功能性状会在种群以及群落水平随着生境梯度发生各种响应性变化(Korner et al., 1988;Tsujino et al., 2006;Hernandez-Calderon et al., 2014)。结合海拔与凹凸度的功能性状研究可以为预测和递推环境变化下植物的适应过程提供分析样本(Korner, 2007)。随着动态植被模型日益被关注,使用植物功能性状数据能够提升生物圈模型对气候变化响应和反馈的预测(Sakschewski et al., 2015)。因此,探索功能性状对环境的响应机制非常重要。
近年来,越来越多的研究关注不同海拔和凹凸度条件下植物功能性状的变异并探索其响应机制(Rasmann et al., 2014;Read et al., 2014;周光霞等,2016;Midolo et al., 2019)。这些研究主要侧重于叶片结构、养分等功能性状,并从群落、种群以及个体等层次分析植物表型在不同凹凸度和海拔梯度下的适应策略。当环境随时间和空间变化时,物种的性状及生长策略也会随之发生变化(Moran, 1992;Alpert & Simms, 2002;Baythavong & Stanton, 2010)。诸多研究表明,不同类型的功能性状随海拔和凹凸度的响应规律有同有异。如植物比叶面积与海拔呈显著负相关(宝乐,2009;Baythavong & Stanton, 2010;李宏伟等,2012;Torres-Dowdall et al., 2012),叶片化学计量性状则在不同的研究中有不同的结论(陈昊轩等,2021)。生长在凹地的植物往往具有较大比叶面积并采取快速生长型策略,而不同凹凸度下生长的植物会有明显的水分利用效率差异(Garten & Taylor, 1992)。然而,目前很少有研究明确地依据层片将冠层与林下层树种划分并对比分析其性状沿环境梯度的差异性。层片是指沿群落垂直梯度的物种集合,这些物种具一定的生理生态相似性,且层片内的环境具一致性(Gleason, 1936)。冠层树种通常直接与外部环境相互作用,受到更强的降水冲淋、风压及光辐射(Akihiro et al., 2017),并且其较长输水路径更易受到干旱胁迫(Zhou et al., 2013)。相比冠层树种,林下层物种所处环境的光合有效辐射较少,因而需要更强的光捕获能力(Weerasinghe et al., 2014)。因此,不同生长型的树种很可能对异质环境的响应存在差异。特别是在人为干扰和气候变化背景下,林冠层会遭受更多的胁迫与生存压力(Ozanne et al., 2003)。已有研究报道部分森林生态系统发生了逆行演替(Zhou et al., 2013;Ibanez et al., 2017)。因此,针对不同层片树种对环境的响应规律开展对比研究,对于揭示森林群落垂直层次上的生态适应策略具有重要意义。
为了探究冠层和林下层树种对异质生境的响应和适应策略,本研究选取广东鼎湖山南亚热带常绿阔叶林20 hm2样地(以下简称鼎湖山大样地)的5个优势树种,包括2个冠层树种和3个林下层树种,测定其在高、中、低3个海拔梯度和山脊、山坡、山谷3种凹凸度条件下所有胸径≥1 cm的个体的胸径,以及8个叶功能性状(包括叶片厚度、长宽比、干物质含量和比叶面積4种形态结构性状和 δ 13C、 δ 15N、氮、磷含量4种化学计量性状),以探究以下科学问题:(1)植物功能性状是否对海拔和凹凸度因子存在响应?(2)如果存在响应,哪种功能性状更普遍地响应海拔和凹凸度因素?(3)冠层和林下层树种对海拔和凹凸度的适应是否存在差异?
1 材料与方法
1.1 研究区自然概况
鼎湖山大样地建立于2005年,位于广东省鼎湖山国家级自然保护区(23° 09′21″—23°11′30″ N,112° 30′39″—112°33′41″ E)。该区域年平均气温20.9 ℃,年平均降水量1 927 mm,年平均相对湿度85%(叶万辉等,2008)。鼎湖山大样地地形复杂,有3个山脊和4个山谷,海拔范围为230~470 m,地势起伏大,坡度范围为30°~50°(Wang et al., 2012)。该样地的森林有400余年自然生长历史。自2005年开始,每5 a对样地进行一次群落调查,记录胸径≥1 cm的个体的种名及坐标,测量胸径、冠幅及树高(Shen et al., 2014)。
1.2 样方设置及树种选择
在鼎湖山大样地内500个20 m × 20 m的样方中,根据相对海拔和凹凸度的变化,选取代表3种海拔和3种凹凸度生境的27个样方。具体来说,沿3条山体,在每个山体的3种海拔(包括低、中、高海拔; 范围为308.4 ~ 413.4 m, 最大相对海拔差105 m)和3种凹凸度类型(包括山脊、山坡和山谷,-6.16~6.71 m)分别选取9个样方,3个山体各生境类型分别选择Jaccard群落相似度指数最大的3个样方(周光霞等,2016)。
本研究选择冠层和林下层优势树种时遵循两方面原则:一方面,所选树种为上述27个样方内多度位于前列的冠层和林下层优势树种;另一方面,由于需要在不同生境条件下进行对比研究,故选择在全部6种地形类型下均存在且具一定多度的优势树种。经过筛选确定了以下5种优势树种为研究对象,即冠层树种中以锥栗(Castanopsis chinensis)和厚壳桂(Cryptocarya chinensis)作為代表树种;林下层以光叶山黄皮(Aidia canthioides)、黄果厚壳桂(Cryptocarya concinna)和柏拉木(Blastus cochinchinensis)作为代表树种。总体而言,各优势树种在各生境类型的3个样方之间分布较为均匀一致(表1)。
1.3 环境因子测定
本研究使用海拔和凹凸度作为环境因素。使用电子全站仪测量小样方4个角的高程,取平均值作为每个样方的高程(Legendre et al., 2009)。另外,使用克里金插值法计算每个树种坐标位置处的对应海拔高度,并使用全站仪得到高程信息计算样地的凹凸度,并将其划分为山脊、山坡和山谷。凹凸度的测量方法详见周光霞等(2016)。
1.4 功能性状测定
在上述27个样方中,测定了5种优势树种的叶功能性状(表1,表2)。在每个样方中,对于有10个以上个体的物种,随机选择10个个体进行胸径及叶功能性状的测量;对于个体数少于10的物种,测量所有个体的叶功能性状。采用碳纤维高枝剪(最大伸展高度14 m)剪取林冠中部外层枝条,随后从剪取的枝条上采集成熟、完整叶片进行后续分析。共采集1 058株树木个体。每株植物采集至少3个分枝和6片完全展开、成熟且向阳的叶片。采用叶面积仪测量叶片面积(LA, cm2)、叶片长度和宽度,并使用螺旋千分尺测量叶片厚度(mm); 称取叶片鲜重并将其置于70 ℃烘箱中至少72 h,重新称量获得叶片干重;比叶面积(SLA, cm2 ·g-1)为叶面积与干重的比值,叶干物质含量(LDMC)是叶片鲜重和干重的比值。以上测定方法详见周光霞等(2016)的方法。叶片氮含量(Nmass)用元素分析仪测定,叶片磷含量(Pmass)用钼电阻比色法测定(Shen et al., 2014)。
δ 13C和 δ 15N由质谱分析法得到的同位素比率测定。
1.5 数据分析
本研究中,所有数据分析均在python(版本3.6.11)(Sanner, 1999)程序中进行,在P<0.05时表示其具有统计学意义。其中,使用scipy包中的Pearson功能(Swami & Jain, 2013),通过线性回归分析海拔和凹凸度与各物种及两种生长型物种总体的关联性。使用scipy包中的Kruskal-Wallis功能(Kruskal & Wallis, 1952)检测不同组间是否存在统计学差异,在P<0.05时表示组间差异具有统计学意义,Z值越高表征组间差异越大。该方法不需数据满足方差齐性要求,也可在各组数目不同的情况下进行分析度量。
采用Pearson相关分析方法,分别对各物种的每个个体的功能性状及所处地域的海拔与凹凸度进行线性相关性检验;使用Kruskal-Wallis方法,分析每个物种在3种凹凸度类型下及3种海拔梯度下各功能性状的种内变异。将两种冠层树种与3种林下层树种合并后视作整体进行如前分析。分别再进行Pearson相关分析与Kruskal-Wallis组间差异性分析各功能性状在各层片内的变异。依据Kruskal-Wallis组间差异性分析,分析林冠层与林下层树种在6种不同类型生境中两种层片间的功能性状是否存在显著差异。值得指出的是,本研究的冠层优势树种与林下层优势树种的多度相差较大,采样数量也存在差异,故采用了允许组间样本数存在差异的Kruskal-Wallis方法进行组间差异性检验。
2 结果与分析
2.1 冠层和林下各优势树种叶功能性状种内变异及其对海拔和凹凸度的响应
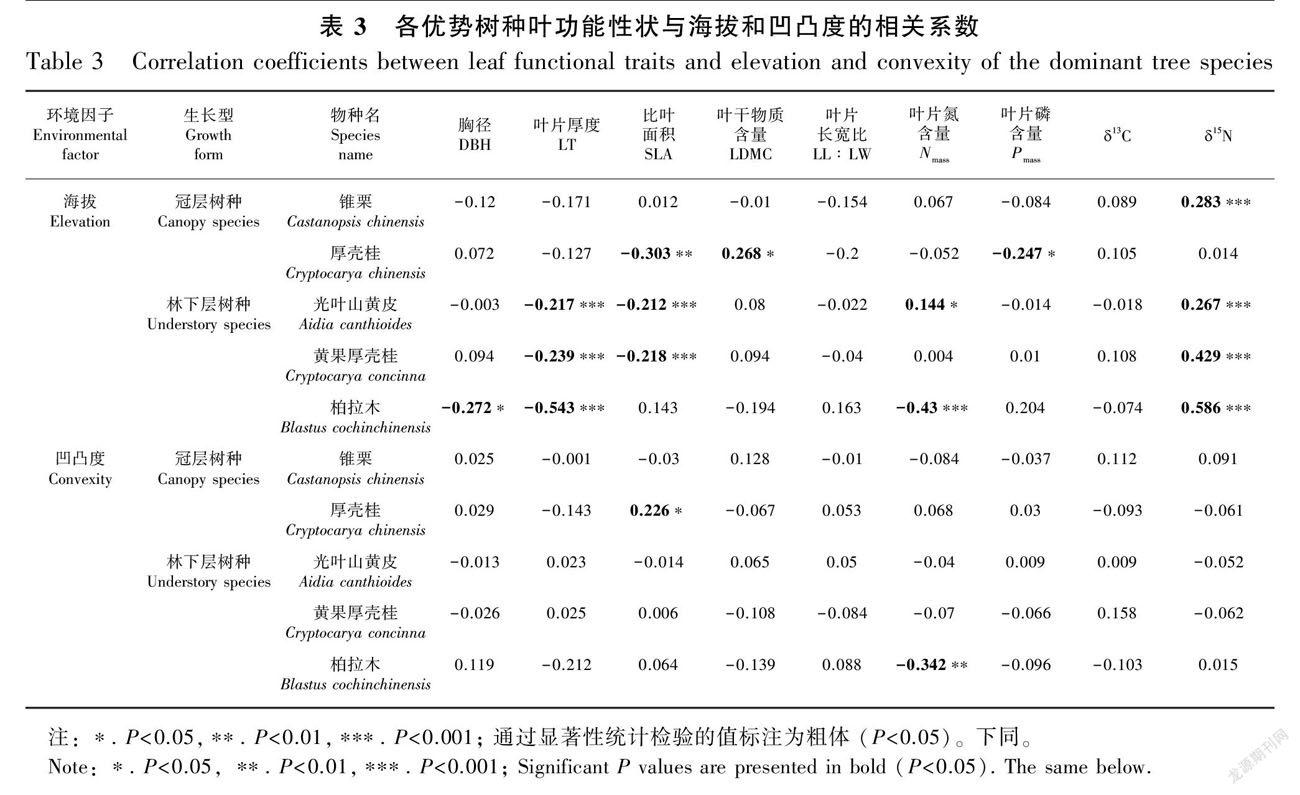
在海拔梯度方面,冠层树种中,锥栗叶片δ15N随海拔增加而显著增加;厚壳桂的比叶面积(SLA)和叶片磷含量(Pmass)与海拔显著负相关,叶干物质含量(LDMC)与海拔显著正相关。林下层树种中,3个树种的叶片厚度(LT)均随海拔升高而降低,δ15N随海拔增加而增加;光叶山黄皮和黄果厚壳桂的SLA随海拔升高而降低。此外,光叶山黄皮(正相关)和柏拉木(负相关)叶片氮含量(Nmass)与海拔关系的方向相反。在凹凸度方面,仅冠层树种厚壳桂的SLA与凹凸度正相关,林下层树种柏拉木的Nmass与凹凸度负相关,其他树种均无显著相关性(表3)。
2.2 冠层和林下层优势树种叶功能性状的层片内变异对海拔因子响应的差异
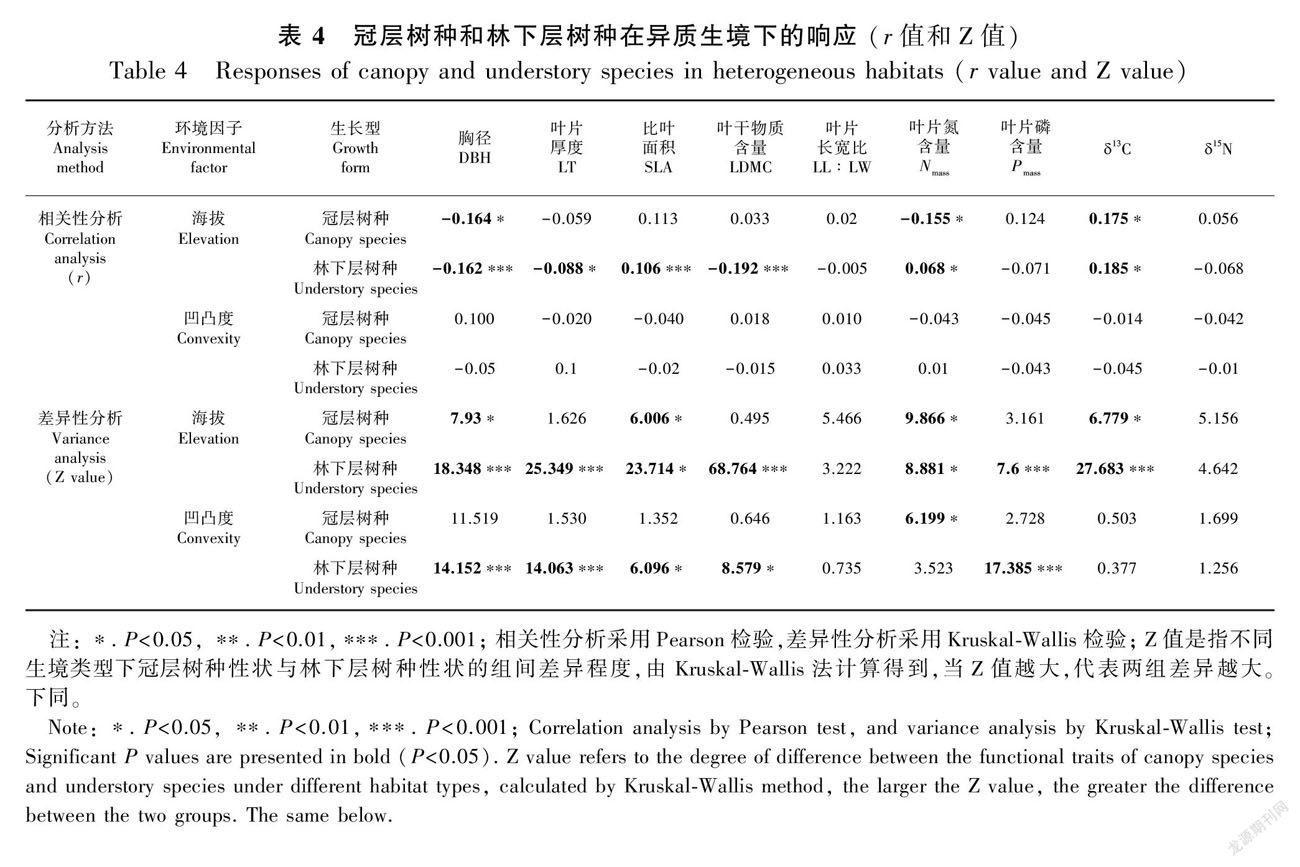
将两种生长型的物种合并后进行分析,就相关性分析而言,林下层树种相较于冠层树种有更多功能性状与海拔显著相关,其中DBH、LT、LDMC、Nmass和 δ 13C与海拔显著负相关,SLA和Pmass与海拔显著正相关;冠层树种仅DBH和Nmass与海拔显著负相关, δ 13C与海拔显著正相关。差异性分析表明,林下层树种的DBH、LT、SLA、LDMC和Pmass在各类凹凸度生境中均存在显著差异。林下层树种有更多性状在不同凹凸度及海拔等级间存在显著差异,包括DBH、LT、SLA、LDMC和Pmass;冠层树种仅Nmass在不同凹凸度生境间存在显著差异(表4)。
2.3 冠层及林下层优势树种叶功能性状在不同生境下的差异
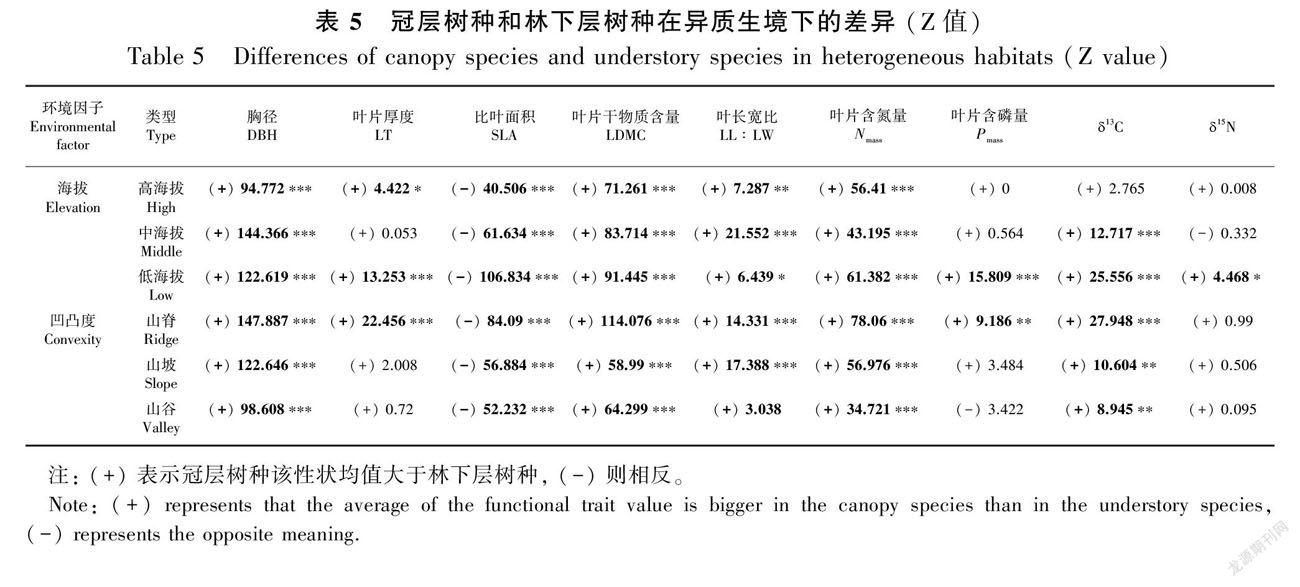
冠层树种和林下层树种的DBH、SLA、LDMC和Nmass在3种海拔和3种凹凸度生境中均存在显著差异。叶片长宽比(除山谷生境)和 δ 13C(除高海拔生境)在各环境梯度下均在冠层树种和林下层树种间存在显著差异,而叶片厚度、Pmass和 δ 15N性状仅在如低海拔等特定地形有相关性。就性状值大小而言,相较于林下层树种,冠层树种总体上具有更高的DBH、LT、LDMC、LL∶LW、Nmass、Pmass、δ13C和δ15N,及更低的SLA(表5)。
3 讨论与结论
3.1 叶功能性状对海拔和凹凸度的响应
本研究发现,多个优势树种的比叶面积(SLA)和叶片厚度(LT)均随海拔梯度升高而减小,这与前人研究结果一致(宝乐,2009;李宏伟等,2012)。海拔与土壤水含量、养分密切相关,体现在海拔较高处光照更强,这种海拔与叶结构性状的相关性即使在较小的海拔梯度中也被检测到。刘玉平等(2017)的研究发现,即使其样方只有70 m的海拔差异,由于土壤水分的分布差异性,不同生长型树种的比叶面积与海拔也均呈极显著负相关。随着相对海拔的升高,土壤水分及养分含量会逐渐减少,植物叶片的SLA减少且LT增加,使得叶片具有较高的次生代谢产物和更厚的细胞壁,以投资更多的资源防止水分丧失,从而适应环境的变化。Pfennigwerth等(2017)的研究也得出了类似规律,即SLA和LT对环境变化敏感,随温度、降水、光照强度等均会产生较大变异。
植物的δ15N可反映高温、干旱等环境特征,同时与植物的氮元素利用、吸收及水分利用效率密切相关(McLauchlan et al., 2006)。通常在高温和干燥的气候中植物有着较高的δ15N(Amundson et al., 2003;Craine et al., 2009)。锥栗、光叶山黄皮、黄果厚壳桂和柏拉木的δ15N均与海拔梯度显著相关,这与Anderson & Gezon(2015)的结论相似,在高海拔山区δ15N沿海拔梯度存在差异。产生这些现象的原因可能在于随海拔梯度增加,土壤养分利用降低,干旱胁迫加重。
在化学计量性状方面,仅厚壳桂的叶片磷含量(Pmass)与海拔显著负相关,而光叶山黄皮和黄果厚壳桂的叶片氮含量(Nmass)随海拔增加的变化趋势相反,其他物种的Nmass和Pmass随海拔的变化不显著。对于化学计量性状沿海拔的相关性,以往研究的结果并不一致。Van de Weg等(2009)的研究表明Nmass与海拔梯度显著的负相关,而也有研究结果表明Nmass与海拔无显著相关性(Fisher et al., 2013),这很可能意味着不同物种对N、P具有不同的响应机制,如相较于木本植物,草本植物倾向于有着更高的Nmass响应程度,这表征其有更强的资源获取能力(Midolo et al., 2019)。
本研究发现多个优势树种的LT、SLA与相对海拔呈显著正相关,与δ15N呈显著负相关,这些化学计量及叶形态结构性状相互佐证了植物功能性状随海拔的异质性分布很可能与水分、养分存在关联。这些相似的趋勢也体现了不同的物种对环境异质性上可能存在相似的响应方式(Poorter et al., 2009)。但是,优势树种的叶片氮、磷含量对海拔的响应并无一致性规律。此外,仅有厚壳桂的SLA和柏拉木的Nmass被发现与凹凸度存在显著相关关系,说明凹凸度与植物叶功能性状很可能更广泛地存在非线性关系。
3.2 冠层和林下层优势树种对环境适应策略的差异
本研究所选取的27个样方中的生境异质性较强,特别是随海拔及凹凸度变化的土壤水分及养分存在较大差异(周光霞等,2016)。胸径(DBH)、LT、SLA、叶干物质含量(LDMC)在各环境梯度下变化显著,能够较好地指示各层片随环境变化的表型响应过程。冠层和林下层树种的叶功能性状对海拔和凹凸度的响应程度存在显著差异。相较于冠层树种,林下层树种功能性状对海拔梯度的响应程度更高,并且在不同凹凸度生境下种内变异更大,原因可能在于林下层树种所处环境的资源异质性(尤其是光照)高于冠层树种,因而随环境的变化以较强的表型可塑性调整自身适应策略。Read等(2014)在一项Meta分析中发现,不同生活型植物对于环境变化存在不同的响应机制,其中被子植物SLA随海拔升高而降低,而针叶树则不随海拔发生显著变化。本研究进一步发现,林下种相较于冠层种对环境变化的反应比冠层种敏感。
耐阴叶片往往有较低的叶片长宽比,利于有效捕获光斑(Tsukaya, 2006)。本研究中,冠层树种相较于林下层树种有着较高的叶片长宽比,表明林下层树种叶片有着相对较高的耐阴性。这可能是由于林下层的光照被林冠层部分截获,因此在这种情形下,林下层优势树种发展出更有利于光捕获的性状以有效获取光合作用所需的光能条件。同时,冠层树种处于植物外层,直接与外部环境接触(Akihiro et al., 2017),而由于森林冠层可缓冲降水等冲淋压力(Storck et al., 2002),减轻光辐射、吸收并反射掉部分直射光,并维持冠层内部的湿度(Anhuf & Rollenbeck, 2001),因此林下层小气候环境与林冠外部通常存在差异。冠层树种的叶片具有较高的LDMC和较低的SLA,而林下种则在光照较弱、湿度较高的环境下,更倾向于提高光合效率。Kenzo等(2015)发现热带雨林的冠层树种有更低的比叶面积,更高的叶片氮含量和δ13C。Weerasinghe等(2014)和Ichie等(2016)也在热带雨林中发现了森林上层树种具更低的比叶面积。这些与本文针对南亚热带常绿阔叶林的研究结果一致。此外,就植物水力协调策略而言,相较林下层树种,冠层树种会通过提升δ13C和δ15N等与水分利用效率相关性状的表达,来提升其耐旱性及抗胁迫能力。因此,在光照、内外层环境以及水力的共同作用下,两种层片在不同生境类型中均表现出SLA、LDMC、 δ 13C等叶功能性状的差异,体现了对不同微环境的差异性适应策略。
Zhou等(2013)研究发现,冠层树种有着更高的水力运输成本,对水力传输安全也有着更高的要求以避免木质部栓塞。鼎湖山地区近年出现降水量季节分布不均匀的趋势,在年总降水量不变的情况下降水趋向于集中,即旱季更干,而湿季更湿,且深层土壤的含水率下降,导致干旱胁迫加剧(Zhou et al., 2011, 2013),这将致使冠层树种遭遇更大的胁迫风险。尽管本研究发现多个优势种的功能性状对海拔梯度带来的养分、水分差异存在相似的响应方式,但相较冠层树种,林下层树种的性状对不同海拔梯度和凹凸度类型响应更显著,显示出对环境变化更强的表型可塑性。在这种情形下,可塑性更强的植物可能有着更强的适应能力,能够在环境变化中维持种群规模,而可塑性较弱的物种可能倾向于种群衰退甚至存在灭绝风险。Zhou等(2013)发现鼎湖山森林群落近几十年来呈现出越来越多地由较小的个体和更多种类的矮乔木和灌木所占据的趋势。本研究发现冠层和林下层树种在异质生境中的表型可塑性差异,加之冠层与非冠层的环境差异,可能是解释这一现象的原因之一。
综上所述,本文从叶功能性状角度对比分析了南亚热带常绿阔叶林冠层和林下层优势树种对局域异质生境的响应策略。本研究结果表明,由于不同层片的优势树种对异质生境的响应程度存在较大差异,表现在林下层树种具有更多的功能性状在不同类型生境下存在显著差异,因此林下层树种在异质生境中通过更强的表型可塑性以适应更多样的环境条件。另外,由于比叶面积、叶片厚度与 δ 15N等叶功能性状更普遍地对海拔因素存在响应,因此它们是指示南亚热带常绿阔叶林树种响应环境的重要且有效的性状。
参考文献:
AKIHIRO N, ROGER L, KITCHING MC, et al., 2017. Forests and their canopies: achievements and horizons in canopy science[J]. Trend Ecol Evol, 32(6): 438-451.
ALPERT P, SIMMS EL, 2002. The relative advantages of plasticity and fixity in different environments: when is it good for a plant to adjust?[J]. Evol Ecol, 16(3): 285-297.
AMUNDSON R, AUSTIN AT, SCHUUR EAG, et al., 2003. Global patterns of the isotopic composition of soil and plant nitrogen[J]. Glob Biogeochem Cycle, 17(1): 1031.
ANDERSON JT, GEZON ZJ, 2015. Plasticity in functional traits in the context of climate change: a case study of the subalpine forb Boechera stricta (Brassicaceae)[J]. Glob Change Biol, 21(4): 1689-1703.
ANHUF D, ROLLENBECK R, 2001. Canopy structure of the Rio Surumoni rain forest (Venezuela) and its influence on microclimate[J]. Ecotropica, 7(1-2):21-32.
BAO L, 2009. Comparison and analysis of leaf functional traits among main forest communities and dominant species[D]. Beijing: Beijing Forestry University.[寶乐, 2009. 东灵山地区主要森林群落及其优势种叶功能性状比较与分析[D]. 北京: 北京林业大学.]
BAYTHAVONG BS, STANTON ML, 2010. Characterizing selection on phenotypic plasticity in response to natural environmental heterogeneity[J]. Evolution, 64(10): 2904-2920.
CHAPIN FS, 2003. Effects of plant traits on ecosystem and regional processes: a conceptual framework for predicting the consequences of global change[J]. Ann Bot, 91(4): 455-463.
CRAINE JM, ELMORE AJ, AIDAR MPM, et al., 2009. Global patterns of foliar nitrogen isotopes and their relationships with climate, mycorrhizal fungi, foliar nutrient concentrations, and nitrogen availability[J]. New Phytol, 183(4): 980-992.
CHEN HX, LIU XR, SUN TY, et al., 2011. Variation in leaf C∶N∶P stoichiometry of quercus species along the altitudinal gradient in Taibai mountain, China[J]. Acta Ecol Sin, 2021, 41(11):1-10. [陈昊轩, 刘欣蕊, 孙天雨, 等, 2011. 太白山栎属树种叶片碳氮磷化学计量特征沿海拔梯度的变化规律[J]. 生态学报, 41(11):1-10.]
ENOKI T, ABE A, 2004. Saplings distribution in relation to topography and canopy openness in an evergreen broad-leaved forest [J]. Plant Ecol, 173(2): 283-291.
FISHER JB, MALHI Y, TORRES IC,et al., 2013. Nutrient limitation in rainforests and cloud forests along a 3 000 m elevation gradient in the Peruvian Andes[J]. Oecologia, 172(3): 889-902.
GARTEN CT, TAYLOR GE, 1992. Foliar δ 13C within a temperate deciduous forest: spatial, temporal, and species sources of variation[J]. Oecologia, 90(1):1-7.
GLEASON HA, 1936. Is thesynusia an association?[J]. Ecology, 17(3):444-451.
HERNANDEZ-CALDERON E, MENDEZ-ALONZO R, MARTINEZ-CRUZ J, et al., 2014. Altitudinal changes in tree leaf and stem functional diversity in a semi-tropical mountain[J]. J Veg Sci, 25(4): 955-966.
IBANEZ T, HEQUET V, CHAMBREY C, et al., 2017. How does forest fragmentation affect tree communities? A critical case study in the biodiversity hotspot of New Caledonia[J]. Landscape Ecol, 32: 1671-1687.
ICHIE T, INOUE Y, TAKAHASHI N, et al., 2016. Ecological distribution of leaf stomata and trichomes among tree species in a Malaysian lowland tropical rain forest[J]. J Plant Res, 129(4): 625-635.
KAO WY, CHANG KW, 2001. Altitudinal trends in photosynthetic rate and leaf characteristics of Miscanthus populations from central Taiwan[J]. Aust J Bot, 49(4): 509-514.
KENZO T, INOUE Y, YOSHIMURA M, et al., 2015. Height-related changes in leaf photosynthetic traits in diverse Bornean tropical rain forest trees[J]. Oecologia, 177(1): 191-202.
KORNER C, 2007. The use of ‘altitude’ in ecological research[J]. Trend Ecol Evol, 22(11): 569-574.
KORNER C, FARQUHAR GD, ROKSANDIC Z, 1988. A global survey of carbon isotope discrimination in plants from high-altitude[J]. Oecologia, 74(4): 623-632.
KRUSKAL WH, WALLIS WW, 1952. Use of ranks in one-criterion variance analysis[J]. J Am Stat Assoc, 47(260): 583-621.
LEGENDRE P, MI X, REN H, et al., 2009. Partitioning beta diversity in a subtropical broad-leaved forest of China[J]. Ecology, 90(3): 663-674.
LI HW, WANG XA, GUO H,et al., 2012. Leaf functional traits of different forest communities in Ziwuling Mountains of Loess Plateau[J]. Chin J Ecol, 31(3): 544-550.[李宏偉, 王孝安, 郭华, 等, 2012. 黄土高原子午岭不同森林群落叶功能性状[J]. 生态学杂志, 31(3): 544-550.]
LIU YP, LIU GF, BAIYILA DF,et al., 2017. Effects of topographic factors on leaf traits of dominant species in different forest communities in Daqinggou nature reserves[J]. Sci Silv Sin, 53(3): 154-162. [刘玉平, 刘贵峰, 达福白乙拉, 等, 2017. 地形因子对大青沟自然保护区不同森林群落叶性状的影响[J]. 林业科学, 53(3): 154-162.]
MCEWAN RW, LIN YC, SUN IF,et al., 2011. Topographic and biotic regulation of aboveground carbon storage in subtropical broad-leaved forests of Taiwan[J]. For Ecol Manag, 262(9): 1817-1825.
MCGILL BJ, ENQUIST BJ, WEIHER E,et al., 2006. Rebuilding community ecology from functional traits[J]. Trend Ecol Evol, 21(4): 178-185.
MCLAUCHLAN KK, HOBBIE SE, POST WM, 2006. Conversion from agriculture to grassland builds soil organic matter on decadal timescales[J]. Ecol Appl, 16(1): 143-153.
MIDOLO G, DE FRENNE P, HOLZEL N,et al., 2019. Global patterns of intraspecific leaf trait responses to elevation[J]. Glob Chang Biol, 25(7): 2485-2498.
MORAN NA, 1992. Theevolutionary maintenance of alternative phenotypes[J]. Am Nat, 139(5): 971-989.
OZANNE CMP, ANHUF D, BOULTER SL, et al., 2003. Biodiversity meets the atmosphere: A global view of forest canopies[J]. Science, 301(5630):183-186.
PARMESAN C, 2006. Ecological and evolutionary responses to recent climate change[J]. Annu Rev Ecol Evol Syst, 37(1): 637-669.
PFENNIGWERTH AA, BAILEY JK, SCHWEITZER JA, 2017. Trait variation along elevation gradients in a dominant woody shrub is population-specific and driven by plasticity[J]. Aob Plants, 9(4): plx027.
POORTER H, NIINEMETS U, POORTER L,et al., 2009. Causes and consequences of variation in leaf mass per area (LMA): A meta-analysis[J]. New Phytol, 182(3): 565-88.
POORTER L, WRIGHT SJ, PAZ H,et al., 2008. Are functional traits good predictors of demographic rates? Evidence from five neotropical forests[J]. Ecology, 89(7): 1908-1920.
RASMANN S, BURI A, GALLOT-LAVALLEE M,et al., 2014. Differential allocation and deployment of direct and indirect defences by Vicia sepium along elevation gradients[J]. J Ecol, 102(4): 930-938.
READ QD, MOORHEAD LC, SWENSON NG,et al., 2014. Convergent effects of elevation on functional leaf traits within and among species[J]. Funct Ecol, 28(1): 37-45.
SANNER MF, 1999. Python: a programming language for software integration and development[J]. J Mol Graph Model, 17(1): 57-61.
SAKSCHEWSKI B, VON BLOH W, BOIT A, et al., 2015. Leaf and stem economics spectra drive diversity of functional plant traits in a dynamic global vegetation model[J]. Glob Change Biol, 21(7): 2711-2725.
SCHINDLER DW, 2003. Ecological stoichiometry: The biology of elements from molecules to the biosphere[J]. Nature, 423(6937): 225-226.
SHEN Y, SANTIAGO LS, SHEN H, et al., 2014. Determinants of change in subtropical tree diameter growth with ontogenetic stage[J]. Oecologia, 175(4): 1315-1324.
STORCK P, LETTENMAIER DP, BOLTON SM, et al., 2002. Measurement of snow interception and canopy effects on snow accumulation and melt in a mountainous maritime climate, Oregon, United States[J]. Water Resour Res, 38(11): 1223.
SWAMI A, JAIN R, 2013. Scikit-learn: Machine learning in Python[J]. J Mach Learn Res, 12(10): 2825-2830.
TORRES-DOWDALL J, HANDELSMAN CA, REZNICK DN, et al., 2012. Local adaptation and the evolution of phenotypic plasticity in Trinidadian guppies (Poecilia reticulata)[J]. Evolution, 66(11): 3432-3443.
TSUJINO R, TAKAFUMI H, AGETSUMA N,et al., 2006. Variation in tree growth, mortality and recruitment among topographic positions in a warm temperate forest[J]. J Veg Sci, 17(3): 281-290.
TSUKAYA H, 2006. Mechanism of leaf-shape determination[J]. Ann Rev Plant Biol, 57: 477-496.
VAN DE WEG MJ, MEIR P, GRACE J, et al., 2009. Altitudinal variation in leaf mass per unit area, leaf tissue density and foliar nitrogen and phosphorus content along an Amazon-Andes gradient in Peru[J]. Plant Ecol Divers, 2(3): 243-254.
WANG ZF, LIAN JY, HUANG GM,et al., 2012. Genetic groups in the common plant species Castanopsis chinensis and their associations with topographic habitats[J]. Oikos, 121(12): 2044-2051.
WEERASINGHE LK, CREEK D, CROUS KY, et al., 2014. Canopy position affects the relationships between leaf respiration and associated traits in a tropical rainforest in Far North Queensland[J] Tree Physiol, 34(6): 564-584.
WRIGHT IJ, REICH PB, WESTOBY M,et al., 2004. The worldwide leaf economics spectrum[J]. Nature, 428(6985): 821-827.
YE WH, CAO HL, HUANG ZL,et al., 2008. Community structure of a 20 hm2 lower subtropical evergreen broadleaved forest plot in Dinghushan, China[J]. J Plant Ecol (Chin Ver), 32(2): 274-286. [叶万辉, 曹洪麟, 黄忠良, 等, 2008. 鼎湖山南亞热带常绿阔叶林20公顷样地群落特征研究[J]. 植物生态学报, 32(2): 274-286.]
ZHOU GX, HUANG LX, ZANG XW, et al., 2016. Effects of habitat heterogeneity on community functional diversity of Dinghu Mountain evergreen broad-leaved forest[J]. Guihaia, 36(2): 127-136. [周光霞, 黄立新, 臧晓蔚, 等, 2016. 生境异质性对鼎湖山常绿阔叶林群落功能多样性的影响[J]. 广西植物, 36(2): 127-136.]
ZHOU GY, PENG CH, LI YL, et al., 2013. A climate change-induced threat to the ecological resilience of a subtropical monsoon evergreen broad-leaved forest in Southern China[J]. Glob Change Biol, 19(4): 1197-1210.
ZHOU GY, WEI XH, WU YP, et al., 2011. Quantifying the hydrological responses to climate change in an intact forested small watershed in Southern China[J]. Glob Change Biol, 17(12): 3736-3746.
(责任编辑 蒋巧媛)
收稿日期:2021-05-15
基金项目:国家自然科学基金(31370446);南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0408);广东省林业科技创新项目(2017KJCX036, 2019KJCX015);广东省科技计划项目(2017A020217001)[Supported by National Natural Science Foundation of China (31370446); Key Special Project for Introduced Talents Team of Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou) (GML2019ZD0408); Guangdong Forestry Science and Technology Innovation Project (2017KJCX036, 2019KJCX015); Science and Technology Planning Project of Guangdong Province, China (2017A020217001)]。
第一作者: 孙鹏 (1995-),硕士,主要从事保护生态学研究,(E-mail)sunpeng18@mails.ucas.ac.cn。
通信作者:沈浩,博士,副研究员,主要从事保护生态学和植物生理生态学研究,(E-mail)shenhao@scbg.ac.cn。

