不同处置方式对菊芋多糖分子量及活性的影响
何曙光,袁平川,周凌云,汤 琳,汪 瑞,陈靠山
(皖南医学院 1.药学院,安徽 芜湖 241002;2.安徽省多糖药物工程技术研究中心,安徽 芜湖 241002)
菊芋俗称洋姜,原产于北美洲,现在我国广泛栽培,食用部位为其块茎,目前亩产可高达4 000~15 000 kg,其鲜品中菊糖含量约占10%~20%,是生产菊糖的主要原料[1]。菊芋块茎中富含菊糖、矿物质、维生素,且低脂肪低热量,在食品、医药、饲料等领域具有特殊价值[2]。研究发现,菊糖具有清除氧自由基减少氧化损伤的作用[5],长期服用菊糖可改善人的血脂和血糖水平[3];同时菊糖具有益生素和双歧因子作用,可促进肠道中双歧杆菌的生长,调节肠道菌群,增强免疫力,降低胃肠疾病及肠癌的发病风险[4]。据报道,菊芋块茎在收获后及室温下储存后极易发生重量减轻和变质,主要表现为菊糖含量下降,还原糖增加[6]。本研究考察菊芋在不同处置方式下菊芋多糖的分子量变化以及生物活性影响,以期为菊芋进一步开发提供参考和指导。
1 材料与试剂
菊芋产自陕西省渭南市华州区金堆镇,经皖南医学院药学院生药学教研室鉴定为菊科植物菊芋新鲜块茎。葡聚糖标准品10 000、5 000、3 500、1 500、1 000 ku为色谱纯,购自美国Sigma-Aldrich公司;DEAE-52纤维素、SuperdexG-75凝胶购自北京索莱宝科技有限公司;抗坏血酸、1 000 ku透析袋购自上海源叶生物科技有限公司;羟自由基测试试剂盒购自南京建成生物研究所;胎牛血清、1%青霉素/链霉素和DMEM和1640培养基购自美国Gibco公司。其他试剂均购自国药,均为分析纯。
2 方法与结果
2.1 方法
2.1.1 实验材料分组及处理 所有菊芋均产自同一块田地。每组提取如下:①10月中旬应季正常采收,作为正常采收组(ZCCS);②应季采收后,用烘干后的干沙掩埋,装箱密封,在4℃条件下保存至次年3月,作为砂藏组(SC);③延迟至第2年3月发芽前采收样品,为延迟采收组(YCCS)。
2.1.2 菊芋多糖的提取 取各组处置后的新鲜样品,经过洗净、切片、烘干(60℃)、粉碎、过筛,得菊芋干粉,备用。各组同时提取,其流程如图1[7-8]。
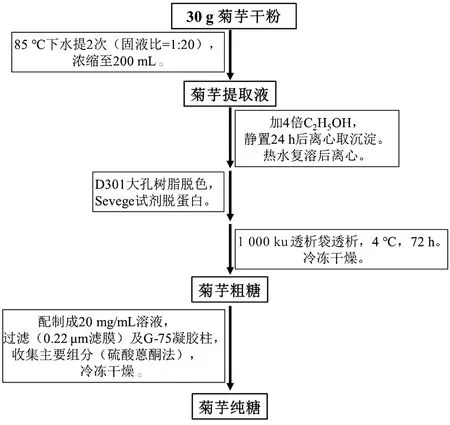
图1 菊芋多糖的提取流程图
2.1.3 分子量测定 采用高效凝胶过滤色谱法(HPSEC)检测多糖的分子量。色谱分析条件:示差折光检测器;色谱柱:TSKgel G3000PW(7.8 mm×300 mm);进样量:20 μL;流动相为超纯水,流速为0.7 mL/min;柱温箱及检测池温度40℃。
精密称取样品和各葡聚糖标准品,分别配制成5 mg/mL溶液,0.22 μm的微孔滤膜过滤,然后将样品转置于1.5 mL EP管中等待进样[9]。
2.1.4 羟自由基清除实验 本研究采用Fenton反应考察多糖对OH·的清除作用。在进行正式检测之前需要进行预实验,从每组中取几个样本,确定最佳浓度和最佳取样量;本实验采用羟基自由基测定试剂盒,利用Griess试剂与体系中羟基自由基发生显色反应,测定显色物质的吸光值。样品溶液用超纯水配制成8个不同的梯度浓度,以等体积超纯水代替多糖样品溶液测定空白对照组吸光值,以等体积超纯水代替工作液测定样品本底吸光值(实验重复3次,每次共5个平行管)。在550 nm处测定吸光值,计算OH·的清除活性,公式如下[10]:
抑制率=[1-(As-A0)/Ac]×100%,其中As为样品组吸光值,A0样品本底吸光值,Ac为空白对照组吸光值。
2.1.5 CCK-8检测小鼠结肠癌细胞CT26的抑制实验 培养CT26细胞到对数期。将多糖溶于RPMI-1640培养基中,配置成不同浓度(0、0.05、0.1、0.2、0.4、0.8、1.6 mg/mL)留存。将均匀悬浮的CT26细胞接种于密度为5×103细胞/孔(每孔100 μL)的96孔板中,孵育24 h,待细胞贴壁后,将培养基吸出,每孔加入配置好的不同浓度的多糖培养基100 μL,每个浓度设5个平行孔,各组加样后孵育24 h(以等体积培养基代替多糖样品溶液测定空白组)。在各孔分别加入10 μL的CCK-8溶液,继续孵育4 h后。使用全自动酶标仪在450 nm处测量溶液的吸光度[11](实验重复3次)。计算公式如下:
抑制率=(OD空白-OD样品)/OD空白×100%,其中OD样品和OD对照分别是各浓度多糖组和空白组的吸光度。
2.1.6 CCK-8检测巨噬细胞RAW264.7增殖实验 培养264.7细胞到对数期。将多糖溶于DMEM培养基中,并提前配置成各种浓度(0、0.05、0.1、0.2、0.4、0.8、1.6 mg/mL)留存。将悬浮均匀的对数期RAW264.7细胞接种于密度为5×103个细胞/孔(每孔100 μL)的96孔板中,孵育24 h,待细胞贴壁后吸出培养基,每孔加入不同浓度的多糖培养基100 μL,每个浓度设5个平行孔,各组加样后孵育24 h(以等体积培养基代替多糖样品溶液测定空白组)。接着在每孔加入10 μL的CCK-8溶液,孵育4 h后[12],使用全自动酶标仪在450 nm处测量溶液的吸光度(实验重复3次)。计算公式如下:
相对增殖率=(OD样品-OD空白)/OD空白×100%,其中OD样品和OD对照分别是各浓度多糖组和空白组的吸光度。

2.2 结果
2.2.1 处置方式对多糖分子量的影响 经液相检测可知:ZCCS组菊芋多糖保留时间为12.441 min,SC组为12.576 min,YCCS组为12.715 min。YCCS组菊糖分子量相对较小,ZCCS、SC两组多糖分子量无明显差异(图2)。SC组多糖分子量分布较广,ZCCS组和C组分子量分布较集中(表1)。
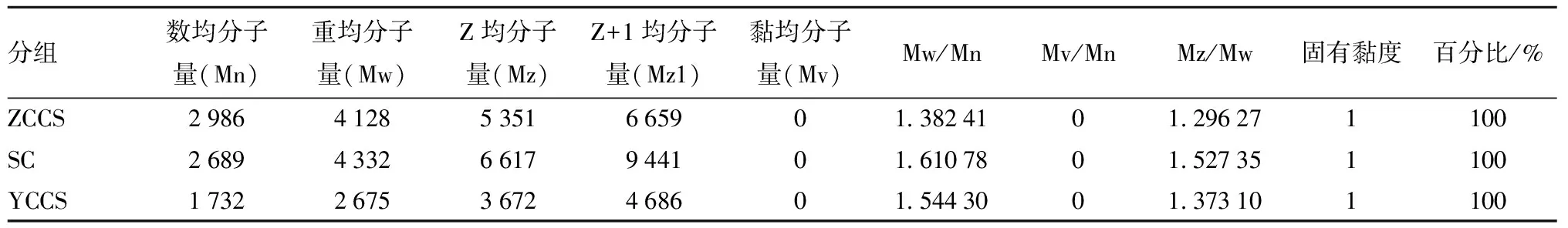
表1 各组菊芋多糖分子质量对照表
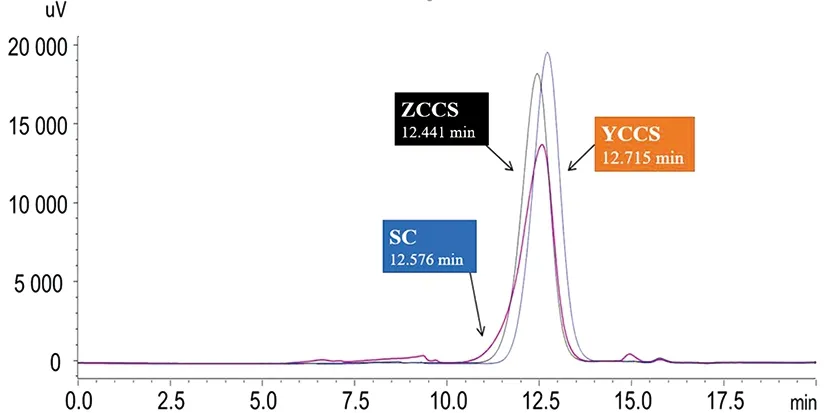
图2 3种处置方式后菊芋多糖液相色谱分析
2.2.2 不同处置方式所得菊芋多糖对OH·清除作用 ZCCS、SC、YCCS 3组多糖在8 mg/mL浓度时对OH·清除率分别为50.89%、27.82%和49.56%,且3组多糖在实验浓度为5 mg/mL与8 mg/mL时两两比较,ZCCS组和YCCS组多糖对OH·均具有较强的清除能力,SC组多糖的清除能力相对较弱,差异有统计学意义(P<0.001)(图3A)。
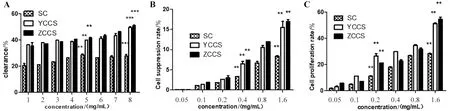
A.菊芋多糖对OH·自由基清除率菊芋多糖对CT26细胞的抑制率菊芋多糖作用RAW264.7细胞的增殖率代表两两比较均有统计学意义。
2.2.3 对小鼠结肠癌细胞CT26的抑制效果 小鼠结肠癌细胞CT26的抑制实验表明(图3B),当3组多糖样品浓度为1.6 mg/mL时,3组菊芋多糖对CT26细胞的抑制率分别15.44%、8.32%和16.89%,且在样品浓度为0.4 mg/mL和1.6 mg/mL时,3组两两比较差异有统计学意义;此时活性强弱顺序为ZCCS>YCCS>SC,差异有统计学意义(P<0.01)。本实验所用的3组多糖对CT26细胞都有一定抑制作用,其中SC组多糖在抗肿瘤方面的活性相对薄弱。
2.2.4 对巨噬细胞RAW264.7增殖作用 巨噬细胞RAW264.7增殖作用实验表明(图3C),3组多糖浓度为1.6 mg/mL时,3组多糖对巨噬细胞RAW264.7的增殖率分别54.54%、28.32%和51.23%,且在样品浓度为0.2 mg/mL和1.6 mg/mL时,3组两两比较差异有统计学意义;此时活性强弱顺序为ZCCS>YCCS>SC,差异有统计学意义(P<0.01)。3组菊芋多糖中,SC组多糖增殖作用相对较弱。
3 讨论
菊糖具有抗氧化,改善血脂和调节血糖的功效,同时还可以调节肠道菌群,增强免疫力,降低胃肠疾病及肠癌的发病风险[3-5]。本研究通过3种处置方法得到不同的菊芋多糖并分析了3组多糖的分子量和生物活性的差异。实验结果表明:3组菊芋多糖分子量有明显差异,其中SC组分子量分布较广,ZCCS组和YCCS组分子量分布集中。菊芋多糖具有独特的分子量范围,其聚合度2~100,菊芋多糖的长度、组成和分散性取决于收获时间、提取前处理和提取后过程,且活性最好的多糖是富含聚合度<30的菊芋多糖[9]。抗氧化活性方面,SC组相比另两组多糖活性较弱。OH·清除能力与抗氧化物质供电子能力相关[13],由于3种多糖都是菊芋多糖,所以SC组多糖清除能力下降可能是由于在处置过程中消耗了自身一部分有供电能力的多糖。3组多糖均具有一定的抑制肿瘤细胞活性,其中SC组多糖活性较弱。目前,多糖的抑制肿瘤生长作用已经被很多的研究者证实,主要机理有:①口服多糖大大减少肿瘤的发生率;②部分种类多糖可以直接诱导肿瘤细胞凋亡,从而达到抗癌的作用;③增强免疫力,加强巨噬细胞对癌细胞的吞噬作用;④直接抑制肿瘤的转移扩散[14]。3组多糖的巨噬细胞增殖活性也出现了SC组较弱的现象。巨噬细胞属免疫细胞,其主要功能是以固定细胞或游离细胞的形式对细胞残片及病原体进行噬菌作用,并激活淋巴球或其他免疫细胞,令其对病原体作出反应,在机体免疫过程中起至关重要的作用[12]。由于菊芋块茎在收获后及室温下储存后菊糖含量下降,还原糖增加[6]。结合实验结果,菊糖会随着储存过程品质会逐渐下降,这对于菊芋块茎的储存和加工起着关键的指导意义。
本实验结果证明,在经过不同处置方式之后可以得到不同分子量、不同聚合度以及活性强弱不同的菊芋多糖。这与特定聚合度的多糖含量有关。在处置过程中SC组菊芋消耗了自身的多糖,导致其活性出现了下降,虽然多糖分子量只降低了一点,但是其多糖分子量分布变广,抗氧化、抑制肿瘤以及免疫活性的降低,说明了菊芋内部多糖聚合度发生了变化,即特定聚合度的多糖含量下降;在延迟采收过程中,菊芋自身的消耗可以从土壤中吸取,但其多糖分子量的减少,以及活性的略微降低,也在提醒着我们菊芋内部多糖聚合度发生了微量的变化。
通过不同处置方法得到不同活性的多糖对提高菊芋多糖生物活性具有重要指导意义。目前菊芋多糖生物活性与分子量及多糖聚合度的关系研究较少,由以往报道可知[8-9,15],菊芋多糖的生物活性与特定聚合度的多糖有关。本实验为进一步深入研究菊芋多糖的化学结构、含量、各聚合度的比例及生物学功能提供了参考,也为研究菊芋多糖与药理活性的构效关系提供了研究思路。

