色素上皮衍生因子对子宫肌瘤平滑肌细胞增殖和分化的影响
吴 娟,姜 珏,王志芳,刘瑾华,吴金萍,李妙妮,杨丽娜*
(1兵器工业五二一医院妇科,西安 710065;2西安交通大学第二附属医院超声科;*通讯作者,E-mail:ylina258@126.com)
子宫肌瘤是成年女性最常见的良性肿瘤,可通过多种方式扰乱子宫功能,可能导致子宫大出血、贫血、不孕、胚胎植入缺陷、早产、产程梗阻、尿失禁等[1]。子宫肌瘤的致病原因与雌激素异常分泌有关,雌激素主要通过两种不同的雌激素受体ERα和ERβ来调节靶基因表达[2]。许多研究证实,子宫肌瘤中ERα和ERβ的表达量远高于正常组织,并且可导致子宫肌瘤细胞过度增殖[2]。此外,雌激素可上调多种血管生成因子的表达[3],血管生成平衡受损是导致肌瘤形成的原因之一[4]。色素上皮衍生因子(PEDF,SERPINF1)是一种50 kD的酸性糖蛋白,它最初被描述为一种神经营养因子和有效的抗血管生成因子[5,6]。PEDF是内皮细胞中VEGF-R2血管生成信号的内源性抑制剂,通过降低其关键的促有丝分裂受体VEGF-R2的VEGF-A活性,部分阻止新生血管的生长[7]。后来的研究证实PEDF是一种多功能蛋白质,还具有抗炎和抗氧化特性[8,9]。最近,有文献报道称在子宫肌瘤细胞系培养液中加入重组PEDF可下调血管内皮生长因子(VEGF)以及ERα和ERα的表达,并抑制细胞增殖;重组PEDF可在体内降低小鼠肌瘤的生长速度[10]。虽然前人研究发现PEDF与子宫肌瘤的形成有关,然而,确切的分子机制尚不清楚。因此,本研究拟探讨PEDF对子宫肌瘤中子宫平滑肌细胞增殖和分化的影响,旨在进一步揭示子宫肌瘤的发生机制,并为开发新的治疗方案提供基础。
1 材料与方法
1.1 材料与试剂
DMEM/F12培养基购自美国GIBCO公司。Lipofectamine 2000、Trizol试剂购自美国Invitrogen公司。细胞计数试剂盒8(CCK-8)溶液购自美国Sigma公司。EdU Apollo 567、DAPI购自美国Sigma-Aldrich公司。一步法TUNEL细胞凋亡检测试剂盒、增强化学发光(ECL)试剂、裂解缓冲液碧云天生物技术研究所。M-MLV逆转录酶购自美国Promega公司。SYBR Green Real time PCR Master Mix购自日本Takara公司。PEDF、ERα、ERβ、SM22α、α-SMA、Bcl-2、cleaved Caspase-3、PI3K、total-AKT、p-AKT、β-actin、辣根过氧化物酶标记的山羊抗兔IgG二抗、FITC标记的羊抗兔二抗购自美国Santa Cruz Biotechnology公司。
1.2 组织收集、细胞培养及形态观察
为了考察PEDF在子宫肌瘤组织和正常子宫肌层组织中的表达差异,收集我院接受子宫肌瘤切除术的30例患者的子宫肌瘤组织(子宫肌瘤组织组)以及邻近正常子宫肌层组织(正常子宫肌层组织组),患者年龄在39~52岁之间。患者纳入标准:①组织学诊断为子宫肌瘤;②术前3个月无服雌孕激素史;③无子宫内膜病变及肌瘤变性;④患者无免疫系统疾病、心脑血管系统疾病、器官病变及其他严重疾病;⑤患者知情同意。排除标准:①合并子宫颈及子宫内膜恶性病变、肌瘤变性的患者;②近期有抗生素、激素等药物使用史的患者;③合并其他严重疾病的患者。通过Western blot和qRT-PCR检测子宫肌瘤组织以及邻近正常子宫肌层组织中的PEDF蛋白和mRNA水平。
将组织切成小块并在37 ℃下用0.15%胶原酶消化2~3 h。然后加入预冷的胎牛血清(FBS)5 ml,在4 ℃以1 500 r/min离心10 min,收集平滑肌瘤细胞并用磷酸盐缓冲盐水(PBS)洗涤3次。弃去上清液并收集沉淀细胞。将细胞在添加有20% FBS的DMEM/F12培养基中于37 ℃、5% CO2条件下传代培养48 h。然后使用平滑肌细胞标记物(α-SMA)通过免疫荧光鉴定选择的细胞是否是平滑肌细胞。将鉴定的子宫肌瘤平滑肌细胞用于后续实验。本研究通过兵器工业五二一医院伦理委员会的批准(审批号:兵工521伦审[2019]12号]),参与本研究的患者均签署知情同意书。
通过SM22α免疫荧光染色观察子宫肌层平滑肌细胞和子宫肌瘤平滑肌细胞形态。将玻片放入6孔板中,然后加入1×104个子宫肌层平滑肌细胞(子宫肌层平滑肌细胞组)或子宫肌瘤平滑肌细胞(子宫肌瘤平滑肌细胞组)培养48 h,取出爬片,PBS洗涤,4%多聚甲醛室温固定30 min,0.1% Triton X-100渗透2 min。PBS洗涤,胎牛血清封闭30 min,然后滴加SM22α一抗并在4 ℃孵育过夜,然后与FITC标记的羊抗兔二抗在37 ℃孵育30 min,用DAPI对细胞核进行染色,并在倒置荧光显微镜下观察。实验重复3次。
1.3 细胞转染及分组处理
委托上海吉玛制药技术有限公司合成靶向PEDF基因序列的短发夹RNA(shRNA-PEDF,PEDF抑制剂)和阴性对照shRNA(shRNA-NC)以及过表达PEDF的重组慢病毒(PEDF-pLenti6.3,PEDF激动剂)和阴性对照慢病毒(pLenti6.3-NC)。细胞共分为以下5组:对照组、pLenti6.3-NC组、PEDF-pLenti6.3组、shRNA-NC组、shRNA-PEDF组。然后进行后续检测。对照组细胞不进行转染,pLenti6.3-NC组转染pLenti6.3-NC,PEDF-pLenti6.3组转染PEDF-pLenti6.3,shRNA-NC组转染shRNA-NC,shRNA-PEDF组转染shRNA-PEDF。使用Lipofectamine 2000对子宫肌瘤平滑肌细胞进行转染。转染48 h后收集细胞用于后续实验,为了考察PEDF对子宫肌瘤平滑肌细胞增殖、凋亡、分化和PI3K/AKT信号通路的影响,通过细胞计数试剂盒8(CCK-8)测定细胞活力,EdU染色试剂盒检测细胞增殖,TUNEL染色检测细胞凋亡,qRT-PCR检测细胞中PEDF mRNA的水平,Western blot检测细胞中PEDF、ERα、ERβ、SM22α、α-SMA、Bcl-2、cleaved Caspase-3、PI3K、total-AKT和p-AKT的蛋白水平。
1.4 计数试剂盒8(CCK-8)法测定细胞活力
细胞转染24 h后,离心收集细胞,然后用PBS洗涤,制成单细胞悬液。将细胞(6×103个/孔)接种到含有100 μl DMEM/F12培养液的96孔板中,每孔加入10 μl细胞计数试剂盒8(CCK-8)溶液。孵育48 h后,使用酶标仪检测450 nm处的光密度(OD)。实验重复3次。
1.5 EdU染色检测细胞增殖
采用EdU染色试剂盒检测细胞增殖情况。首先,将6×103细胞接种于96孔板中,加入EdU Apollo 567溶液处理细胞30 min。然后用DAPI对细胞核进行染色。最后在荧光显微镜下观察EdU阳性细胞。实验重复3次。
1.6 TUNEL染色检测细胞凋亡
使用一步法TUNEL细胞凋亡检测试剂盒检测细胞凋亡。转染后将1×104个细胞接种于96孔板中,4%多聚甲醛室温固定30 min,0.1% Triton X-100(溶于0.1%枸橼酸钠溶液)渗透2 min。PBS洗涤,TUNEL反应混合物37 ℃孵育细胞1 h,DAPI染色后,用奥林巴斯荧光显微镜对凋亡细胞进行分析。实验重复3次。
1.7 qRT-PCR检测分析组织和细胞中PEDF mRNA水平
用Trizol试剂从组织和细胞中提取总RNA,并根据说明书使用M-MLV逆转录酶逆转录2 μg的总RNA。使用分光光度计测量并计算RNA浓度。使用SYBR Green real time PCR Master Mix在Bio-Rad iQ5实时荧光定量PCR仪上进行RT-PCR。PEDF引物的上游和下游序列分别是5′-CCAGACGCGTACGATAGTAG-3′和5′-GAAGTATCCAATAGCTACCCG-3′。GAPDH作为内部对照,引物的上游和下游序列分别是5′-ATTCAACGGCACAGTCAAGG-3′和5′-GCAGAAGGGGCGGAGATGA-3′。PCR反应程序:95 ℃预变性30 s,95 ℃变性30 s,52~58 ℃退火45 s,72 ℃延伸45 s,40个循环。使用2-ΔΔCt计算PEDF的相对表达。实验重复3次。
1.8 Western blot检测分析组织或细胞中PEDF、ERα、ERβ、SM22α、α-SMA、Bcl-2、cleaved Caspase-3、PI3K、total-AKT和p-AKT的蛋白水平
将组织和细胞在裂解缓冲液中裂解,然后蛋白质在12% SDS-PAGE上电泳。随后转移到PVDF膜上,室温下用5%脱脂奶粉封闭2 h。然后将膜与PEDF(1 ∶1 000)、ERα(1 ∶2 000)、ERβ(1 ∶2 000)、SM22α(1 ∶500)、α-SMA(1 ∶2 000)、Bcl-2(1 ∶2 000)、cleaved Caspase-3(1 ∶3 000)、PI3K(1 ∶2 000)、total-AKT(1 ∶1 000)、p-AKT(1 ∶1 000)和β-actin(1 ∶1 000)一抗在4 ℃过夜孵育。用TBST洗涤后,将膜与辣根过氧化物酶标记的山羊抗兔IgG二抗(1 ∶3 000)在室温下孵育1 h。通过增强化学发光(ECL)试剂进行显影。使用Image J对所得条带的强度进行量化。GAPDH用作内部参考。实验重复3次。
1.9 统计数据分析
计量数据用均数±标准差表示,通过SPSS软件对各组数据进行统计分析,两组间比较采用t检验或配对t检验,多组间比较采用单因素方差分析,多重比较采用LSD检验。本研究中所有数据均符合正态分布。P<0.05表示差异具有统计学意义。
2 结果
2.1 子宫肌瘤组织和平滑肌细胞中PEDF的表达
与正常子宫肌层组织相比,子宫肌瘤组织中PEDF的mRNA和蛋白表达水平均降低(t=13.221,P<0.001;t=10.297,P<0.001;见图1)。与正常子宫肌层平滑肌细胞相比,子宫肌瘤平滑肌细胞中PEDF的mRNA和蛋白表达水平均降低(t=12.464,P<0.001;t=13.563,P<0.001;见图2)。
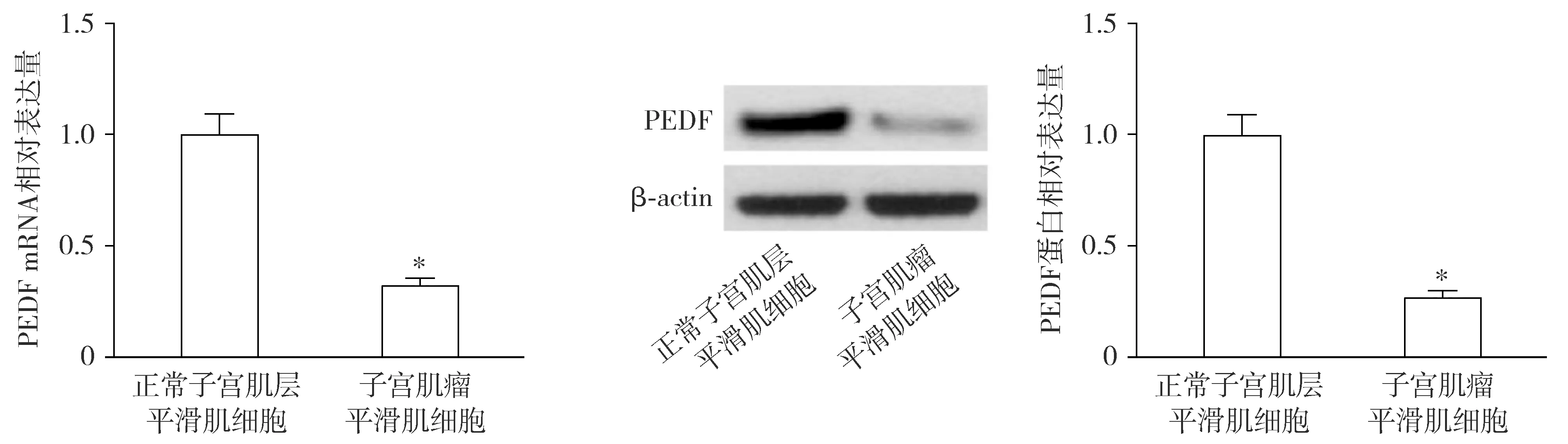
与正常子宫肌层平滑肌细胞比较,*P<0.05图2 子宫肌瘤平滑肌细胞和正常子宫肌层平滑肌细胞中PEDF的表达Figure 2 PEDF expression in uterine fibroids smooth muscle cells and normal myometrial smooth muscle cells
2.2 PEDF对子宫肌瘤平滑肌细胞增殖的影响
5组细胞中PEDF的mRNA(F=282.141,P<0.001)和蛋白(F=196.572,P<0.001)表达水平差异均具有统计学意义。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞中PEDF的mRNA和蛋白表达水平均显著升高(P<0.05,见图3);与shRNA-NC组相比,shRNA-PEDF组的PEDF的mRNA和蛋白表达水平均显著降低(P<0.05,见图3)。
5组细胞相对活力差异有统计学意义(F=29.336,P<0.001,见图4)。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的相对活力显著降低(P<0.05);与shRNA-NC组相比,shRNA-PEDF组细胞相对活力显著升高(P<0.05)。各组EdU阳性率差异有统计学意义(F=27.105,P<0.001,见图4)。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的EdU阳性率显著降低(P<0.05);与shRNA-NC组相比,shRNA-PEDF组EdU阳性率显著升高(P<0.05,见图4)。
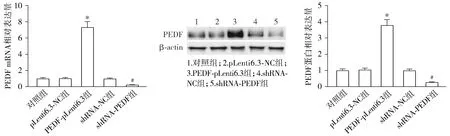
与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图3 子宫肌瘤平滑肌细胞中PEDF-pLenti6.3和shRNA-PEDF的转染效率Figure 3 Transfection efficiency of PEDF-pLenti6.3 and shRNA-PEDF in uterine fibroids smooth muscle cells

与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图4 PEDF对子宫肌瘤平滑肌细胞增殖的影响 (EdU染色×100)Figure 4 Effect of PEDF on the proliferation of uterine fibroids smooth muscle cells
2.3 PEDF对子宫肌瘤平滑肌细胞凋亡的影响
5组TUNEL阳性率差异有统计学意义(F=158.809,P<0.001,见图5)。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的TUNEL阳性率显著升高(P<0.05);与shRNA-NC组相比,shRNA-PEDF组TUNEL阳性率显著降低(P<0.05)。5组细胞中Bcl-2(F=183.272,P<0.001)和cleaved Caspase-3(F=175.191,P<0.001)的蛋白相对表达量差异均具有统计学意义(见图6)。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的Bcl-2蛋白相对表达量显著降低,cleaved Caspase-3显著升高(P<0.05);与shRNA-NC组相比,shRNA-PEDF组Bcl-2蛋白相对表达量显著升高,cleaved Caspase-3显著降低(P<0.05,见图6)。
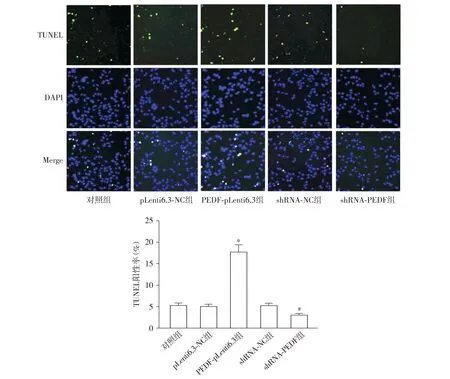
与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图5 PEDF对子宫肌瘤平滑肌细胞凋亡的影响 (TUNEL染色,×100)Figure 5 Effect of PEDF on the apoptosis of uterine fibroids smooth muscle cells
2.4 PEDF对子宫肌瘤平滑肌细胞分化的影响
SM22α主要分布在细胞质中。子宫肌层平滑肌细胞的肌丝清晰,排列整齐,细胞形态规则。子宫肌瘤平滑肌细胞的肌丝排列不规则,呈网状或团状(见图7)。
5组细胞中SM22α(F=137.024,P<0.001)和α-SMA(F=165.753,P<0.001)的蛋白相对表达量差异均具有统计学意义。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞SM22α和α-SMA蛋白相对表达量显著降低(P<0.05);与shRNA-NC组相比,shRNA-PEDF组SM22α和α-SMA蛋白相对表达量显著升高(P<0.05,见图8)。
2.5 PEDF对子宫肌瘤平滑肌细胞中ERα和ERβ表达的影响
5组细胞中ERα(F=159.676,P<0.001)和ERβ(F=134.397,P<0.001)的蛋白相对表达量差异均具有统计学意义。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的ERα和ERβ蛋白相对表达量显著降低(P<0.05);与shRNA-NC组相比,shRNA-PEDF组ERα和ERβ蛋白相对表达量显著升高(P<0.05,见图9)。
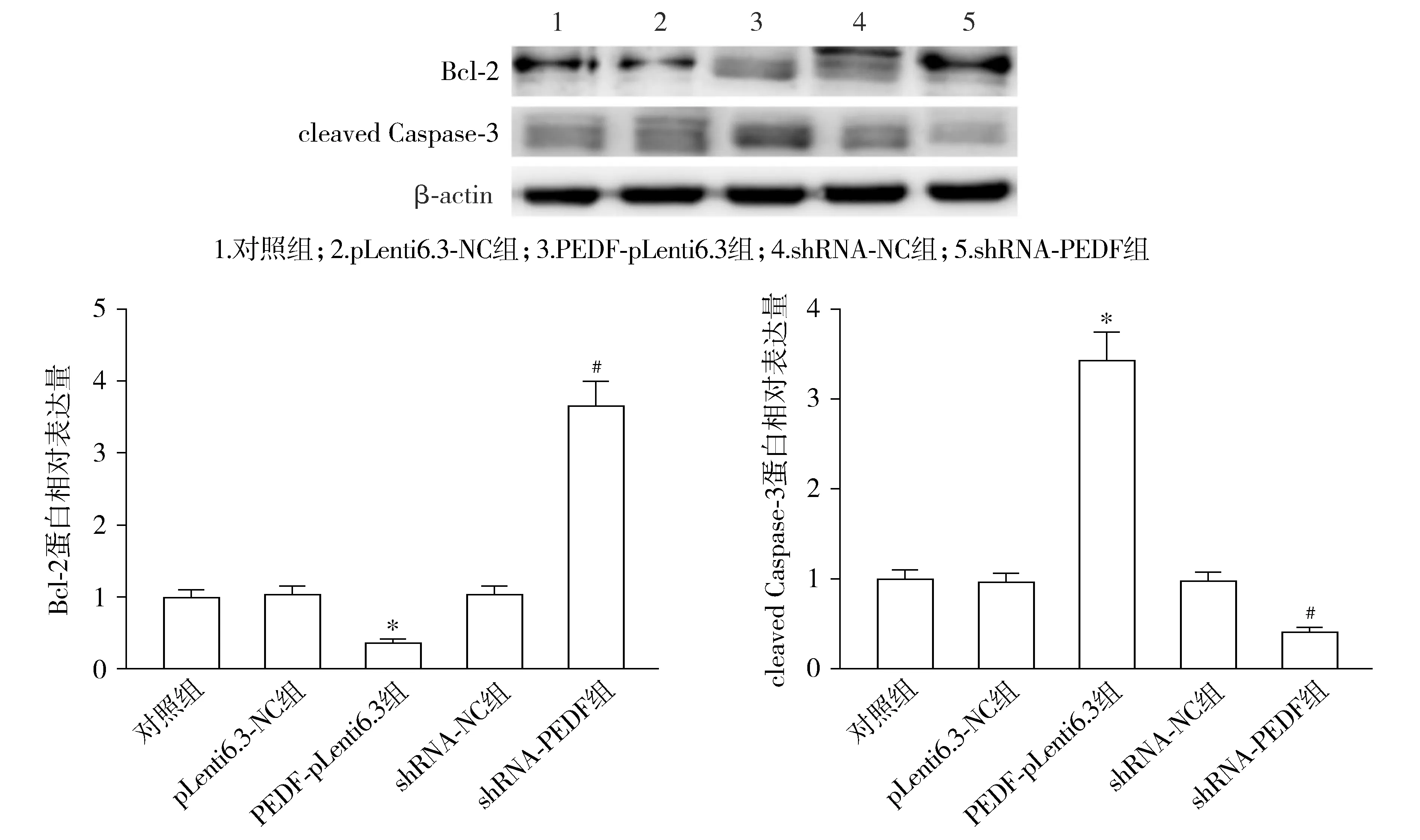
与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图6 PEDF对子宫肌瘤平滑肌细胞Bcl-2和cleaved Caspase-3蛋白表达的影响Figure 6 Effect of PEDF on the protein expression of Bcl-2 and cleaved Caspase-3 in uterine fibroids smooth muscle cells

绿色荧光:SM22α;蓝色荧光:DAPI图7 子宫肌层平滑肌细胞和子宫肌瘤平滑肌细胞形态 (×1 000)Figure 7 Morphology of normal myometrial smooth muscle cells and smooth muscle cells of uterine fibroids (×1 000)
2.6 PEDF对子宫肌瘤平滑肌细胞中PI3K-AKT信号通路的影响
5组PI3K(F=142.972,P<0.001)和p-AKT(F=191.951,P<0.001)的蛋白相对表达量差异均具有统计学意义。与pLenti6.3-NC组相比,PEDF-pLenti6.3组子宫肌瘤平滑肌细胞的PI3K和p-AKT蛋白相对表达量显著降低(P<0.05);与shRNA-NC组相比,shRNA-PEDF组PI3K和p-AKT蛋白相对表达量显著升高(P<0.05,见图10)。然而,各组total-AKT蛋白相对表达量差异无统计学意义(F=0.398,P=0.806,见图10)。
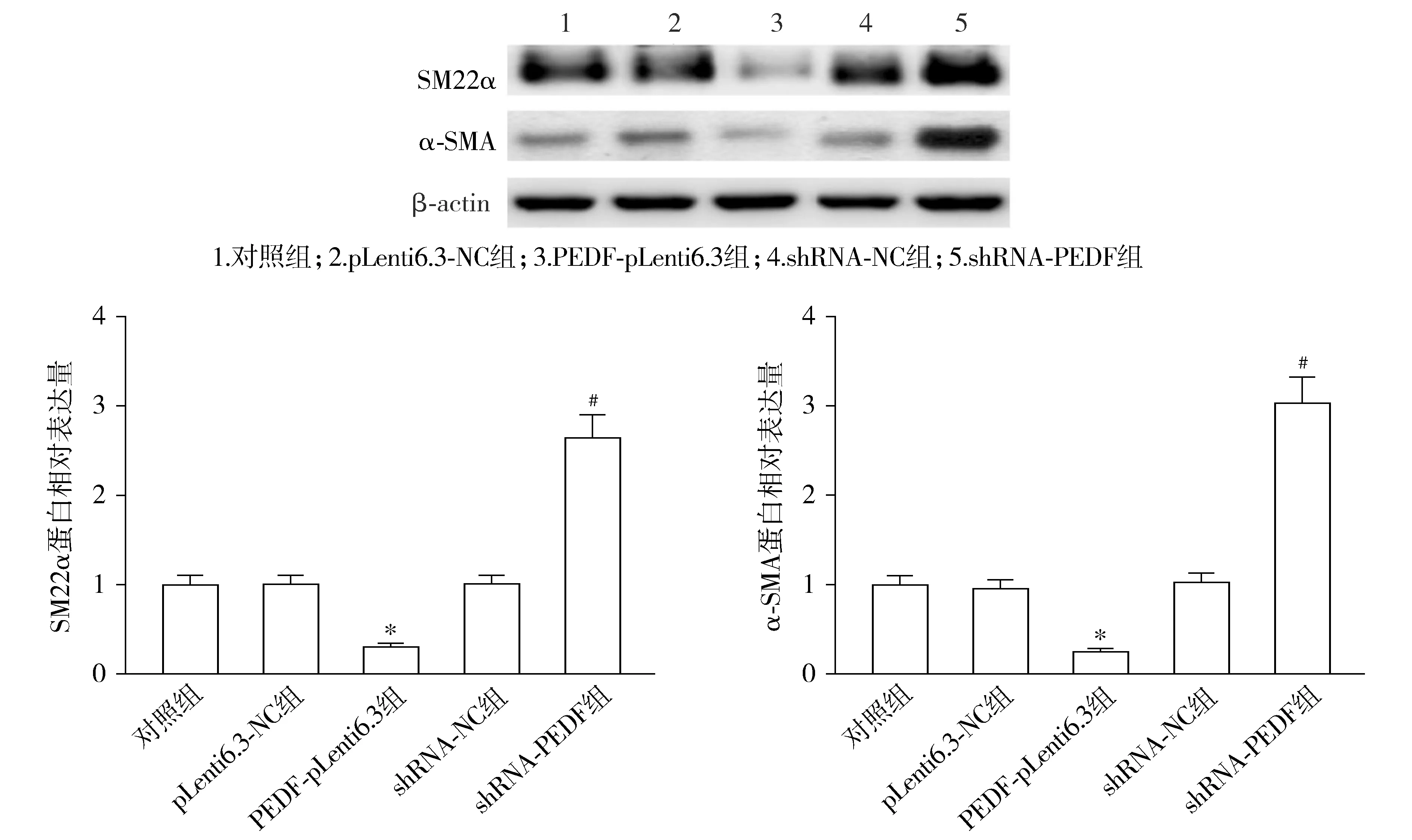
与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图8 PEDF对子宫肌瘤平滑肌细胞SM22α和α-SMA蛋白表达的影响Figure 8 Effect of PEDF on the expression of SM22α and α-SMA proteins in uterine fibroids smooth muscle cells
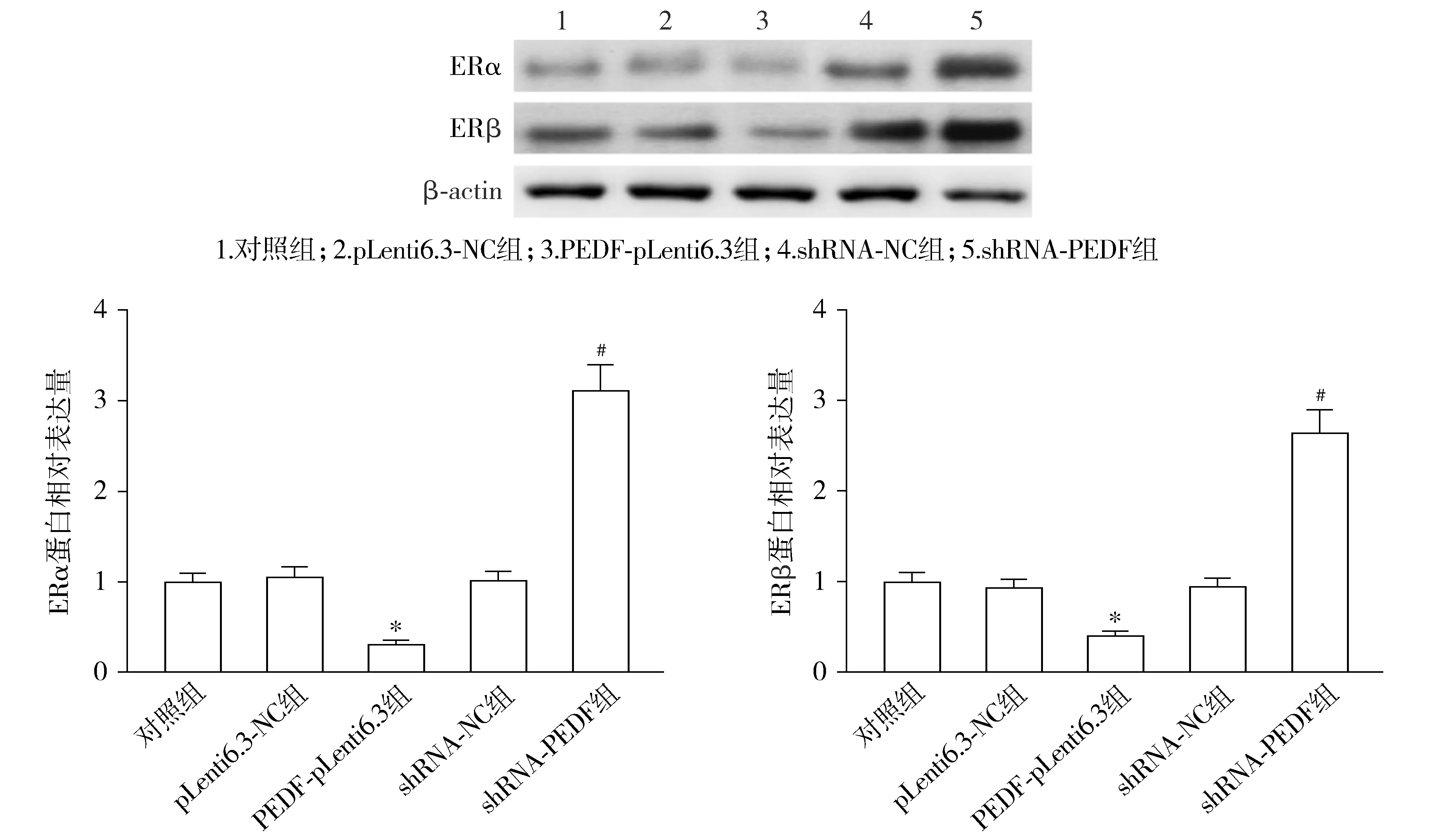
与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图9 PEDF对子宫肌瘤平滑肌细胞ERα和ERβ蛋白表达的影响Figure 9 Effect of PEDF on the expression of ERα and ERβ proteins in uterine fibroids smooth muscle cells

与pLenti6.3-NC组比较,*P<0.05;与shRNA-NC组比较,#P<0.05图10 PEDF对子宫肌瘤平滑肌细胞PI3K、total-AKT和p-AKT蛋白表达的影响Figure 10 Effect of PEDF on the expression of PI3K, total-AKT and p-AKT proteins in uterine fibroids smooth muscle cells
3 讨论
PEDF是由SERPINF1编码的一种50 kD的蛋白,属于serpin家族[11]。本研究中发现子宫肌瘤组织和平滑肌细胞中PEDF的表达被抑制,提示PEDF的低表达可能参与子宫肌瘤的发生发展。其他文献已经报道PEDF具有多种生物学功能,主要的功能包括抗多种疾病的血管生成、抗炎、抑制肿瘤生长和转移、诱导肿瘤内皮细胞凋亡等[5,6,12-14]。为了进一步揭示PEDF在子宫肌瘤发生发展中的可能作用,本研究通过对子宫肌瘤平滑肌细胞转染PEDF-pLenti6.3来上调PEDF的表达,转染shRNA-PEDF来下调PEDF的表达,研究结果表明,上调PEDF明显抑制了子宫肌瘤平滑肌细胞的增殖,并促进细胞凋亡。然而,下调PEDF则起到了相反的作用。这些结果说明PEDF调节子宫肌瘤平滑肌细胞的生长。最近,Bar-Joseph等[10]使用重组PEDF处理子宫肌瘤细胞系,结果表明重组PEDF抑制了细胞增殖;另外,重组PEDF可在体内降低小鼠背部异位子宫肌瘤的生长速度。结合本研究结果可知,PEDF的确调控子宫肌瘤的生长。另外,研究表明[15]PEDF的直接和间接抗肿瘤作用在很大程度上依赖于肿瘤细胞和血管内皮细胞的凋亡,并通过多种调控机制影响细胞凋亡。PEDF可直接或间接调控FasL、Bcl-2家族蛋白、Caspases、c-Flip、NFAT和PEDF-R的表达,从而影响细胞凋亡[15]。本研究结果也说明上调PEDF通过影响Bcl-2和cleaved Caspase-3的蛋白表达从而抑制了子宫肌瘤平滑肌细胞的凋亡。
子宫肌瘤的发生是由子宫平滑肌细胞的异常增殖和分化引起的[16]。α-SMA和SM22α是平滑肌细胞分化状态的标志物[17]。本研究结果表明上调PEDF明显抑制了子宫肌瘤平滑肌细胞中α-SMA和SM22α的表达,从而抑制了分化。其他文献也报道,PEDF可诱导神经元分化[11]。因此,PEDF可能也通过调控平滑肌细胞分化从而影响子宫肌瘤的生长。
子宫肌瘤发生在育龄阶段,其他学者认为子宫肌瘤可能是雌激素依赖性良性肿瘤[18,19]。先前的研究证实ERα在子宫肌瘤中的表达高于在正常子宫平滑肌中的表达[20]。目前,ERα在子宫肌瘤中的作用受到越来越多的关注,ER调节剂、选择性雌激素受体调节剂已被用于临床治疗子宫肌瘤[21]。本研究发现,上调PEDF抑制了子宫肌瘤平滑肌细胞中ERα和ERβ表达。据报道,当突变型ERα从大鼠子宫肌瘤组织转染到原代血管平滑肌细胞中时,它将与野生型ERα竞争结合雌激素反应元件,并失活雌激素介导的信号通路,从而诱导子宫肌瘤细胞凋亡并抑制其生长[20]。因此,这可能也是PEDF参与子宫肌瘤进展的机制之一。本研究结果与Bar-Joseph等[10]研究一致,该研究发现重组PEDF处理子宫肌瘤细胞系可下调ERα和ERβ的表达。
PI3K/AKT信号通路是人类肿瘤中最频繁激活的信号通路之一,也是研究最广泛的一种信号通路[22]。PI3K可以激活Akt并调控细胞增殖、凋亡、生长、侵袭和其他过程[23]。PI3K/AKT信号通路的激活促进了细胞增殖,并减少细胞凋亡,在癌细胞中可促进恶性转化和血管生成[24]。现有文献报道,PEDF以PEDFR依赖的方式通过PI3K/AKT信号通路增加GLUT4介导的大鼠缺血心肌葡萄糖摄取[25],提示PEDF对PI3K/AKT信号通路具有调控作用。因此,本研究探讨了PEDF对子宫肌瘤平滑肌细胞中PI3K-AKT信号通路的影响。本研究证实下调PEDF促进了子宫肌瘤平滑肌细胞PI3K/AKT信号通路的激活。此外,上调子宫肌瘤平滑肌细胞中的PEDF则抑制了PI3K/AKT信号通路的激活。由于PI3K/AKT信号通路的激活可促进细胞的增殖和分化[26,27],因此,本研究结果说明PEDF至少部分通过调节PI3K/AKT信号通路影响子宫肌瘤平滑肌细胞的增殖和分化。
综上所述,本研究表明PEDF在子宫肌瘤中被抑制。上调PEDF可抑制子宫肌瘤平滑肌细胞的增殖和分化,并诱导细胞凋亡,其机制部分是通过PI3K/AKT信号通路介导的。因此,PEDF可能是评价子宫肌瘤生长的候选标志物,而重组PEDF可能是治疗子宫肌瘤的新型药物。

