GM1治疗对新生7日龄高胆红素血症SD大鼠血清NSE水平的影响
赵小静,宋 瑞,阴怀清,武师润
(1山西医科大学第一临床医学院儿科,太原 030001;2山西医科大学第一医院儿科;*通讯作者,E-mail:yhq0351@163.com)
高胆红素血症是新生儿多见但不应该忽视的一种疾病,病理性和进行性间接高胆红素血症可发展为胆红素脑病(bilirubin encephalopathy,BIE)[1]。BIE可以是短暂的和急性的(有早期、中期和晚期阶段),也可以是永久性的、慢性的和终身的(两眼不能向上凝视、感觉神经听力损失、牙齿发育异常和锥体外系障碍如舞蹈症脑瘫)[1,2],是导致新生儿神经行为和认知功能障碍甚至残疾、死亡的主要原因之一。当前主要用光疗和换血疗法快速降低血清中的胆红素,但对于已进入血脑屏障的胆红素,其产生的神经毒性可使细胞发生凋亡、坏死,然而目前临床上还未发现可以预防和减轻脑损伤的有效药物。有研究表明,单唾液酸四己糖神经节苷脂(monosialote-trahexosyl ganglioside,GM1)可通过血脑屏障进入细胞膜,重构神经网络、促进受损神经恢复,改善神经功能[3],已被用于治疗多种神经系统疾病,但应用于胆红素脑病的研究尚少[4]。血清NSE被证明在反映脑损伤程度中具有较高的敏感性和特异性[5]。本实验研究通过建立新生7日龄高胆红素血症大鼠模型,观察予以外源性GM1干预前后血清NSE的水平以及神经元凋亡情况来评估脑组织损伤的程度,为临床儿科医生防治高胆红素脑病提供新方向。
1 材料与方法
1.1 材料与试剂
胆红素(美国Sigma公司),TUNEL试剂盒与血清NSE酶联免疫法检测试剂盒(武汉博士德生物技术公司),神经节苷脂GM1(山西国药控股国大药房有限公司)、NaOH粉末与浓盐酸(山西医科大学生理实验室提供),二甲苯、无水乙醇、90%乙醇、PBS、DAB显色试剂盒等则由山西医科大学第一附属医院病理科提供,5%水合氯醛由山西医科大学第一附属医院小儿内科提供。
1.2 液体配制及模型制备
1.2.1 配制胆红素溶液 于避光条件下称取胆红素晶体50 mg,溶于1 ml浓度为0.5 mol/L的NaOH溶液中,再加入9 ml双蒸水,用浓度为0.5 mol/L的盐酸将pH调至8.5,此时胆红素溶液的浓度为5 mg/ml。
1.2.2 实验动物及模型制备 新生7日龄SD大鼠(山西医科大学动物实验动物中心,已通过动物伦理委员会审查),雌雄不限,体质量10~18 g,随机分为对照组、高胆红素血症模型组(模型组)、GM1组,每组各40只。模型组大鼠腹腔注射100 μg/g配制好的胆红素溶液,对照组大鼠腹腔注射等体积的生理盐水,GM1组大鼠腹腔注射100 μg/g配制好的胆红素溶液后立即腹腔注射GM1 10 mg/kg。三组再根据各组大鼠注射药物结束后的不同时间点分为6,12,24,48,72 h亚组,每个亚组8只。造模结束后,将大鼠放回原饲养环境由母鼠喂养至相应时间点。
1.3 实验观察
1.3.1 病理学观察 各组大鼠于设定的不同时间点处死(5%水合氯醛麻醉,将其固定于手术台上,打开腹腔,充分暴露肝脏,在肝缘剪一小口,暴露心脏,用1 ml注射器从心尖部进针抽取血液置于EP管中,静置30 min后离心,取上清液置于管中标记后在-80 ℃冰箱中存放,分别取装有生理盐水、10%多聚甲醛的20 ml注射器从心尖部进针依次灌洗,直至肝缘小口处流出清亮的液体),断头取脑,置于福尔马林溶液中固定24 h后将包含海马区的脑组织石蜡包埋切片,苏木素-伊红(HE)染色,光镜下观察海马区组织病理学改变。TUNEL染色观察海马区细胞凋亡率。
1.3.2 血清学观察 将血清标本提前取出置于室温下解冻,随后用ELISA法检测血清中NSE的含量。
1.4 统计学分析
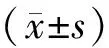
2 结果
2.1 HE染色
对照组细胞排列整齐,细胞形态正常,未见明显细胞水肿;模型组细胞排列愈加紊乱,空泡变性明显,胞核溶解、碎裂、消失;GM1组大鼠海马区细胞排列紊乱,细胞水肿,部分可见空泡,细胞核部分消失(见图1)。
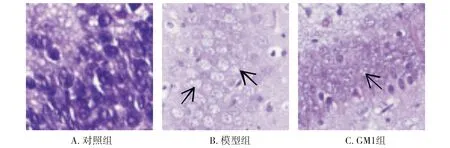
图1 各组新生大鼠海马区细胞HE染色 (×400)Figure 1 HE staining of cells in the hippocampal regions of newborn rats in each group (×400)
2.2 TUNEL染色
与对照组相比,模型组各时间点海马区细胞凋亡明显增加,差异具有统计学意义(P<0.05);与模型组比较,GM1组各时间点海马区细胞凋亡减少,但仍高于对照组,且差异均有统计学意义(P<0.05,见表1)。
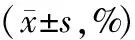
表1 各组各时间点海马区细胞凋亡指数
2.3 血清NSE含量
对照组血清NSE浓度较低,每个相对应的时间点模型组血清NSE浓度均比对照组高(P<0.05),GM1组血清NSE浓度均比模型组低,但仍高于对照组,且差异均有统计学意义(P<0.05,见表2)。
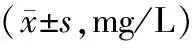
表2 各组各时间点血清NSE浓度
3 讨论
新生儿基于胆红素代谢的特殊性,容易合并高胆红素血症,这是胆红素生成和消除之间不平衡的结果[6]。相关数据显示高于60%的足月儿和80%的早产儿患有新生儿黄疸[7],若未及时发现并进行干预和治疗,极易引起胆红素脑病,严重者可威胁患儿生命。目前高胆红素血症脑损伤的具体机制尚未清楚,现有的研究表明[8],低浓度的未结合胆红素(unconjugated bilirubin,UCB)可以通过抗氧化起神经保护作用,而过量的UCB常沉积于基底节区,且感染苍白球、黑质、海马区等位置的频率较高,从而发挥神经毒性作用。近些年的研究推翻了临床上常以胆红素指标对高胆红素血症等进行诊断及预后的做法,脑内胆红素浓度、胆红素暴露的时间、神经元易感性及血脑屏障的功能状态成为更为重要的考虑因素[6],溶血病患儿或早产儿出生后几天内的胆红素浓度会急剧升高,若此时才对患儿进行干预则极有可能错过最佳治疗时机,使患儿出现神经系统功能损伤现象,进一步发展为严重胆红素脑病[9]。因此,寻找更为敏感和特异的检测指标及治疗策略尤为重要。
NSE特异性定位在于中枢神经系统的神经元和神经内分泌细胞的胞质内。其在血清中是稳定的,不受非神经元特异性烯醇化酶交叉反应的影响[10,11]。相关数据显示血清NSE的高低可评估在缺氧、缺血、动脉低血压和高血压等损害因素的进展过程中脑细胞损伤的程度[12],血清浓度与脑损伤程度成正比[13]。
神经节苷脂在脊椎动物的神经组织中高水平且持续表达[14],并在许多细胞生理过程中扮演着重要角色,包括细胞分化、细胞信号、神经元保护、神经元修复和细胞凋亡等[3]。GM1可穿过血脑屏障,有研究表明[15],它是细胞膜的组成成分,与调节离子转运、神经元分化、G蛋白偶联受体、免疫系统再激活和神经保护信号等机制的蛋白质相互作用,发挥其在神经系统中潜在的治疗作用;它还刺激内源性NGF的合成,共同发挥神经细胞保护作用,促进神经细胞再生[16]。
健康人的血清NSE水平正常较低,在脑损伤状态下,神经元细胞膜结构和功能受损,NSE透过血脑屏障进入脑脊液及体循环[13],这为本研究提供了理论基础。外源性GM1已被用于治疗多种神经系统疾病,但应用于胆红素脑病的研究尚少[4]。本研究通过建立新生7日龄高胆红素血症大鼠模型,随时间推移,脑组织海马区细胞排列愈加紊乱、水肿明显、凋亡增加,血清NSE水平增加,提示胆红素所致脑损伤,予以外源性GM1干预后海马区神经元细胞凋亡减少、血清NSE含量降低,初步推断在高胆红素血症中,GM1也发挥着脑损伤神经保护作用。
综上,此实验观察到新生高胆红素血症SD大鼠海马区神经元细胞凋亡增加,血清NSE水平明显升高,GM1干预后细胞凋亡减少,NSE水平下降,认为GM1对新生高胆红素血症大鼠脑损伤有神经保护作用,这为实际工作中早期防治高胆红素血症脑损伤提供了新的治疗思路。有研究显示[17],维持细胞内钙稳态是神经元存活的关键,那么GM1是如何调节钙稳态起到神经保护作用,其中涉及的详细分子机制还需大量的实验研究。

