EPO通过JAK2/STAT5信号通路减轻大鼠血管平滑肌细胞钙化
常晋瑞,魏 明,赵玉峰,南 瑛,曹 健,朱娟霞,孙 娜
(西安医学院基础医学研究所,西安 710021;*通讯作者,E-mail:563000915@qq.com)
血管钙化是慢性肾病常见的并发症,是慢性肾病全因死亡的独立预测因子[1,2]。然而,目前尚无特效的药物和治疗方法能够减缓或治愈血管钙化。因此寻找有效的血管钙化治疗方法和干预靶点,具有十分重要的临床意义。
慢性肾病患者发生血管钙化的同时,常伴发肾源性生物活性物质缺乏。研究表明,多种内源性生物活性物质参与了血管钙化的调控[3,4]。促红细胞生成素(erythropoietin, EPO)是肾脏分泌的一种糖蛋白,通过其受体发挥生物学活性[5],EPO目前已被广泛应用于临床肾性贫血的治疗。我们前期研究[6]发现,血管平滑肌细胞上亦有EPO受体(EPO receptor, EPOR)的蛋白表达,且钙化血管平滑肌细胞中EPOR蛋白表达降低,进一步研究发现EPO可减轻慢性肾病大鼠血管钙化[6]。然而其受体后信号通路尚不清楚。
据文献报道[7],Janus激酶2/信号转导与转录活化因子5(Janus kinase 2/signal transducer and activator of transcription 5, JAK2/STAT5),磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶(phosphatidylinositol 3 kinase/serine-threonine kinase, PI3K/Akt)与细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)是EPOR后的经典信号通路[7]。典型的JAK2/STAT5通路是EPO调节红系祖细胞分化、增殖和存活的重要因子;最近研究发现JAK2/STAT5在多种靶细胞中参与mRNA剪接、细胞骨架重组和细胞代谢等过程[7-9];PI3K/Akt信号在介导红系祖细胞存活、增殖和终末分化方面至关重要,ERK信号参与了红细胞的终末成熟;在非红系细胞中,PI3K/Akt和ERK信号通过调节细胞凋亡、氧化应激和炎症,参与了EPO保护心肌和神经细胞损伤的作用[10]。但JAK2/STAT5、PI3K/Akt与ERK信号通路是否参与EPO减轻血管钙化的作用尚不清楚。鉴于此,本研究分别采用JAK2/STAT5、PI3K/Akt与ERK信号通路的阻断剂AG490、LY294002或PD98059预孵育大鼠血管平滑肌细胞,在高磷诱导的血管平滑肌细胞钙化模型中,观察3条通路在EPO减轻血管平滑肌细胞钙化的作用,探索EPO抑制血管钙化的受体后通路。
1 材料与方法
1.1 材料与试剂
雄性成年SD大鼠,(150±10)g,由西安交通大学医学部实验动物中心提供[许可证号:SCXK(陕)2012-003],本实验动物处理遵循西安医学院实验动物管理章程并获得西安医学院伦理委员会批准[批准编号:XYLS2020044]。EPO购自沈阳三生制药有限责任公司,β-磷酸甘油(G9422)与茜素红(A5533)购自美国Sigma-Aldrich公司。AG490(14704)、LY294002(9901)和PD98059(9900)购自美国Cell Signaling Technology公司。钙含量(C004-2-1)和碱性磷酸酶(alkaline phosphatase, ALP)(A059-2-2)试剂盒购自南京建成科技有限公司。兔抗平滑肌蛋白(Smoothelin)(ab219652)和兔抗钙结合蛋白(Calponin)(ab46794)购自英国Abcam公司。鼠抗骨桥蛋白(osteopontin, OPN)(sc-21742)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)(sc-25778)多克隆抗体和辣根过氧化物酶偶联二抗(山羊抗兔、抗鼠)购自美国Santa Cruz公司。化学发光试剂盒购自北京普利莱技术公司。
1.2 大鼠血管平滑肌细胞培养与分组
按照我们之前的方法[3],采用大鼠原代血管平滑肌细胞培养方法。分离雄性SD大鼠胸主动脉,去除内皮和外膜。然后,将血管中膜切成约1 mm2的小块,置于含有20%胎牛血清(Hyclone,美国)的Dulbecco改良Eagle培养基(DMEM;Gibco,美国),并在细胞培养箱中孵育。传代后,将血管平滑肌细胞培养在含10% FBS的DMEM中。第3代至第8代的细胞用于实验。
为了分别探索JAK2/STAT5、PI3K/Akt与ERK三条信号通路在EPO减轻血管钙化中的作用,将细胞各分成4组:对照组、钙化组、钙化+EPO组和钙化+EPO+通路的阻断剂组(AG490、LY294002或PD98059)。AG490、LY294002与PD98059分别是JAK2/STAT5、PI3K/Akt与ERK通路的阻断剂。将血管平滑肌细胞采用2%血清饥饿24 h后,加入AG490(10 μmol/L)或LY294002(10 μmol/L)或PD98059(10 μmol/L)预孵育30 min,再加入EPO(10 U/ml)并诱导钙化(10 mmol/L β-甘油磷酸)。每3 d更换一次含有EPO、β-甘油磷酸与AG490、LY294002或PD98059的培养基。后续实验均参照此分组处理。参考文献[3],在加药处理第3天收集细胞进行ALP活性测定,在第6天进行蛋白检验以分析细胞表型,在第14天进行茜素红染色和钙含量测定。
1.3 ALP活性检测
培养3 d的待测细胞用冷PBS冲洗3次后,加入200 μl ALP裂解液(含0.2% NP40,1 mmol/L MgCl2·6H2O)于冰上裂解30 min后,收取细胞。将样品在-70 ℃冰箱中反复冻融3次。4 ℃,8 000 r/min离心10 min,取上清。使用ALP试剂盒测量ALP活性,并将值与蛋白浓度标准化,计算单位蛋白中的ALP活性。实验重复4次。
1.4 Western blot法检测细胞中Smoothelin、Calponin和OPN的蛋白表达
采用RIPA蛋白裂解液收取细胞后超声破碎细胞,4 ℃ 13 000 r/min离心10 min,取上清。蛋白定量采用BCA试剂盒(西安赫特生物有限公司,批号WB003)。向上清中加入5×蛋白上样缓冲液,于100 ℃煮沸15 min。取60 μg样品蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转膜,白蛋白封闭1 h,一抗稀释液4 ℃过夜,二抗常温孵育1 h后,采用ChemiDoc MP(Bio-Rad公司,美国)成像系统进行化学显色曝光后,应用Image Lab软件(Bio-Rad公司,美国)进行条带灰度分析。蛋白相对含量以目的蛋白条带灰度值和内参GAPDH条带灰度比值表示。
1.5 茜素红染色检测钙盐沉积情况
将细胞用4%(V/V)多聚甲醛固定15 min后,去离子水冲洗3次。加入1%茜素红1 ml,37 ℃水浴30 min。去离子水冲洗3次。倒尽剩余去离子水。倒置显微镜放大100倍观察、照相。阳性染色为橘红—红色。染色后的细胞中加入10%甲酸溶液,于摇床上轻微震荡孵育10 min,吸取溶解茜素红的溶液于96孔板,在405 nm波长处测定样品吸光度OD值,减去空白孔(10%甲酸)OD值后,与对照组比较,进行半定量分析。
1.6 钙含量检测
培养14 d的待测细胞用冷PBS冲洗3次,加入200 μl 0.6 mol/L HCl 4 ℃过夜使钙盐充分溶解后,收取细胞并超声破碎细胞,4 ℃ 13 000 r/min离心10 min,取上清行BCA法蛋白定量。另取上清按照钙含量试剂盒说明书测定细胞钙离子浓度,通过细胞蛋白标准化计算单位蛋白中的钙含量。实验重复4次。
1.7 统计学分析
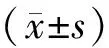
2 结果
2.1 各组血管平滑肌细胞中Smoothelin、Calponin和OPN蛋白表达情况
与对照组比较,钙化组Smoothelin和Calponin蛋白表达水平明显降低(P<0.01),OPN蛋白表达水平上升(P<0.05,见图1);与钙化组比较,钙化+EPO组Smoothelin和Calponin蛋白表达增高(P<0.01),而OPN蛋白表达降低(P<0.05,见图1);与钙化+EPO组比较,钙化+EPO+AG490组Smoothelin和Calponin的蛋白表达水平分别下调了53.6%和27.7%(P<0.05),OPN蛋白表达水平上调了86.8%(P<0.01,见图1)。
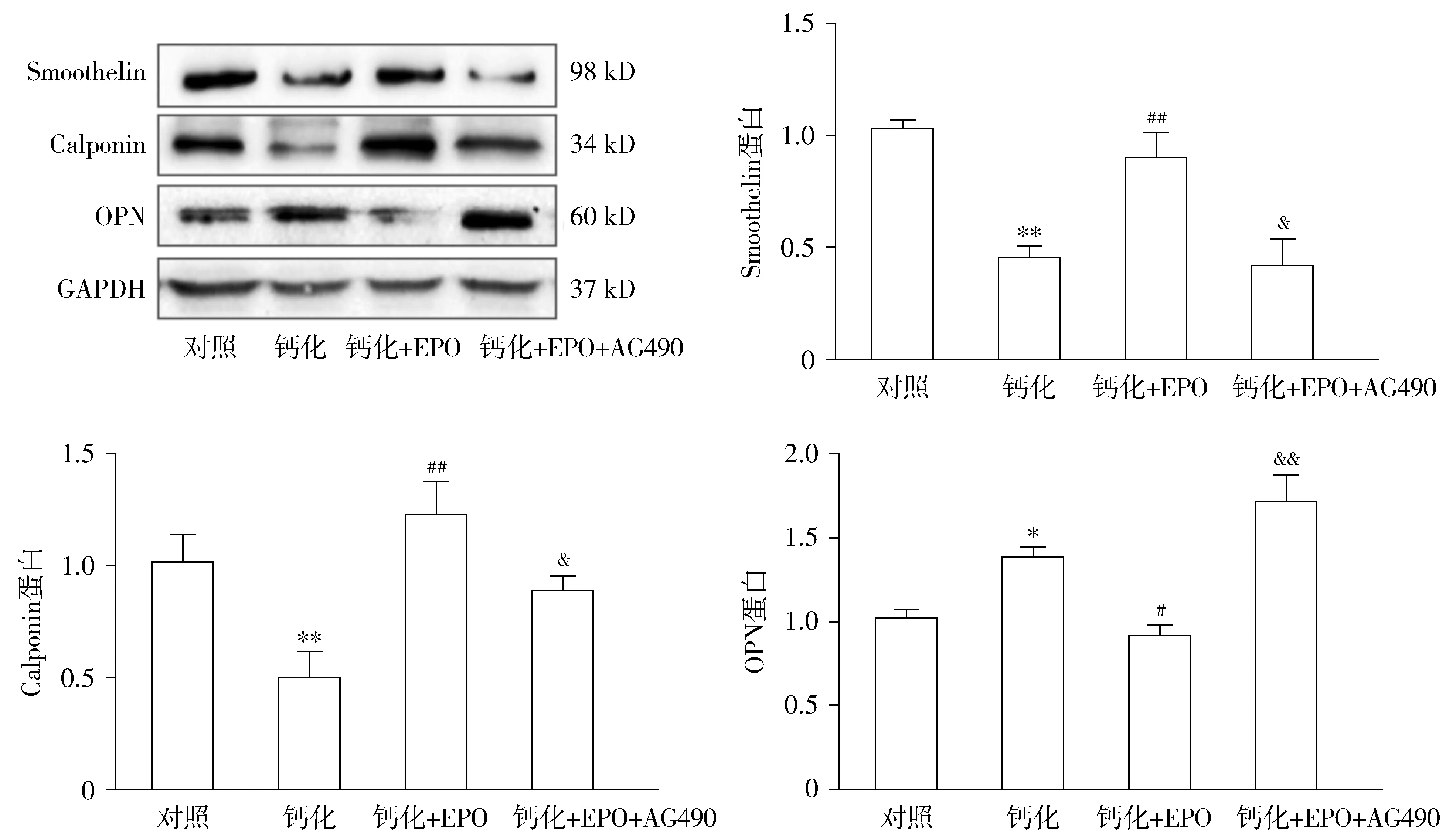
与对照组比较,*P<0.05,**P<0.01;与钙化组比较,#P<0.05,##P<0.01;与钙化+EPO组比较,&P<0.05,&&P<0.01图1 Western blot检测各组血管平滑肌细胞中Smoothelin、Calponin和OPN蛋白表达Figure 1 The protein levels of Smoothelin, Calponin and OPN in vascular smooth muscle cells in each group by Western blot
2.2 AG490对EPO抑制血管平滑肌细胞钙化的影响
与钙化组相比,钙化+EPO组钙含量和ALP活性分别降低了46.7%和49.5%(P<0.01),细胞间橘红色钙盐染色显著减少(见图2)。与钙化+EPO组比较,钙化+EPO+AG490组钙含量和ALP活性分别增加了58.3%(P<0.05)和88.7%(P<0.01),橘红色钙盐染色明显增加(见图2)。
2.3 LY294002和PD98059对EPO减轻血管平滑肌细胞钙化的影响
与钙化组比较,钙化+EPO组钙含量和ALP活性明显降低(P<0.05);与钙化+EPO组相比,钙化+EPO+LY294002组或钙化+EPO+PD98059组钙含量和ALP活性均无明显差异(见图3)。
3 讨论
一项国际性、多中心研究发现,81%的慢性肾病患者伴有腹主动脉钙化[11]。血管钙化是导致慢性肾病患者心血管疾病发病率和死亡率显著增加的重要危险因素[12,13]。因此预防和早期诊治血管钙化以降低慢性肾病患者心血管事件以及病死率,已成为亟待解决的临床问题。
血管钙化是指钙盐在动脉壁的过度异常沉积。既往认为血管钙化是机体钙磷代谢失衡所致的钙盐在细胞和组织间的被动沉积过程,作为与衰老相伴行的退行性病变,是血管老化的标志。而近年研究表明[14],血管钙化的形成是一个与骨发育相似的、细胞介导的、主动的、可逆转和高度可调控的生物学过程,是血管壁细胞尤其是中膜血管平滑肌细胞向成骨样细胞或软骨样细胞表型转变的过程[14]。血管平滑肌细胞的表型转变伴随着收缩蛋白Smoothelin和Calponin等的表达降低,而成骨细胞标志物蛋白包括ALP、OPN、骨钙素、骨形态发生蛋白2及核结合因子α1等的表达增加[15]。我们的研究发现,高磷刺激的血管平滑肌细胞中Smoothelin和Calponin的蛋白表达降低,而ALP活性和OPN蛋白表达增加,钙含量和茜素红染色结果进一步证实高磷处理组钙盐沉积阳性染色增多,提示离体血管平滑肌细胞钙化模型制备成功。
我们之前的研究发现,多种内分泌活性物质参与了血管钙化的调控[3,4]。肾脏不仅是人体最重要的排泄器官,还是人体一个重要的内分泌器官。慢性肾病常常同时并发血管钙化、贫血和肾源性生物活性物质的缺乏,如EPO。成熟的EPO是一个高度糖基化、含有165个氨基酸的糖蛋白,其发挥作用主要通过与靶细胞膜上的EPOR结合[16]。多篇研究证实,EPO通过抑制内质网应激、减少细胞凋亡等机制减轻心、脑血管损伤[17,18],而内质网应激和凋亡可促进血管钙化的发生[19,20]。我们之前的研究发现,EPOR不仅存在于造血细胞,还存在于血管平滑肌细胞,而且慢性肾病大鼠钙化血管平滑肌细胞中EPOR蛋白表达降低[5]。在此基础上,我们探索性地给予钙化血管平滑肌细胞EPO处理,发现EPO能减轻高磷诱导的血管平滑肌细胞向成骨样细胞转变,进一步减少钙盐沉积,证实补充生物活性物质EPO,可减轻血管钙化。但本研究尚未观察给予EPO后,血管平滑肌细胞中EPOR的表达改变及EPOR在EPO减轻血管平滑肌细胞钙化中的作用。在后续的研究中,我们将直接在血管平滑肌细胞中过表达EPOR或采用其他EPOR激动剂,进一步探索EPO/EPOR在血管平滑肌细胞钙化中的作用。
多篇研究发现,JAK2/STAT5通路参与了EPO的生物学作用[7,8]。JAK/STAT通路是一种重要的信号转导途径,参与传递多种代谢相关激素和细胞因子的信号,包括促红细胞生成素等[21]。JAK家族有4个成员:JAK1/2/3和TYK2[22]。JAK1/2和TYK2广泛表达,而JAK3主要在造血细胞中表达。STAT家族有7个成员STAT1/2/3/4/5a/5b/6。不同的细胞因子招募不同JAK和STAT相组合。EPO与其受体结合后,诱导EPOR发生二聚体化。构象变化的EPOR激活下游信号分子,如JAK2/STAT5、PI3K/Akt、ERK等信号通路[7,23]。Miljus等[9]在缺氧诱导的蝗虫脑神经元损伤模型中发现,JAK2抑制剂AG490可消除EPO对蝗虫脑神经元的保护作用,而PI3K的抑制剂LY294002对EPO介导的神经保护作用无影响[9]。本研究采用AG490预孵育以阻断JAK2/STAT5通路后,EPO抑制血管平滑肌钙化的作用消失,而PI3K/Akt、ERK的阻断剂LY294002与PD98059不能阻断EPO减轻血管平滑肌细胞钙化的作用。提示EPO抑制血管钙化是通过激活JAK2/STAT5通路实现的。
综上所述,JAK2/STAT5信号通路可能介导了EPO抑制血管平滑肌细胞向成骨样细胞表型转变、减少钙盐沉积,减轻血管钙化的作用。内源性活性物质EPO在血管钙化的发生发展过程中发挥重要的调控作用,JAK2/STAT5有可能成为血管钙化新的防治靶点。

