维生素C制剂及果蔬中Vc含量测定实验的改进
李文卓, 贾 旭, 杨德红, 蔺春蕾, 张艳丽
(中原工学院 材料与化工学院, 河南 郑州 450007)
维生素C制剂及果蔬中Vc含量的直接碘量法测定实验是分析化学经典的氧化还原滴定实验,在高校化学、化工、医药、环境等理工类专业中被广泛开设。该方法具有仪器操作简单,样品预处理简易、现象明显等优点,同时又可以使学生掌握碘量法测定的原理和方法步骤,提高实验技能[1]。然而,在配制碘溶液时,在研磨碘和碘化钾的混合物的过程中,碘的挥发量较大,很容易造成实验室污染,影响师生健康;另外,用该方法测量维生素C制剂和果蔬中Vc含量时,消耗的碘和碘化钾的量过大,增加了实验成本和含碘废液的排放量。为了解决以上问题,笔者改进了碘标准溶液的配制方法,考查了不同浓度的碘标准溶液对测定Vc含量的影响。
1 实验
1.1 仪器试剂
1.1.1 仪器
ES-J220A分析天平(天津市德安特传感技术有限公司),85-2型恒温磁力搅拌器(河南智成科技发展有限公司)。
25 mL移液管、250 mL容量瓶、50 mL酸式滴定管。
1.1.2 试剂
NaOH 溶液(1.0 mol/L)、HCl溶液(1.0 mol/L)、I2(优级纯)固体、KI固体、Na2S2O3标准溶液(0.05 mol/L)、固体As2O3、维生素C片剂(华中药业股份有限公司)、2 g/L淀粉溶液、2 mol/L的HAc溶液。
以上试剂如无特殊说明均为天津市科密欧化学试剂有限公司的分析纯试剂。玻璃仪器均为洛阳北方玻璃厂出产。实验用水为新制备的蒸馏水。
1.2 碘标准溶液配制方法的改进
1.2.1 配制方法
常规的碘标准溶液配制方法:将固体I2、KI和H2O混合(见表1中碘液A的配制),研磨至溶解,再将溶液转入棕色试剂瓶中,加蒸馏水稀释即可制成。然而,研磨过程中,体系敞开,碘的挥发量较大,造成实验室环境污染。另外,由于I2在KI溶液中的溶解速率慢,也会造成I2的挥发,同样污染实验室环境。
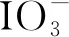
(1)
反应(1)表明,使用强碱性物质,可显著增加I2的溶解速率。因此,在碱性环境中溶解固体I2,能显著降低I2的挥发量。
(2)
然而,在酸性环境下反应(2)的反应速率较快,生成的I2如果不能及时和试样反应,必然会以固体I2的形态析出并挥发,严重影响滴定的准确度。为了解决这一问题,需要在配制下列碘液时加入一定量的KI,从而发生反应(3)
(3)
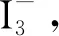
由此得知,可以通过改变溶液的酸碱性来改变碘元素在水溶液中的存在形式,改善其溶解速率,克服常规的碘标准溶液配制方法出现的问题。改进的I2标准溶液的配制方法见表1。表1中,碘液A为用常规的方法配制的I2标准溶液[3],碘液B为用改进的方法配制的I2标准溶液。

表1 常规和改进的碘标准溶液配制方法对照表
1.2.2 改进的碘液配制方法的理论依据

表2 部分含碘物质的标准电极电势
(4)
从反应(1)和反应(2)可知,如果在碱性环境下溶解I2,在酸性环境下利用反应(2)生成的I2作为滴定剂进行滴定,则存在下面物质转换关系。
(5)
1.3 果蔬试样液的制取及Vc含量的标定
用250 mL干燥小烧杯准确称取85 g左右捣碎了的新鲜果蔬(柠檬)试样[5],将其转入250 mL锥形瓶中,用蒸馏水冲洗小烧杯1~2次。向试样中加入2 mol/L的CH3COOH溶液10 mL和2 g/L的淀粉溶液3 mL,摇匀,立即用I2标准溶液滴定至试液由浅黄色变为浅蓝色,30s内不褪色即为终点[6]。平行标定5份。
1.4 碘标准溶液浓度的标定
用移液管移取25.00 mL 0.051 24 mol/L的Na2S2O3标准溶液于250 mL锥形瓶中,加50 mL蒸馏水、2 g/L的淀粉溶液3 mL,然后分别用配制好的碘液A 和碘液B滴定至试液呈浅蓝色,30 s内不褪色即为终点。平行标定6份,同时做空白实验,计算碘溶液浓度。
1.5 碘标准溶液稳定性测试
标准溶液在使用过程中的稳定性对标定结果影响非常大。为此,我们采用As2O3基准试剂制备的Na3AsO3溶液对碘液A和B进行一系列标定,以考察其浓度随时间的变化[7]并与标准溶液Na2S2O3标定碘液B结果作比较。
Na3AsO3基准溶液的制取方法为:准确称取0.624 2 g的As2O3,置于100 mL烧杯中,加入5 mL浓度为 6 mol/L的NaOH溶液,温热溶解,然后加2滴2 g/L酚酞指示剂,用6 mol/L HCl溶液中和至刚好无色,再加入1~1.5 g NaHCO3,搅拌溶解,定量转移至250 mL容量瓶中,加蒸馏水稀释至刻度,摇匀,便可得到0.012 62 mol/L的Na3AsO3基准溶液[3]。
测定时,准确移取25.00 mL Na3AsO3,加50 mL蒸馏水、5 g NaHCO3和3 mL淀粉指示剂,用配置好的碘标准溶液滴定到稳定的蓝色, 30 s内不褪色即为终点。记录消耗碘液的体积,同时做空白实验。每隔30 min标定一次,时间跨度为240 min,碘液B标定8次,观察标定出的碘溶浓度随时间的变化。
1.6 Vc含量的测定
1.6.1 维生素C制剂中Vc含量的测定
准确称取研磨好的维生素C制剂0.2~0.3 g,置于250 mL 锥形瓶中,加入100 mL新煮沸并冷却的蒸馏水、10 mL醋酸和3 mL淀粉溶液,分别用浓度为0.025 03 mol/L的改进的碘标准溶液和0.049 85 mol/L 的I2标准溶液滴定至出现稳定的浅蓝色,记录消耗I2溶液的体积。分别平行滴定3份,同时做空白实验。维生素C片剂样品中维生素C的含量按式(6)计算:
(6)
WVc1——维生素C片剂样品中维生素C的含量,mg/(100 mg)样品;
VI2——滴定消耗的I2标准溶液的体积,mL;
cI2——I2标准溶液的浓度,mol/L;
m1——维生素C片剂样品的质量, g;
M1——维生素C的摩尔质量, g/mol。
1.6.2 果蔬试样液中Vc含量的测定
用浓度为0.025 03 mol/L改进的碘标准溶液滴定果蔬试样液,滴定至试样液由浅黄色变为浅蓝色且在30 s内不褪色为终点。试样液中Vc的含量按式(7)计算:
(7)
WVc2——果蔬试样中维生素C的含量,mg/(100 g);
m2——果蔬试样质量,g。
2 结果与讨论
2.1 碘标准溶液配制过程中碘的挥发量
表3为配制的碘液A和碘液B的标定结果,可以得出碘液A和碘液B浓度的平均值分别为0.023 80 mol/L和0.025 03 mol/L。碘液A的平均浓度比碘液B的平均浓度小,其原因是配制碘液A时,在研磨溶解碘和碘化钾的过程中,体系敞开,碘的溶解速率慢,固体碘漂浮在溶液表面上导致其升华所致。碘标准溶液配制过程碘的挥发量hI2(计算时VI2为500 mL,参照表1)按式(8)计算:
(8)
hI2——I2的挥发量,g;
mI2——固体I2的质量,g;
MI2——I2的摩尔质量,g/mol;

根据(8)式,可以算出碘液A和碘液B配制过程中碘的挥发量分别为0.194 g和0.032 8 g。因而,采用改进后的碘标准溶液配制方法,可以使碘的挥发量减少到原来的16.9%。因而,用这种配制方法可以显著减少碘挥发量,改善实验室环境,降低对学生身体健康的伤害[8]。
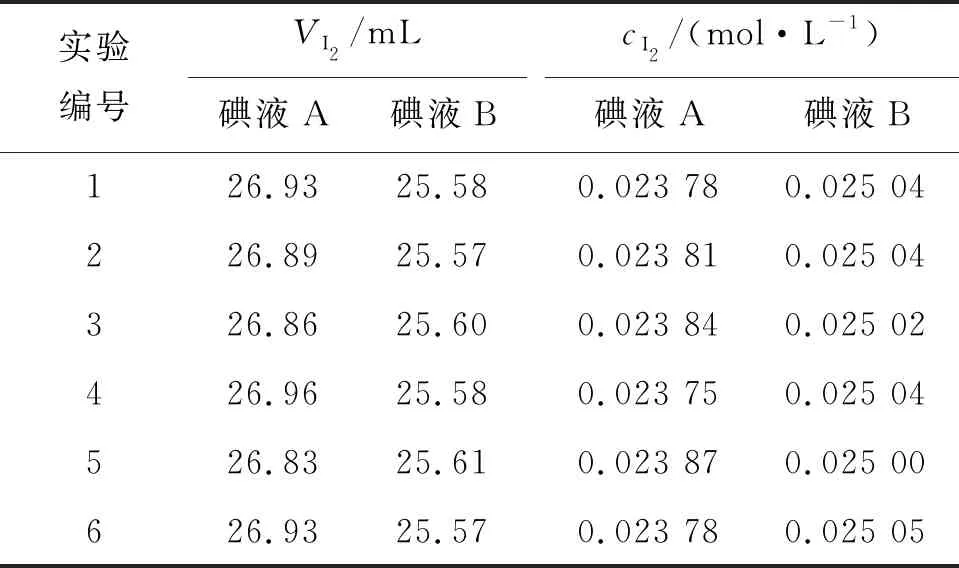
表3 碘标准溶液标定结果
2.2 碘标准溶液的稳定性
实验“维生素片剂中Vc含量的测定”一般需要4 h,因此,要求配制的碘标准溶液在4 h内保持稳定。为此,每间隔30 min用Na3AsO3基准溶液标定一次改进的碘标准溶液,共标定8次。标定结果见表4。由表4可知,8次标定的碘溶液的浓度非常接近,平均值为0.025 05 mol/L,平均相对误差为0.15%,相对标准偏差为0.62%,满足分析化学定量分析的要求[9],与Na2S2O3标定的碘溶液浓度(0.025 03 mol/L)非常接近。由此可知碘溶液B在240 min内具有很高的稳定性,完全可以满足实验的要求。
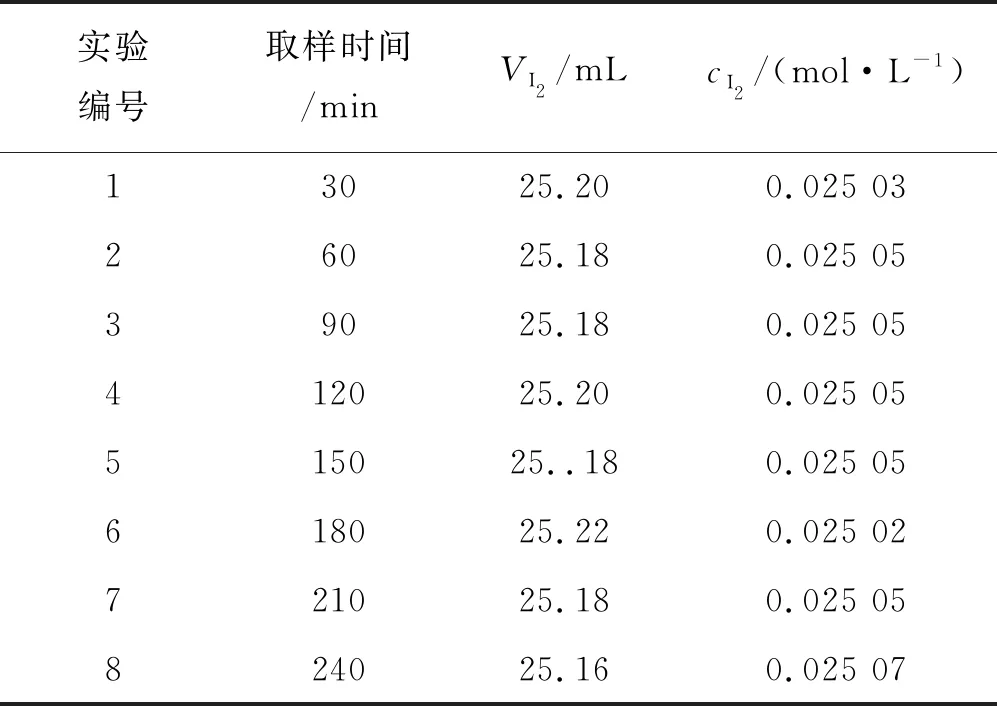
表4 碘标准溶液稳定性测试结果
2.3 碘标准溶液浓度的影响
分别用浓度为0.025 03 mol/L的改进碘标准溶液和教材所要求浓度为0.049 85 mol/L的碘标准溶液测定维生素片剂中Vc的含量[4],结果见表5。用浓度为0.025 03 mol/L和0.049 85 mol/L的碘标准溶液标定得出的WVc1的平均值分别为83.04 mg/(100 mg)和83.05 mg/(100 mg), Vc的含量无显著差异,也与样品实际值相符合,达到了实验教学目的。由于碘浓度减半,实验所产生含碘废物的量也随之减半。践行了节能减排,建设资源节约型和环境友好型“两型社会”的理念[10]。

表5 碘标准溶液浓度的影响
2.4 碘标准液浓度对果蔬Vc的影响
用浓度为0.025 03 mol/L改进的碘标准溶液测定果蔬中的Vc的含量,结果列于表6。从表6可以得出,WVc2的平均值为109.33 mg/(100 g),相对偏差为0.1%,满足相对偏差小于±0.2%要求。因此采用碘溶液浓度减半方法也同样适用于果蔬中Vc含量的测定。

表6 果蔬试样Vc含量的测定结果
3 结语
本文应用理论与实践相结合思想,采用“减量、减液”思路,对“维生素C制剂及果蔬中Vc含量测定实验”进行了改进。采用碱性条件下溶解固体碘,酸性条件下释放碘的方法,对配制碘标准溶液的方法进行了改进。该方法可以使碘的挥发量减少到原来的16.9%,降低了I2标准溶液配制过程对实验环境的污染。所配制的碘标准溶液在4h内浓度保持稳定,完全满足Vc含量测定实验的要求。改进后的实验降低了实验消耗,改善了实验室环境,减轻了实验室废水回收处理的压力,在获得良好的实验效果的同时培养了学生实验绿色化意识。这是一次成功把化学理论、实践教学、节能减排三者紧密结合探索与实践。

