超排处理对家兔生殖器官形态及激素水平的影响
王志亮,杨喜喜,铁雅楠,伏晓玉,王欣荣
(甘肃农业大学动物科学技术学院,兰州 730070)
胚胎移植(embryo transfer,ET)与超数排卵(superovulation)作为研究动物繁殖的重要技术,对缩短动物繁殖周期,提高生产力水平起到非常重要的作用[1-2]。目前对大部分动物进行超排处理时,常用的激素种类及组合有促卵泡素(follicle-stimulating hormone,FSH)+人绒毛促性腺激素(human chorionic gonadotropin,hCG)、FSH+促黄体素(luteinizing hormone,LH)+hCG、孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)+hCG、促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)、雌二醇(estradiol,E2)以及人绝经期促性腺激素(human menopausal gonadotropin,hMG)等[3]。各种激素因其自身特点在注射方式上也有所不同,由于FSH和LH在动物体内半衰期短,所以需要每天持续注射[4],而PMSG半衰期较长只需注射一次即可,但首次超排不如FSH、LH等内源性激素的效果好,重复超排效果却好于FSH等激素[5]。研究表明,家兔采用50 IU PMSG效果不如50 IU PMSG+50 IU hCG,表明PMSG+hCG联合的超排效果明显优于PMSG[6],在有效实现超数排卵的前提下,由于PMSG与hCG具有价格低廉、操作方便的优点,所以在生产中得到广泛的应用,也能取得很好的经济效益。有研究表明,在家兔上通过对35 IU hMG+100 IU hCG、10 IU FSH+100 IU hCG和80 IU PMSG+100 IU hCG 3种超排方式比较,发现PMSG+hCG组合超排效果较好,胚胎回收率最高[7]。通过对动物超排后激素变化的研究发现,激素处理能够引起动物内源性激素变化而改变动物生殖器官生理状态,达到较好的超排效果[8-9]。
影响超排的因素有很多,如季节、动物的年龄、体重、品种和饲养条件等均会对超排效果造成影响[10],但最主要的因素还是动物生殖系统对超排激素的反应情况。在超排过程中,通过多种激素的协同调节,会影响卵巢上卵泡发育的时间和数量,使多个卵泡在发育过程中能够抵抗闭锁发育成熟而排卵。超排方法主要有恒量法和递减法,有研究表明,对家兔注射40、 50、 60、 70、 80、 90 IU PMSG 1次,或10 IU FSH 6次恒量注射后再进行12.5~7.5 IU FSH 6次递减注射,结果表明只要剂量合适2种超排方法均可实现有效超排[11]。家兔属于常年发情、刺激性排卵的动物,使用超排处理可在短期内获取大量卵母细胞和胚胎。超排处理涉及到动物下丘脑等性腺轴上发生的一系列生理变化,包括生殖激素的调节与协同反馈、卵巢等不同部位的组织学改变等。现阶段主要研究不同超排剂量对超排处理和胚胎的获取与重复超排对动物繁殖性能的影响,而对超排后动物生殖器官组织形态学变化和内源性血清激素变化研究较少[12-13]。基于本课题组前期对激素用量的筛选(未发表),本研究用70 IU PMSG+100 IU hCG对家兔进行超排处理,通过生殖器官形态和生殖激素水平的变化来研究其影响,以揭示外源激素干预下家兔激素分泌的变化及生殖器官的组织学特点,以期为超排效果提供形态学和激素水平变化的理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 性成熟雌性家兔(伊拉肉兔品系)购自甘肃某养殖有限公司,购入后在甘肃农业大学动物实训基地进行饲养。经1周适应性饲养后,挑选12只体重大小一致的家兔分为2组,每组6只,单笼饲养,兔舍采用人工控温与光照,自由采食饮水,屠宰时体重为(3.38±0.01) kg。
1.1.2 主要试剂及仪器 PMSH和hCG均购自宁波第二激素厂;苏木精染液(武汉谷歌生物科技有限公司)、无水乙醇、二甲苯、盐酸和中性树胶均购自国药集团化学试剂有限公司;抑制素(inhibin,INH)、FSH、LH、孕酮(progesterone,P4)和E2激素测定试剂盒均购自上海酶联生物科技有限公司。石蜡切片机(RM2016)购自Leica公司;正置光学显微镜购自尼康公司;游标卡尺(0~500 mm)购自上海恒量量具有限公司,;自动脱水机(JJ-12J)、包埋机(JB-P5)和冻台(JB-L5)均购自武汉俊杰电子有限公司;组织摊片机(KD-P)和烘片机(KD-H)购自浙江金华科迪仪器设备有限公司。
1.2 方法
1.2.1 试验动物的处理及样品采集 将12只动物分为试验组和对照组,每组6只。给试验组家兔大腿内测注射70 IU PMSG,72 h后在相同位置注射100 IU hCG,对照组均对应注射等体积生理盐水。试验组和对照组家兔均采取与雄兔合笼刺激诱导排卵,合笼24 h处死采集卵巢、输卵管、子宫等样品,现场测量各样品物理参数后,4%多聚甲醛固定。分别在注射PMSG前、注射hCG前及处死前采集对照组和试验组家兔耳缘静脉血,3 000 r/min离心5 min,吸取上层血清于-20 ℃保存备用。
1.2.2 生殖器官物理参数测量 用游标卡尺测量卵巢的长、宽和厚,输卵管长、输卵管壶腹部、峡部及漏斗部的宽度,子宫的长度、宽度、周长及子宫壁的厚度,并统计排卵点数及充血卵泡数。
1.2.3 组织切片的制备 对家兔生殖器官的物理数据测量后,将卵巢、输卵管和子宫分离,在4%多聚甲醛中固定24 h后,对卵巢进行修块,经二甲苯、梯度乙醇脱水、浸蜡、包埋、切片、摊片、沾片、烤片、二甲苯脱蜡、苏木精染色、盐酸分化、水洗、伊红染色、梯度乙醇脱水、二甲苯透明、中性树胶封片,将制备好的卵巢切片置于显微镜下镜检,选取3个以上不同视野进行拍照并采集照片,运用Image-Pro Plus 6.0软件测量卵泡直径和卵母细胞直径。
1.2.4 血清激素测定 按照试剂盒说明书采用ELISA法测定血清中INH、FSH、LH、P4和E2含量。
1.3 数据统计分析
激素测定数据用Excel 2010统计,用SPSS 25.0进行独立样本t检验分析,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 超排对卵巢组织形态的影响
家兔卵巢呈纺锤形,质感较硬不易变形,表面有大小不等的卵泡突出,经超排处理后卵巢体积明显变大,表面卵泡、充血卵泡和排卵点增多(图1)。与对照组相比,试验组卵巢重量、长度、宽度和厚度均极显著增加(P<0.01);卵巢上的排卵点数、充血卵泡数、闭锁卵泡数均极显著增多(P<0.01)(表1)。通过对卵巢切片的观察发现,超排后家兔卵巢皮质内有大量的卵泡发育,而对照组发育卵泡数量相对较少,同时2组都有一定数量的黄体存在,且试验组的黄体数量较多,而对照组中可见的黄体数量较少且已经发生退化(图2)。
2.2 超排对卵泡和卵母细胞的影响
由表2可知,与对照组相比,除次级卵泡直径显著减小外(P<0.05),其他各级卵泡的直径均差异不显著(P>0.05),卵泡内卵母细胞的直径差异也不显著(P>0.05)。
由图3可知,无论是否有超排处理,家兔卵巢的组织学特征相似,即随着卵巢皮质表层大量原始卵泡的发育,其周围出现了单层卵泡细胞层,此时原始卵泡发育为初级卵泡,随后出现透明带而发育为次级卵泡,之后随着卵泡腔的出现则发育为三级卵泡,并几乎占据整个皮质层。在卵泡发育的各个阶段大部分卵泡发生闭锁,且腔前卵泡和有腔卵泡有着不同的闭锁方式,仅有少部分优势卵泡发育为成熟卵泡并排卵。

A,对照组;B,试验组A,Control group;B,Experimental group图1 各组卵巢形态观察Fig.1 Observation of ovary morphology in each group
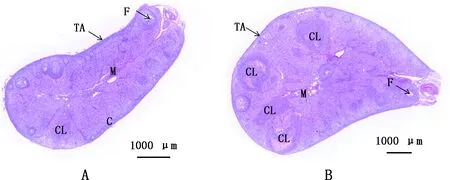
①A,对照组;B,试验组。②TA,白膜;C,皮质;M,髓质;F,卵泡;CL,黄体①A,Control group;B,Experimental group.②TA,Tunica albuginea;C,Cortex;M,Medulla;F,Follicle;CL,Corpus luteum图2 各组卵巢组织形态(100×)Fig.2 Ovarian tissue morphology in each group (100×)

表2 各组不同级别卵泡和卵母细胞直径

PRF,原始卵泡;PF,初级卵泡;SF,次级卵泡;PO,初级卵母细胞;ZP,透明带;IC,间质细胞;FA,卵泡腔;SG,颗粒层;TFI,卵泡内膜;TFE,卵泡外膜;AF,闭锁卵泡PRF,Primitive follicles;PF,Primary follicle;SF,Secondary follicle;PO,Primary oocyte;ZP,Zona pellucida;IC,Interstitial cells;FA,Follicular cavity;SG,Stratum granulosum;TFI,Theca folliculi intern;TFE,Theca folliculi externa;AF,Atresia follicles图3 各组不同级别卵泡组织形态Fig.3 The histological morphology of follicles of different grades in each group
2.3 超排前后子宫和输卵管的组织形态学变化
由表3可知,与对照组相比,试验组输卵管长度和壶腹部宽度均显著增加(P<0.05),漏斗部宽度极显著增加(P<0.01)。由表4可知,与对照组相比,试验组子宫长度极显著增加(P<0.01),子宫宽度显著增加(P<0.05);子宫周长和子宫壁厚小于对照组,但差异均不显著(P>0.05)。
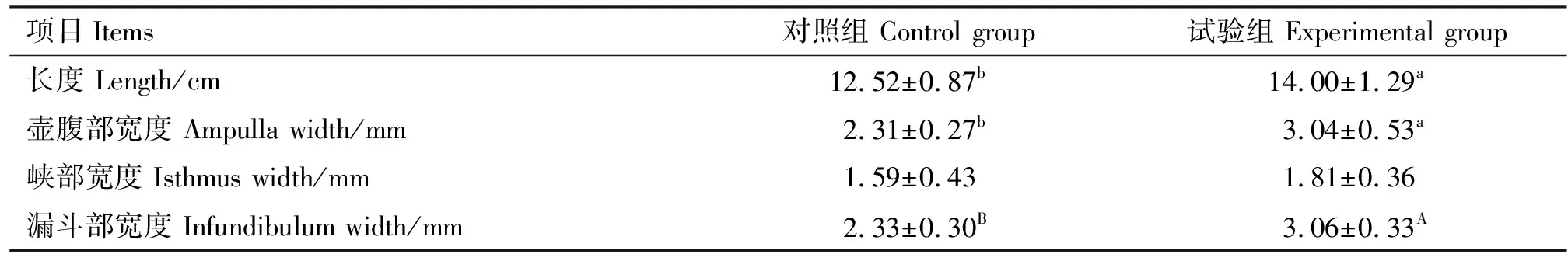
表3 输卵管物理参数测定结果

表4 子宫物理参数测定结果
2.4 超排前后生殖激素水平的变化
对照组家兔血清INH水平随处理时间延长呈递增趋势,与对照组相比,在注射PMSG前和hCG前试验组INH含量均显著降低(P<0.05)(图4A);与对照组相比,在注射hCG前试验组FSH含量显著增加(P<0.05),处死前FSH显著降低(P<0.05)(图4B);试验组血清中LH无明显变化,对照组血清中LH含量先降低后上升,且注射hCG前和处死前试验组LH含量均显著高于对照组(P<0.05)(图4C);试验组与对照组血清中P4含量变化均不明显,但都有下降趋势,且2组间差异不显著(P>0.05)(图4D);对照组血清中E2含量呈现先增后减的变化趋势,而在试验组中基本无变化,且2组间差异不显著(P>0.05)(图4E)。

①Ⅰ,注射PMSG前;Ⅱ,注射hCG前;Ⅲ,处死前。②*,差异显著(P<0.05);无*,差异不显著(P>0.05)①Ⅰ,Before the injection of PMSG;Ⅱ,Before the injection of hCG;Ⅲ,Before the slaughtering.②*,Significant difference(P<0.05);No *,No significant difference(P>0.05)图4 血清激素INH(A)、FSH(B)、LH(C)、P4(D)和E2(E)在不同时期的含量Fig.4 Contents of serum hormone INH (A),FSH (B),LH (C),P4 (D) and E2(E) in different periods
3 讨 论
3.1 超排处理对家兔生殖器官形态及组织学特征的影响
相较于FSH、LH等激素超排方案,PMSG与hCG价格低廉且操作方便[14]。PMSG能够促使卵巢中卵泡快速发育,而与卵母细胞一起构成卵泡的体细胞(卵泡细胞、颗粒细胞和内膜细胞)的分化则是其生长的主要原因[15]。本研究结果表明,在卵泡发育过程中,外源激素的处理对大多数卵泡直径无影响,但能显著减小次级卵泡的直径。Downs[16]研究表明,PMSG可以促使卵巢中卵泡的同步发育,能够使次级卵泡快速发育成三级卵泡,说明PMSG主要作用于生长卵泡的发育,但对卵泡内的卵母细胞大小无显著影响。本研究发现,试验组卵巢中有大量的闭锁卵泡,且各级闭锁卵泡的组织结构不完全相同。在闭锁的原始卵泡中,卵母细胞会先塌缩退化后消失,初级卵泡和次级卵泡闭锁形式为透明带塌缩以及卵母细胞核固缩后消失。而在闭锁的有腔卵泡中,首先卵母细胞退化消失,随后颗粒细胞逐渐充满整个卵泡腔后致密化,最后颗粒细胞凋亡消失。有研究指出,小尾寒羊生长卵泡的闭锁有2种形态,一种是实心卵泡,另一种是囊状卵泡[17]。这与本研究观察到的家兔卵泡的闭锁方式有所不同。在东北虎的卵巢中,卵泡闭锁体现在卵母细胞退化消失,透明带松散褶皱,颗粒细胞间疏松结合超1/3[18]。研究显示,东北梅花鹿卵泡的闭锁主要有2种类型,第一种普遍发生于原始卵泡、初级卵泡和次级卵泡中,表现为卵母细胞发生退行性变化,是卵泡闭锁的主要形式;第二种主要发生于三级卵泡中,表现为卵泡细胞核致密化,细胞质空泡化并瓦解[19]。在本研究中家兔卵泡的闭锁状态与梅花鹿的相似,即在无腔卵泡和有腔卵泡中存在2种闭锁类型,但不同物种之间不同类型的闭锁差异的具体原因尚需进一步研究。另外本研究也显示,对照组中的闭锁卵泡数少于试验组,这可能是超排处理使卵泡大量发育的同时,卵泡的闭锁也有所增加所致。
PMSG能够使动物卵巢中卵泡大量发育生长,卵巢基质增加[20],使得卵巢体积增大,重量增加。本研究观察到,与对照组相比,试验组卵巢的皮质和髓质中的细胞数量多且排列紧密,另外结缔组织和血管也表现出增多和变大的趋势。胡鹏飞等[21]的研究发现,4 IU PMSG处理对小鼠子宫的增大也有影响,本研究也检测到输卵管和子宫在处理前后有部分形态发生显著变化。因此,本研究通过70 IU PMSG+100 IU hCG的激素组合对家兔进行超排处理,会对家兔卵巢的形态及组织学特征产生一定的影响,如卵巢增大、排卵点以及黄体数目增多等,且对输卵管、子宫大小也有影响,但对成熟卵泡和卵母细胞的直径没有显著影响。
3.2 超排处理对家兔血清生殖激素分泌的影响
INH是抑制垂体促性腺激素细胞分泌FSH的主要调节因子之一。在促性腺激素的作用下,卵巢颗粒细胞和膜细胞合成并分泌INH[22-23]。Meng等[24]研究发现,卵泡内抑制素的表达水平取决于卵泡的发育阶段,说明INH是卵泡发育能力的重要影响因子。在新发育的优势卵泡中分泌的抑制素B(INHB)具有2个功能[25]:一是负反馈调节垂体分泌FSH,二是与LH局部协同作用,增加膜细胞分泌雄激素的能力[26]。在雌性动物的发情周期,垂体分泌的LH通过血液循环到达卵巢,协调垂体分泌的FSH刺激卵母细胞和卵泡发育,促进雌激素的分泌释放,在形成LH峰后促进排卵[27]。PMSG具有FSH相似的功能,能够促进卵泡的发育,且具有LH的部分功能,能够促进卵泡排出和黄体的形成。本研究中,在PMSG注射后INH一直呈递减趋势,且在注射hCG后显著低于对照组,说明超排处理使INH浓度降低,INH对FSH的分泌抑制作用减小,PMSG和hCG与INH协同作用促使FSH升高,刺激更多卵泡成熟,使卵巢能够排出大量成熟卵母细胞,促进卵巢颗粒细胞的增生和雌激素的分泌,在卵母细胞排出后FSH浓度会发生下降[28],而家兔为刺激排卵动物,试验组在注射完hCG交配后刺激卵母细胞排出与外源性激素反馈影响FSH浓度迅速下降。而PMSG和hCG均有类似LH的作用,与自身LH共同作用从而导致LH处于较高浓度并发生了钝化,但LH浓度一段时间内仍然维持相对较高的水平,说明处理也能够起到延长妊娠的作用。
卵巢内雌激素主要分泌部位为卵泡的颗粒细胞,主要包括E2和雌酮,而且两者可互相转化。雌激素通过对下丘脑的反馈作用,调节促性腺激素释放激素和促性腺激素分泌,在促进卵泡发育,调节发情周期起重要作用[28]。有研究发现,PMSG超排处理猪后其E2在72 h之前缓慢增长,在72 h达到最高,随后浓度降低[29],本研究在家兔中也发现了类似的结果,但与对照组相比差异不显著。孕酮主要来源于卵巢的黄体细胞,其中P4是孕激素中活性最高的,也是雌激素和雄激素的共同前体。有研究表明,对水牛和猪注射PMSG超排后,P4浓度会降低[29-30],本试验结果与水牛和猪上的结果一致,说明超排处理对孕酮水平的降低作用是一致的,但降低程度因物种而异。由此可见,采用70 IU PMSG+100 IU hCG激素组合对家兔进行超排处理对E2和P4的分泌量并不会产生显著影响。
4 结 论
用70 IU PMSG+100 IU hCG的激素对兔进行超排处理,可使卵巢体积增大、表面的排卵点数增多,黄体和闭锁卵泡数目增多,血清中INH浓度降低、FSH和LH浓度升高,且外源性与内源性激素协同作用于卵巢,实现稳定的超排效果。

