不同浓度氯化钾对小鼠早期胚胎体外发育的影响
王秋月,王美亚,于芳芳,白璐佳,李文雍,张 迪
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
钾离子是生物体内必不可少的离子之一,也广泛存在于动物机体各处。钾离子对维持细胞稳态、维护心脏正常功能、保持渗透压和酸碱平衡、维持新陈代谢和神经肌肉的应激性等方面具有十分重要的作用[1,2]。钾离子在早期胚胎发育过程中也有十分重要的作用。哺乳动物输卵管和子宫液的元素组成分析显示,体内早期胚胎微环境中钾离子保持较高的浓度[3,4]。在胚胎体外培养研究中所使用到培养液中,除去氨基酸、葡萄糖等一些为早期胚胎发育提供能量的物质外,其余成分主要是包括钠、钾和钙等在内的多种盐类,盐在水溶液中解离为相应的离子。已知离子在细胞中具有非常广泛的作用,对大量的细胞生理过程至关重要,其主要功能是建立特定地细胞内环境[5]。目前,商品化胚胎培养液中都含有6 种无机离子,分别是:Na+、K+、Cl-、Ca2+、Mg2+和SO42-[3,5]。这些培养液的共同特点是含有高浓度的Na+和Cl-。高浓度Na+的主要功能是维持培养液的渗透压,Ca2+作为关键的信号,它的异常存在会严重干扰胚胎生长和发育[6,7];然而,对于K+的角色和功能还不清楚。
早期研究表明哺乳动物输卵管液中含有较高浓度的K+和Cl-。但目前广泛使用的胚胎培养液中K+浓度一般都较低(见表1),其范围在0.6 mM~6.0 mM[8-13],远低于输卵管液中的钾离子浓度(10.5~16.5 mM)。虽然K+在早期胚胎发育过程中的作用尚不清楚,但K+参与糖和蛋白质代谢,因此可以确定K+在物质转运、能量代谢等多种生理活动中起作用。一项对牛体外胚胎发育的研究表明,当胚胎培养体系中不含K+时,胚胎的卵裂率和囊胚发育率会受到严重影响,这表明K+对于维持早期胚胎的正常发育是必需的[14];但其它研究表明,当猪胚胎在低K+浓度(0.6 mM)培养时,早期胚胎的卵裂率可以得到提高并加快囊胚腔的形成[15]。

表1 常见胚胎培养液中K+浓度比较
研究发现K+通道是细胞中种类最多的离子通道家族[16,17]。当细胞外K+浓度发生改变时,膜两侧钾离子浓度也随之变化,随之影响细胞膜的极化状态,进一步影响细胞的电活动和膜表面各种离子通道的开闭。离子通道在受精卵和胚胎发育中扮演十分重要的角色,它们的活性在整个卵裂早期阶段都受到动态变化的影响,细胞可以根据其生理需要表达和重新分配离子通道[18-20]。钾离子通道在胚胎发育过程中起着重要的作用,钾离子通道活性的改变会引起膜电位的改变,进而在细胞水平调节配子成熟、受精、细胞分裂和早期胚胎发育等生理功能[21]。对于所有类型的细胞来说,膜电位在细胞生长和分化过程中起着关键作用[22]。因此,对早期胚胎来说,如果其膜电位在发育早期出现较大的改变,则可能会影响胚胎的发育。
1 材料与方法
1.1 实验动物
本实验使用SPF 级6-8 周龄雌性昆明白(KM)小鼠,8-10 周龄KM 雄性小鼠,均购自安徽医科大学实验动物中心,动物实验均按照阜阳师范大学实验动物福利与伦理委员会的指导方针进行。小鼠饲养在清洁级动物饲养间,温度为22~26℃,湿度为55±5%,12h 光控,提供灭菌饲料和水。
1.2 实验试剂
实验中主要使用到的试剂有:胚胎培养级纯水购自Hyclone;注射用孕马血清促性腺激素(pregnant mare timulationgonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)购自宁波第二激素厂;生理盐水购自国药;膜电位敏感荧光染料DiBAC4(3)(美国Sigma公司),Hoechst 33342(碧云天);其他药品若无特殊说明,均购自Sigma。
胚胎培养所需培养液:小鼠输卵管培养液(HTF)、胚胎操作液(M2)、胚胎培养液(KSOM)按《小鼠胚胎操作实验手册》中配方配制[13]。
1.3 主要仪器
二氧化碳培养箱(美国Thermo,3141),小型台式高速冷冻离心机(德国Eppendorf,5417R),分析天平(梅特勒,XS205DU),超净工作台(苏州净化,SW-CJ-2E),药品恒温冷藏柜(SANYO,MDR-411FR),体式显微镜(日本尼康,SMZ745T),激光扫描共聚焦显微镜(德国Leica,TCSSP5Ⅱ)等。
1.4 实验方法
1.4.1 体外胚胎的获得
8 周龄昆明白雌鼠腹腔注射PMSG 10 IU,48 h 后,腹腔注射HCG 10 IU 进行超数排卵,12 小时后处死雄鼠取附睾尾,放入提前孵育的HTF 中,用解剖剪在附睾尾中部剪一小口,让精子自然流出并观察精子活力,之后放入37℃、5%的二氧化碳培养箱中使精子获能2 小时。注射HCG 后13~14 小时,处死雌鼠,取其输卵管,在体式显微镜下撕开其膨大的壶腹部获取卵丘卵子复合体,将其放入提前孵育4~6 小时的HTF 中获能;卵子获能1.5 小时后,取70 μL 精子悬液加到盛有卵丘复合体的HTF 培养液中,轻轻晃动培养板并放回37℃、5%二氧化碳培养箱中继续培养4~6 小时后,将培养板从培养箱中取出,用M2 操作液清洗多次去除多余的精子和颗粒细胞,挑出有双原核的受精卵进行培养。
1.4.2 胚胎培养
将受精卵分别移至2.5 mM KCl(对照组)和0 mM KCl、12.5 mM KCl、50 mM KCl 组的胚胎培养液中。对照组培养液为体外培养通用的KSOM培养液,其KCl 浓度为2.5 mM。将培养板置于37℃、5%二氧化碳培养箱中继续培养,在各个时期进行观察并对各组胚胎发育状况进行统计。
1.4.3 胚胎细胞膜电位染色
在胚胎发育早期,实验中选用原核期的胚胎,取正常培养的胚胎,进行染色并观察荧光强度改变情况。取对照组胚胎,首先在Hoech st33342 中进行核染5 分钟,之后将胚胎用M2 操作液清洗几遍,洗去多余的染料,然后将胚胎放入膜电位敏感荧光染料DiBAC4(3)中染色10 分钟,立即在激光共聚焦显微镜下观察染色情况并拍照。对照组胚胎在染过DiBAC4(3)后,立即转移到实验组中观察其染色情况并拍照,对照组和实验组胚胎均连续观察30 分钟。
2 结果与分析
2.1 不同浓度氯化钾对小鼠早期胚胎发育的影响
在体外胚胎培养分析中,分别使用含有0 mM、2.5 mM、12.5 mM 和50 mM 氯化钾的培养液进行早期胚胎培养,探究氯化钾对胚胎早期发育的影响。在实验中,2.5 mM 钾离子浓度是体外培养实验中通用的浓度,在本实验中被用作对照组;而0 mM 钾离子的培养液是指在体外培养中不添加氯化钾;12.5 mM 和50 mM 是指培养液中总氯化钾浓度分别为12.5 mM 和50 mM。
小鼠早期胚胎在不同浓度氯化钾条件下的发育情况如图1 所示。与体外培养液通用的标准浓度(2.5 mM)相比,在0 mM 和50 mM 条件下的胚胎发育情况明显阻滞。对小鼠早期胚胎各时期发育情况的统计分析如表2 所示,从各阶段发育率可以看出,0 mM 浓度下只有极少部分胚胎可以发育至2-Cell 时期,且在发育至2-Cell 期之前已有部分胚胎死亡,表明早期胚胎发育中氯化钾的存在是必要的;而12.5 mM 的氯化钾浓度支持胚胎发育到囊胚阶段,但在各个时期的发育率与对照组相比也都有一定程度的下降;在50 mM 的氯化钾浓度存在下,其2-Cell 的发育率相较于12.5 mM 的有所上升,但其4-Cell 发育率急剧下降,且多数阻滞在2-Cell 阶段,只有极少一部分可以发育至4-Cell。从12.5 mM 和50 mM 氯化钾浓度的发育情况来看,原核期高浓度的氯化钾有助于胚胎发育至2-Cell 时期,但之后较高浓度的氯化钾会使胚胎的发育率有所降低。因此,可以发现早期胚胎对钾离子浓度的需求在各个阶段是不同的。
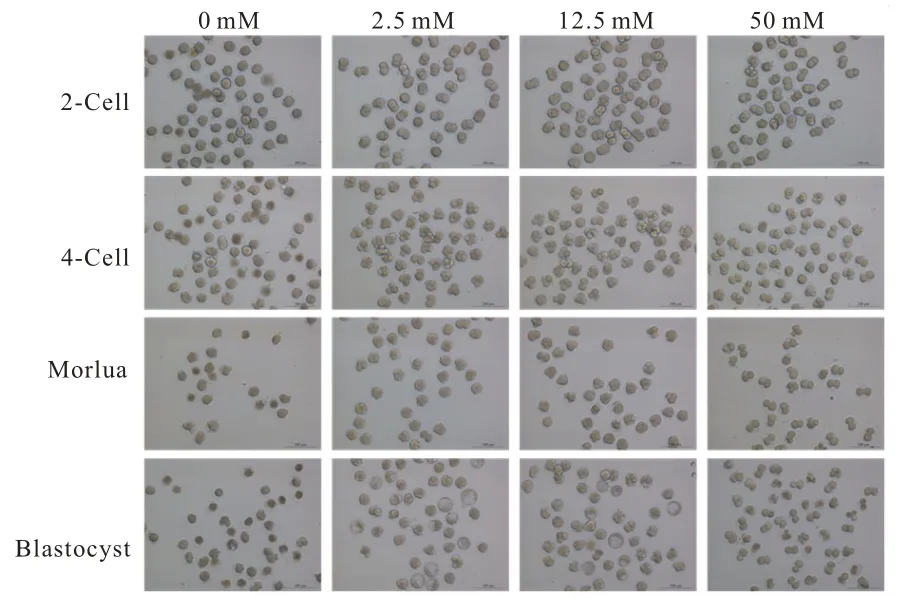
图1 小鼠早期胚胎在不同浓度氯化钾条件下的发育情况统计

表2 不同浓度氯化钾对小鼠早期胚胎发育情况统计
2.2 高浓度KCl 对小鼠原核期胚胎细胞膜电位的影响
细胞膜在维持细胞生理和稳态中起着重要作用,特别是细胞膜电位对细胞稳态的维持和细胞内外信号的传导发挥关键作用。对于所有细胞来说,膜电位在细胞生长和分化过程中起关键作用,控制一系列的细胞功能。膜电位是通过细胞内外介质之间的离子浓度的差异来维持的[22],参与维持细胞膜电位的细胞内离子主要是钾离子和钠离子[6]。膜电位通常维持在一个恒定的范围内,基本没有太大的波动,稳定的膜电位被认为是反映细胞活力和细胞代谢活性的重要参数。干扰早期胚胎的膜电位可能会导致细胞极性的分布不均匀,并影响囊胚腔的形成[23]。因此,采用DiBAC4(3)法对原核期的胚胎进行染色[24],观察高浓度的钾离子对原核期胚胎细胞膜电位的影响。DiBAC4(3)是一种电压敏感的膜电位荧光染料,其本身并无荧光,当进入细胞后与胞浆内的蛋白质结合后才会发出荧光。DiBAC4(3)进入细胞,细胞内荧光强度增加即表示膜电位增加,表示细胞去极化;反之,荧光降低则膜电位降低表示细胞超极化。
如图2 所示,用DiBAC4(3)对原核期胚胎进行染色,然后观察其染色情况。图2(a)是前五分钟时细胞膜荧光强度变化情况,从图中可以看出来,对照组胚胎基本没有什么变化,而在150 mM的氯化钾溶液中可以看到在刚转移时就观察到增亮的荧光强度,这种增加在前五分钟内一直持续;图2(b)显示的是从刚转移到溶液中时一直持续观察30 min 的情况,从图中可以观察到对照组胚胎在30 min 内荧光强度基本没有变化,而在实验组中观察到胚胎在前15 分钟荧光强度在持续增强,15 分钟后基本维持与15 分钟时近似的亮度。

图2 原核期胚胎DiBAC4(3)染色。(a)5 min 染色情况;(b)30 min 染色情况。
应用Image pro plus 对荧光强度进行处理,换算出其平均荧光强度,对每个时间点胚胎膜电位的变化进行量化,电位变化趋势如图3 所示。如图3(a)所示,前五分钟对照组胚胎细胞膜电位基本不变,实验组胚胎可以看出细胞膜电位明显上升;在图3(b)中可以看到,30 min 内对照组胚胎细胞膜电位基本维持不变,而实验组胚胎细胞膜电位在15 min 时最高,之后趋于平稳,但整体还是明显高于对照组。

图3 原核期胚胎细胞膜电位变化情况。(a)5 min 膜电位变化情况;(b)30 min 膜电位变化情况。
3 讨论
体外胚胎培养是研究胚胎发育的重要方法。当胚胎在适当的培养体系中进行培养时,早期胚胎的发育效率会得到很大的提高,且发育良好的胚胎对后续的着床也非常必要。当早期胚胎在体外培养时,如处于不适合的培养环境中则会在多方面对胚胎的发育造成影响,比如影响基因表达、生长代谢、甚至引起细胞凋亡。目前,商品化的胚胎培养液成分中含有的适当浓度的无机盐离子,可以很好地维持细胞渗透压并促进胚胎的发育,但这些离子成分的浓度设定更多的是依靠经验获得,尚缺少必要的理论研究为依据。因此,有很多胚胎发育中出现的问题,甚至在人类辅助生殖中遇到的胚胎质量问题一直没有办法解决,其原因就在于对包括钾离子在内的培养液各成分对胚胎的真正角色和影响机制所知甚少。本研究中虽然通过改变培养液中钾离子浓度来探索其对哺乳动物胚胎发育的影响,但目前研究数据无法得出哺乳动物胚胎进行体外培养时发育率最高时钾离子的确切浓度,且KSOM 培养液中钾离子浓度是经过长期体外培养实验得来的数据,对KSOM 培养液在短期内我们可能无法提出改良和建议,但从研究中我们可以得出小鼠早期胚胎在体外发育时与体内发育相比是一个低钾的环境。
本研究通过改变胚胎培养液中KCl 浓度来探索其对小鼠早期体外胚胎发育的影响。结果表明KCl 的浓度是影响小鼠早期胚胎发育的关键条件之一。从各阶段胚胎的发育率来看,胚胎的每个发育阶段对钾离子的需求也不相同。早期研究认为囊胚形成过程是一个需要高钾浓度的阶段[21],而在更早期的卵裂过程中,胚胎可能并不需要大量的K+,因为高浓度的钾离子甚至抑制胚胎发育到4-Cell 期。K+在维持细胞膜电位中有着不容忽视的作用,钾离子通道的开放与关闭与细胞膜电位有着密切的关系。过量的K+可能通过影响跨细胞膜离子流对胚胎早期细胞膜电位产生改变,并且高浓度的K+通过改变胚胎细胞的渗透压而对胚胎产生影响,最终干扰胚胎的正常发育,甚至导致胚胎的死亡。因此,本研究为早期胚胎体外培养时培养液中钾离子浓度使用的准确性,提供更详实的数据支持。

