Slc9a1 基因在小鼠植入前胚胎发育过程中的作用研究
陈雪雪,明欣,刘新栎,唐俊义,李文雍,张尚荣
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
钠氢交换体(Na+/H+exchanger,NHE)是一种真核细胞广泛表达的膜结合蛋白家族,可介导一种细胞外Na+与一种细胞内H+的电中性交换,并促进各种功能,参与多种过程,包括细胞体积稳态[1]、渗透稳态[2]、细胞增殖[3,4],以及细胞凋亡[5],另外还发现其也在细胞周期调节、细胞运动迁移等细胞过程中产生作用,其表达和功能改变可引起心脏病和癌症等病理性疾病[6,7]。NHE 家族包括9个亚型,根据发现的顺序命名为NHE1-9,每个亚型表现出独特的组织分布和功能特征[8,9],其中NHE1-5 位于质膜,而其他几种异构体定位于细胞内细胞器。NHE1(人中由SLC9A1编码,小鼠中由Slc9a1编码)是普遍存在的异构体,几乎存在于所有类型的细胞中,其功能是所有亚型中研究最广泛的。最近的研究表明,J 亚群禽白血病病毒的复制依赖于鸡1 型钠氢交换体,编辑病毒受体的基因可能会对这种病毒及其相关疾病产生抗性[10]。同时,NHE1 在不同的肿瘤组织中广泛表达,在肿瘤细胞的生长、分化、细胞运动性和转移等起着重要的作用[11,12]。在低氧癌细胞中,NHE1定位于侵袭性足细胞,通过表达和激活p90 核糖体S6 激酶(p90RSK)促进侵袭性足细胞的形成。同时,NHE1 可以通过控制细胞周期的蛋白水解活性来影响侵袭功能[13]。
本研究主要评估Slc9a1在小鼠植入前胚胎发育过程中的可能作用。首先收集小鼠各期体内胚胎,利用RTqPCR 研究Slc9a1mRNA 在植入前胚胎发育各时期的表达情况;然后通过显微注射利用RNAi 技术构建Slc9a1胚胎敲低模型,研究其敲低对胚胎囊胚发育率、囊胚期胚胎的谱系分化以及p53和p21表达水平的影响,阐明其在植入前胚胎发育过程中的作用,为进一步揭示Slc9a1在植入前胚胎发育中的调节机制奠定基础。
1 实验材料和方法
1.1 实验动物
本实验所需实验动物为SPF 级6-8 周龄C57BL/6J 雌性小鼠与8-10 周龄DBA 雄性小鼠的子一代BDF1 小鼠。C57BL/6J 小鼠购自安徽医科大学实验动物中心。保持12 小时光控周期,温度控制在20~25℃,相对湿度50%~70%。实验鼠的使用严格遵循阜阳师范大学动物管理委员会以及《实验动物管理条例》的规定。
1.2 实验试剂
主要试剂有:胚胎培养液(EmbryoMax KSOM,Sigma),胎牛血清(FBS,Hyclone),小鼠胚胎操作液(M2,Sigma),PCR 试剂盒(RT-PCR Kit,TaKaRa),胚胎获能夜(HTF,Sigma),Cdx2 抗体(anti-CDX,BioGenex)、Oct4 抗体(anti-Oct4,Abcam),抗兔二抗(Donkey anti-Rabbit,Thermo Fisher),抗山羊二抗(Donkey anti-Goat,Thermo Fisher),DMEM 培养基(Gibco),谷氨酰胺(1x Gluta-MAX,Thermo Fisher)等。
1.3 实验设备和仪器
主要的实验仪器和设备有:体式显微镜(SMZ745T,日本尼康),显微操作系统(DMIL+DFC 数字冷CCD,Narishige)三气培养箱(3141,Themo),激光扫描共聚焦显微镜(TCS SP5 Ⅱ,Leica),定量PCR 仪(StepOnePlus,ABI)等。
1.4 实验方法
1.4.1 体内各期胚胎的收集
取8-10 周龄的BDF1 雌鼠腹腔内注射10 IU PMSG,48 h 后注射相同剂量的HCG,随即与10周龄BDF1 雄鼠合笼使其自然交配,合笼比例1:1,22.5 h 后分笼检栓,以见栓时间为E0.5,检栓后待用。之后按照胚胎发育各时期时间节点收集各期体内胚胎备用。
1.4.2 实时荧光定量PCR(RT-qPCR).
使用CellAmp ™Direct Prep Kit for RT-PCR(Real Time)&Protein Analysis(TaKaRa)试剂盒进行样本胚胎RNA 收集,按照One Step SYBR®PrimeScriptTMPLUS RT-PCR Kit(Perfaect Real Time)(TaKaRa)试剂盒使用说明书,根据实验需求配制扩增体系,之后按照荧光定量仪器上提前预设程序进行实时定量PCR(qPCR),以Gapdh 为内参。本研究所需引物序列如下表1。

表1.RT-qPCR 引物序列
1.4.3 RNAi 干扰
选择RNAi 干扰技术构建小鼠胚胎基因敲低模型。将用于基因敲低的siRNA 吸入到注射针,通过显微操作注射到原核胚胎的胞浆内,实现目的基因的敲低。对照组(Control)胚胎使用同样注射方法注射非特异性siRNA。对照组和实验组分别进行体外培养至囊胚期。收集部分时期胚胎细胞通过RT-qPCR 进行敲低效率的验证。本研究使用的siRNA 干扰序列如下表2。

表2 siRNA 干扰序列
1.4.4 胚胎培养和囊胚发育率统计
将对照组和实验组胚胎移至胚胎培养液中,在5% CO2,37℃的二氧化碳培养箱中培养至囊胚,记录胚胎每一发育阶段的形态并做好统计。
1.4.5 Outgrowth
将囊胚收集并转移到含有10%胎牛血清和1x GlutaMAX 的DMEM 培养滴的培养皿中,置于培养箱(37℃,5%CO2),连续培养3 天,记录胚胎的形态及贴壁情况并做好统计。
1.4.6 谱系分化免疫荧光共聚焦检测
通过间接免疫荧光实验检测囊胚中Oct4 和Cdx2 的表达情况[14]。对照组和实验室分别选取形态相似的囊胚20 枚,4%多聚甲醛中固定,室温30 min;清洗后放入0.5%Tritonx-100 室温放置2 h;然后分别在1% BSA 中清洗数遍,加入1%BSA 中37℃、5% CO2培养箱中封闭1 h;将相应的抗体用1%BSA 稀释,将受精卵及发育至各阶段的细胞分别转移至抗体中,4℃冰箱中放置过夜;分别于1%Tween20+0.2%Tritonx-100 滴中清洗数遍,转移至二抗,37℃避光放置1 h;分别移至DAPI 中染色,室温避光放置10 min,清洗数遍,抗淬灭剂覆盖,压片拍照后使用共聚焦显微镜来获得荧光图像,使用Image Pro-Plus 6.0 软件进行荧光强度分析。
1.4.7 统计分析
每个实验至少重复三次,采用SPSS16.0 对各期胚胎形成率差异进行分析。所有数据均表示为均值±s.e.m。数据采用t 检验,*P<0.05,有统计学差异,**P<0.01,有显著性差异,***P<0.001,有极其显著差异。
2 结果与分析
2.1 Slc9a1 mRNA 在小鼠植入前胚胎中的表达分析
为了确定Slc9a1在小鼠植入前胚胎中的表达情况,采用qPCR 方法检测了胚胎不同发育阶段Slc9a1基因转录水平。根据RT-qPCR数据图(图1A)可以看到,Slc9a1表达水平在成熟期卵母细胞(MII)和合子期(Zy)表达量最高,尤其是Zy 期表达量最高,而2 细胞期(2C)到囊胚期表达量总体呈递减趋势,其中8 细胞期(8C)期较四细胞期(4C)表达量增加,桑葚期(Mo)表达量最低。
2.2 Slc9a1 敲低胚胎模型的建立
本实验利用RNAi 干扰技术,结合显微注射技术,建立Slc9a1基因敲低小鼠胚胎模型。注射Slc9a1siRNA 为实验组。对照组胚胎使用同样注射方法注射非特异性siRNA。根据预先设计的siRNA1,siRNA2 和siRNA3 分别作为三组实验组进行显微注射。并对对照组和实验组胚胎分别进行体外培养至囊胚期。收集桑椹胚时期的对照组和实验组胚胎进行RT-qPCR 检测Slc9a1mRNA水平,筛选出siRNA1 作为Slc9a1基因敲低的siRNA 沉默序列。定量结果显示实验组胚胎Slc9a1mRNA 表达水平相对于对照组显著降低(如图1B),表明通过显微注射方法可以将胚胎中Slc9a1敲低,可以利用此技术深入研究其在植入前胚胎发育过程中的作用。
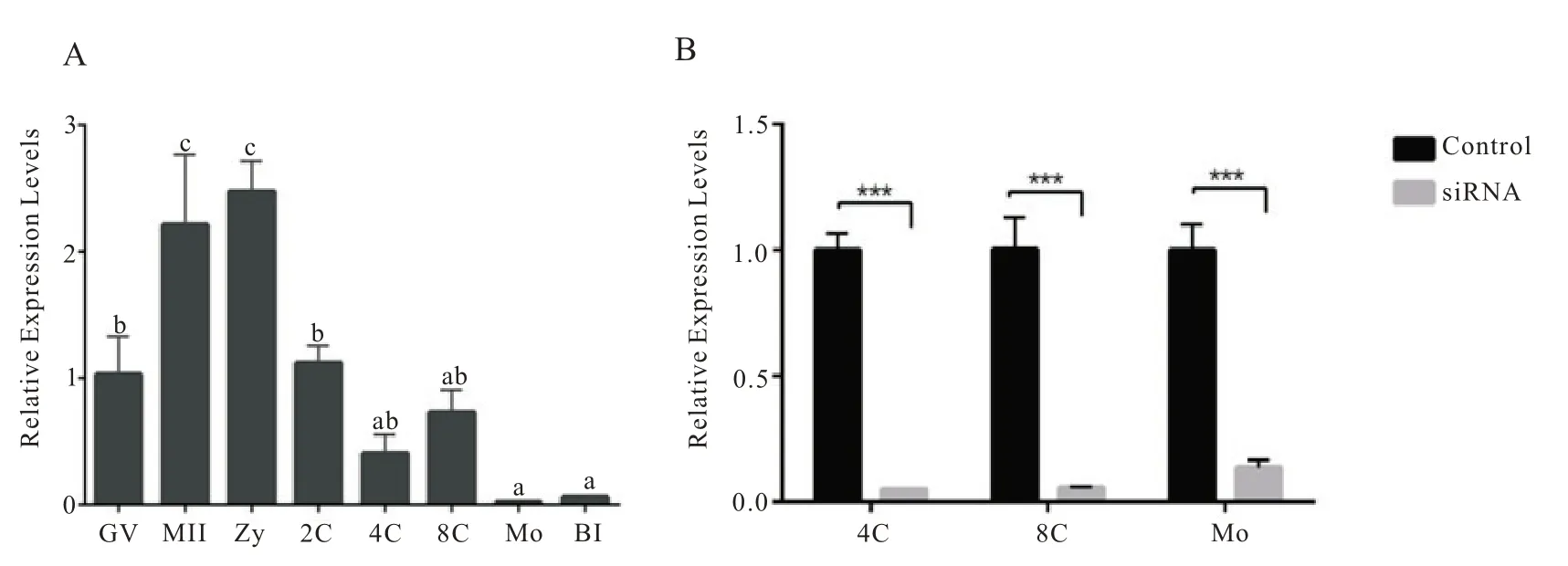
图1.Slc9a1 mRNA 在植入前胚胎发育过程中的表达水平和敲低验证。A.Slc9a1 mRNA 在植入前早期胚胎发育过程中的表达;B.Slc9a1 的敲低验证。
2.3 Slc9a1 对植入前早期胚胎发育的影响
确定获得Slc9a1敲低胚胎后,接下来观察各个时期胚胎发育情况(图2A)。结果表明Mo(E3.0)及其之前时期的对照组和实验组胚胎发育形态及发育率没有明显差异,且发育时期上基本同步。但到了E3.5,即囊胚早期阶段,相比于对照组胚胎,实验组胚胎中基本没有囊胚腔扩充,提示实验组胚胎发育至囊胚数量减少,且囊胚腔扩充较小。继续发育至E4.0,对照组胚胎囊胚腔进一步扩大,内细胞团(ICM)和滋养外胚层分化(TE)分化明显,囊胚形态圆润饱满。而相对于对照组胚胎,极少数发育至囊胚的实验组胚胎囊胚腔扩充同样较小,胚胎体积变小,部分未发育至囊胚的胚胎死亡。为了确认该现象是否为实验组胚胎发育推迟导致,继续培养至E4.5,发现对照组胚胎囊胚腔继续扩充,且胚胎滋养外胚层形成突起,为突破透明带和孵化做准备。而实验组胚胎囊胚数量较E4.0 有所增加,个别囊胚相比对照胚胎,发育正常,但并未形成滋养外胚层突起,同时胚胎死亡增加。考虑到胚胎发育推迟的情况,对E4.5 胚胎囊胚发育率进行了统计(图2C),结果显示实验组囊胚发育率相比对照组显著降低。
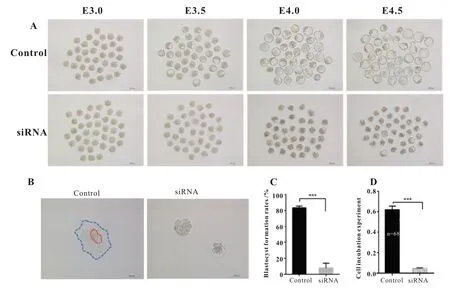
图2.Slc9a1 敲低影响囊胚正常发育。A.E3.0-E4.5 胚胎发育形态图;B.胚胎Outgrowth 形态图;C.E4.5 囊胚发育率统计;D.Outgrowth 率统计。
为了解胚胎植入能力,又进行了Outgrowth孵化实验,并对胚胎破透明带和贴壁情况进行了观测(图2B)以及Outgrowth 率统计分析(图2D)。实验结果显示,Slc9a1敲低胚胎未能突破透明带继续发育,相反,对照组胚胎能正常进行孵化,形成滋养外胚层细胞集落和内细胞团细胞集落。综上表明,Slc9a1敲低影响囊胚正常发育。

图3 对照组和Slc9a1 敲低组囊胚细胞免疫荧光染色结果图
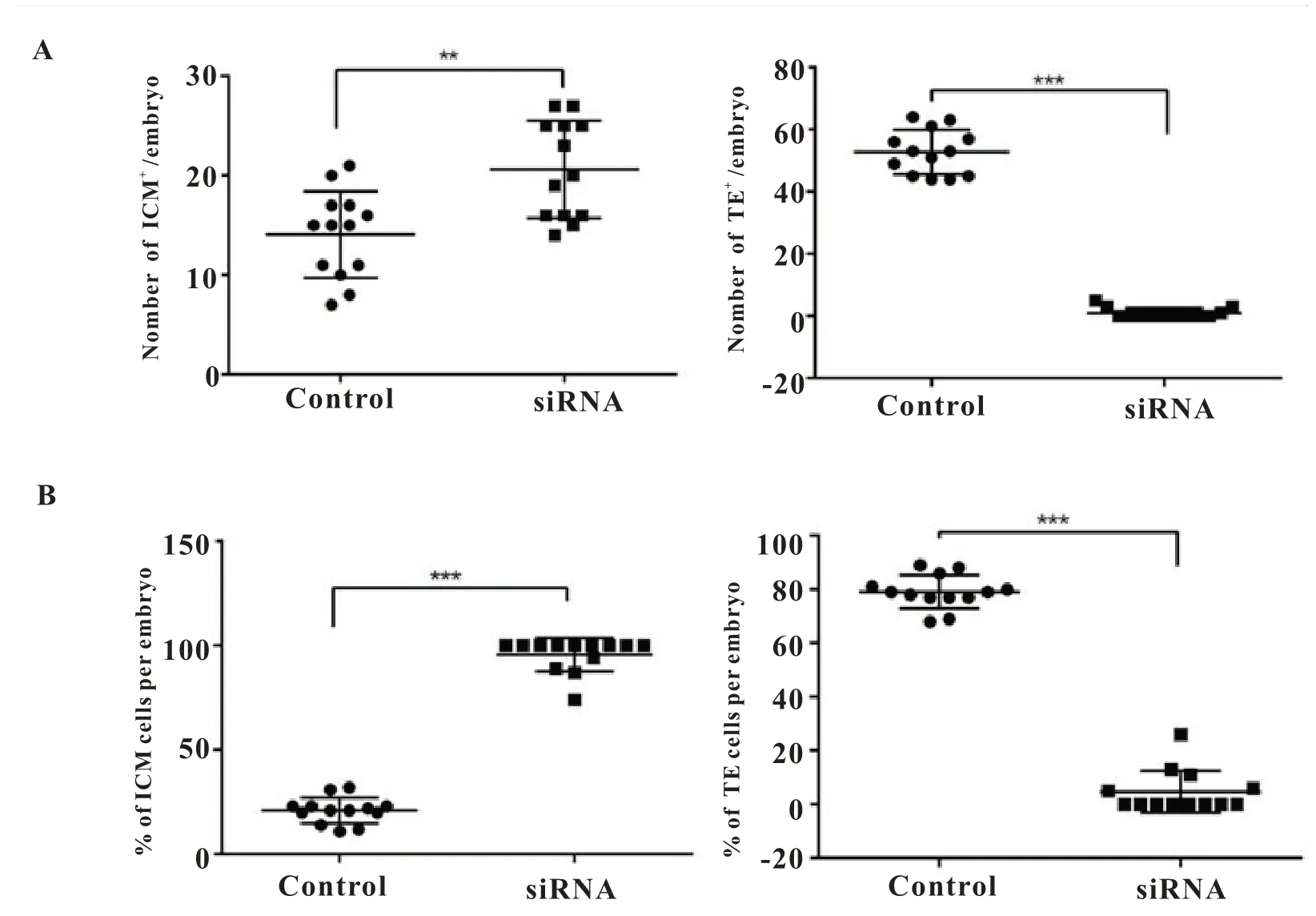
图4 对照组和Slc9a1 敲低组胚胎ICM 阳性细胞数和TE 阳性细胞数统计。A.对照组和Slc9a1 敲低组胚胎ICM 阳性细胞数和TE 阳性细胞数差异对比图;B.对照组和Slc9a1 敲低组胚胎ICM 阳性细胞数和TE 阳性细胞数占总细胞数百分比差异对比图。
2.4 Slc9a1 敲低影响囊胚谱系分化
由于实验组胚胎从桑葚期到囊胚期发育过程中发生异常,且囊胚期囊胚发育率显著降低,囊胚死亡增加,因此对胚胎发育进程中桑椹胚到囊胚期过渡期间发生的生物学事件-囊胚谱系分化进行考察,如前所述,该事件胚胎经历TE 与ICM 两种细胞系的分化。为了解Slc9a1敲低后是否对谱系分化产生影响从而探究实验组胚胎发育异常的原因。用免疫荧光共聚焦方法对谱系分化形成滞的调控,P53 有多种方式抑制细胞周期进程,其中之一是上调细胞周期素依赖性激酶(CDK)抑制因子P21 表达。随后,P21 蛋白结合细胞周期蛋白E-Cdk2 和D-Cdk4,导致细胞周期G1 期阻滞[20]。本研究通过观察并统计免疫染色结果图中的细胞总核,发现Slc9a1敲低导致囊胚期胚胎死亡增加和胚胎细胞数减少,进一步检测肿瘤抑制蛋白P53 及其调控下的生长抑制蛋白P21 表达情况,显示实验组p53 和p21 mRNA 水平均有显著升高,推测Slc9a1敲低后可能通过P53 的上调以及由此导致的P21 上调导致细胞周期阻滞并诱导凋亡,从而引起囊胚细胞死亡率增加。
结论
本研究探究了Slc9a1基因在小鼠植入前胚胎发育过程中的作用,研究发现Slc9a1mRNA 在植入前胚胎发育过程中特异性表达,Slc9a1敲低导致胚胎囊胚发育阻滞并影响谱系分化,影响细胞周期,增加细胞凋亡。因此Slc9a1基因在植入前胚胎发育过程中可能发挥着重要的作用。

