夹脊电针不同时间点干预对ALS-SOD1G93A小鼠腰髓TLR4/NF-κB信号通路的影响
王仕林,孙远征,于天洋,孙 妍△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
肌萎缩侧索硬化症(Amyotrophic lateral sclerosis,ALS)是一类成年发病,病变累及脊髓前角细胞、锥体束和延髓,出现肌无力、肌萎缩和肌束震颤等临床表现的神经变性疾病[1-2]。ALS病情进展较快,患者多在发病后3~5年内死于呼吸肌麻痹[3]。尽管ALS的发病机制目前尚不十分明确[4-5],但部分研究[6]认为ALS的发病与神经炎症反应密切相关。在多种神经变性疾病中都能够观察到具有促炎作用的小胶质细胞中的Toll受体4(Toll-like receptors 4, TLR4)的异常表达[7-8],TLR4通过识别病原因子,激活细胞核内的核因子-κB(Nuclear factor-kappa B, NF-κB)使其在细胞核内大量释放,介导如白介素-1β(Interleukin-1β, IL-1β)、白介素-6(Interleukin-6, IL-6)和肿瘤坏死因子-α(Tumor Necrosis Factor-α, TNF-α)等一系列炎症因子在细胞内高表达,加重神经炎症反应,继而导致神经变性的进一步加剧[9-10]。ALS-SOD1G93A小鼠是经典的ALS动物模型,目前国内外动物实验中多在ALS-SOD1G93A小鼠50~70日龄时进行干预,此时小鼠多尚未发病或病情较轻,若干预时间超过90日龄则治疗效果多不尽人意[11-12]。在临床实践中,ALS患者往往在出现明显的临床症状后才前往医院就诊,延误了最佳治疗时间,而针灸早期介入能否改善ALS患者的预后是值得深入探讨和研究的问题。本课题组前期研究发现[13-15]夹脊电针可以延缓ALS-SOD1G93A小鼠的病情进展,改善临床症状,对ALS的治疗具有积极作用。故本研究通过观察夹脊电针在小鼠60日龄和90日龄两个不同时间点干预对ALS-SOD1G93A小鼠发病时间、肢体运动功能与脊髓前角运动神经元的形态和数量变化及TLR4、NF-κB和IL-1β蛋白表达的影响,探究夹脊电针对ALS-SOD1G93A小鼠的最佳干预时间及机制,为临床上选择治疗ALS的最佳时间提供科学依据。
1 材料与方法
1.1 动物与分组
4只雄性ALS hSOD1-G93A-1Gur/J转基因鼠与20只雌性B6SJL/F1品系健康鼠杂交扩群。实验鼠由黑龙江中医药大学药物安全性评价中心[动物许可证号:SYXK(黑)2016004]提供。饲养于黑龙江中医药大学药物安全性评价中心SPF级动物实验室。实验室内环境:(22±2)℃恒温,40%~50%恒湿,无特殊病原体。由通过专业培训的实验动物饲养人员进行喂养、繁殖,自由摄食灭菌水及颗粒型无菌鼠类饲料。于子代鼠30日龄时行PCR鉴定,将携带hSOD1-G93A基因的转基因鼠按照随机数字表法分为模型组、90 d夹脊电针组和60 d夹脊电针组,12只/组。将不携带hSOD1-G93A基因的阴性鼠随机选取12只作为野生组。各组小鼠60日龄时体质量(16.97±0.62)g。实验过程中对小鼠的操作均符合中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》[16]中的规定。
1.2 主要仪器和试剂
1.2.1 主要仪器 HANS-100A神经刺激仪(南京济生医疗科技有限公司);SA102型转棒式疲劳仪(江苏赛昂斯生物科技有限公司);HS-3345切片机(华速医疗器械有限公司);GZX-DH-Ⅱ电热恒温干燥箱(上海跃进医疗器械有限公司);FD-268复合光学显微镜(Leica公司);NB-70型制冰机(上海雪人);凝胶电泳仪(美国Bio-Rad公司);Multifuge X1R型离心机(美国Thermo Fisher Scientific公司);TZL-50001型水平摇床(苏州珀西瓦尔实验设备公司);TG16-W型漩涡混匀器(美国Benchmark公司);BCA蛋白试剂盒(碧云天技术有限公司);SpectraMax i3x型多功能酶标仪(美国BioTek公司)。
1.2.2 主要试剂 4 %多聚甲醛(碧云天技术有限公司);苏木素—伊红染液(Biosharp);二甲苯(天津市富宇精细化工有限公司);甲苯胺蓝(上海麦克林生化科技有限公司);中性树脂(上海麦克林生化科技有限公司);TBST(索宝莱生物制剂有限公司);SDS-PAGE凝胶快速配制试剂盒(碧云天技术有限公司);蛋白Marker(Thermo Fisher Scientific);蛋白酶抑制剂(Sigma-Aldrich);GAPDH抗体(Sigma-Aldrich);TLR4抗体(Cell Signaling Technology);NF-κB抗体(Cell Signaling Technology);IL-1β抗体(Cell Signaling Technology)。
1.3 干预方法
60 d夹脊电针组和90 d夹脊电针组分别于小鼠60日龄和90日龄时,在异氟烷(流量0.6 L/min,浓度1 %)麻醉条件下将小鼠固定在无菌操作台,采用针灸针(0.16 mm×7 mm,珞亚山川牌)直刺小鼠双侧L1~2、L5~6夹脊穴,针刺深度2~3 mm。HANS-100A神经刺激仪正负极连接同侧两穴,频率2 Hz,电流强度1 mA,治疗20 min/次,2次/周,治疗4周。模型组和野生组小鼠于60日龄时,给予相同条件的麻醉和固定,不进行针刺干预。
1.4 标本采集和保存
在各组小鼠120日龄时取材,随机抽取6只,4 %水合氯醛腹腔注射麻醉,0.9% NaCl(50 mL/只)和4 %多聚甲醛(40 mL/只)灌注,剥离脊髓,截取腰段,甲醛固定,石蜡包埋后-4 ℃保存,用于HE染色和尼氏染色检测。各组剩余6只鼠,4 %水合氯醛腹腔注射麻醉,0.9% NaCl(50 mL/只)灌注后,迅速剥离新鲜腰髓,置冻存管-80 ℃保存,用于Western Blot检测。
1.5 观察指标及检测方法
1.5.1 观察各组小鼠发病时间 小鼠60日龄时通过悬尾实验观察小鼠后肢伸展情况,判定发病日期[17]。悬尾实验时小鼠后肢表现为不能完全伸展,偏离中线,一侧肢体微屈曲或肢体震颤,连续重复3~4次且连续2 d,即判定当日为小鼠发病日,评定由固定的两名实验人员共同完成并记录数据。
1.5.2 各组小鼠转棒实验测试 在各组小鼠55日龄时,用转棒式疲劳仪对小鼠进行连续5 d的适用性训练,设置转速为15 r/min,180 s/次,3次/d。适用性训练结束后,正式进行转棒实验的测试,转速15 r/min,180 s/次,每个测试日进行3次测试,3次中取表现最佳的1次记为结果,每周记录2次。
1.5.3 HE染色观察小鼠腰髓前角运动神经元形态 石蜡切片(厚度4 μm),37 ℃温箱隔夜贴片后行HE染色。组织切片依次经二甲苯脱蜡,逐级酒精脱苯,苏木素染色,盐酒分化2 s,氨水反蓝50 s,流水冲洗3 min后0.5%伊红染色7 min,蒸馏水2~3 s后逐级酒精脱水,二甲苯透明,中性树脂封片。光学显微镜下观察小鼠腰髓前角运动神经元的形态结构,胞浆、细胞质及细胞核着色度,神经元空泡化程度等病理表现。
1.5.4 尼氏染色观察小鼠腰髓前角运动神经元数量 石蜡切片(厚度4 μm),37 ℃温箱隔夜贴片后,组织切片依次经2次二甲苯各10 min脱蜡→逐级酒精各3 min脱苯→1%甲苯胺蓝1 h(60 ℃温箱)→蒸馏水2~3 s→逐级酒精脱水,二甲苯透明→中性树脂封片→干燥后镜下观察染色情况。每只鼠腰髓染色10张片,随机抽5张取平均值作为每例神经元计数值(个/HP)记录。神经元细胞的计数评判标准:细胞体多极化,神经元细胞结构完整,细胞质颗粒状,核仁清晰完整,只要满足以上特点,无论神经元大小均计为1个神经元。
1.5.5 Western Blot法检测小鼠腰髓TLR4、NF-κB及IL-1β表达量 组织研磨后,加入150 μL RIPA裂解液、150 μL PMST蛋白酶抑制剂,提取蛋白→BCA蛋白测定→沸水煮5 min,蛋白变性→SDS-PAGE凝胶制备→电泳→转膜→封闭→抗体孵育→化学发光后成像保存图像。采用Image J v1.8.0对经扫描后保存的条带图片进行分析测定,计算IOD值,定量分析。
1.6 统计学处理

2 结果
2.1 不同时间点夹脊电针干预对各组小鼠发病期的影响
与模型组比较,90 d夹脊电针组发病时间差异无统计学意义(P>0.05);与90 d夹脊电针组比较,60 d夹脊电针组发病时间明显推迟,差异具有统计学意义(P<0.01)。见表1。
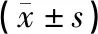
表1 各组小鼠发病时间比较
2.2 不同时间点夹脊电针干预对各组小鼠转棒时间的影响
各组小鼠发病前转棒时间均为180 s,自90日龄起,与野生组比较,其他各组转棒时间降低,差异具有统计学意义(P<0.05);与模型组和90 d夹脊电针组比较,60 d夹脊电针组转棒时长开始降低时间明显延后,差异具有统计学意义(P<0.05),且60 d夹脊电针组相同时间点的转棒时间均长于模型组和90 d夹脊电针组,差异具有统计学意义(P<0.05)。见表2。
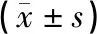
表2 各组小鼠转棒时间比较
2.3 HE染色后各组小鼠腰髓前角运动神经元形态学变化
野生组腰髓切片染色均匀,细胞形态完整,细胞质呈颗粒状,核仁清晰完整,无神经元细胞空泡、水肿等病理损害的特异性表现;模型组腰髓前角组织疏松,大量细胞形态不完整,结构破坏,核仁边缘不清,有固缩现象,可见明显的空泡和水肿等神经损伤的特异性表现;与模型组比较,60 d夹脊电针组和90 d夹脊电针组神经元形态结构较完整,但染色仍然存在不均匀,脊髓前角细胞有空泡和轻度的水肿表现;与90 d夹脊电针组比较,60 d夹脊电针组神经元形态基本完整,相对比较清晰,存在少数染色不清的细胞,细胞空泡化和水肿程度明显降低。见图1。
2.4 各组小鼠腰髓前角运动神经元计数结果
与野生组比较,模型组、60 d夹脊电针组和90 d夹脊电针组脊髓前角运动神经元数量明显减少,差异具有统计学意义(P<0.01或P<0.05);与模型组比较,60 d夹脊电针组和90 d夹脊电针组脊髓前角运动神经元数量增多,差异具有统计学意义(P<0.01或P<0.05);与90 d夹脊电针组比较,60 d夹脊电针组脊髓前角运动神经元数量增多,差异具有统计学意义(P<0.05)。见图2、表3。
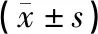
表3 各组小鼠腰髓前角运动神经元计数比较
2.5 Western Blot法观察腰髓TLR4、NF-κB及IL-1β相对表达量
与野生组比较,其他各组TLR4、NF-κB及模型组、90 d夹脊电针组IL-1β相对表达量均显著增加,差异具有统计学意义(均P<0.01),60 d夹脊电针组IL-1β相对表达量增加,差异具有统计学意义(P<0.05);与模型组比较,90 d夹脊电针组和60 d夹脊电针组TLR4及60 d夹脊电针组IL-1β相对表达量均显著减少,差异具有统计学意义(均P<0.01),90 d夹脊电针组和60 d夹脊电针组的NF-κB及90 d夹脊电针组的IL-1β相对表达量均减少,差异具有统计学意义(均P<0.05);与90 d夹脊电针组比较,60 d夹脊电针组TLR4、NF-κB及IL-1β相对表达量均减少,差异具有统计学意义(均P<0.05)。见图3、表4。
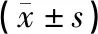
表4 各组小鼠腰髓TLR4、NF-κB及IL-1β相对表达量比较
3 讨论
ALS在中医学内尚无准确病名,因ALS的临床表现为肢体无力、运动迟缓、肌肉萎缩、肌束震颤和呼吸肌麻痹等症状,多将ALS归属中医里的“痿证”范畴;延髓受累时多归为“喑痱证”范畴。ALS的中医治疗主要包括“治痿独取阳明”“夹脊穴论治”“从督论治”等不同治疗原则,其中夹脊电针以其确切的临床疗效得到了广泛的应用,本课题组前期研究证实[18-20],夹脊电针对ALS具有积极治疗作用,能够有效抑制ALS小鼠运动神经元细胞的损害,延缓疾病的发生发展,延长小鼠生存期。夹脊穴是与经络脏腑直接相互转输流注气血的腧穴,位于“督脉之别”的走行位置,而“督脉之别”的循行又“别走太阳”,与足太阳膀胱经相联系。它依靠督脉和足太阳膀胱经,通过气街之经气的共同通路发挥包括背俞穴在内的其他腧穴不能达到的调理枢纽作用[21-22]。该作用让夹脊穴在治疗神经系统病变、脏腑病变等疑难杂症方面具有独特的疗效。故本课题组采用夹脊电针治疗来探究不同时间点的干预对ALS-SOD1G93A小鼠腰髓TLR4/NF-κB炎症通路影响。
本研究结果显示,与模型组比较,90 d夹脊电针组和60 d夹脊电针组小鼠的转棒时间和神经元数量均增加,神经元形态有所改善,提示夹脊电针可以改善ALS-SOD1G93A小鼠的下肢运动功能,减轻脊髓前角运动神经元的损伤程度,保护神经元,这与课题组既往研究一致。同时,本研究结果显示,60 d夹脊电针组的效果优于90 d夹脊电针组,提示发病前的早期干预疗效可能优于发病后干预。
神经炎症是中枢神经系统(Central Nervous System,CNS)中由小胶质细胞和星形胶质细胞激活的免疫应答反应,小胶质细胞作为CNS中的免疫细胞,其与星形胶质细胞在CNS中发挥免疫调节作用[23]。Javier H. Jara等[24]研究ALS患者运动皮层中星形胶质细胞和小胶质细胞增生的情况。在患者运动皮层和TDP-43小鼠模型中检测到被激活的星形胶质细胞和小胶质细胞,特别是杆状小胶质细胞,证实ALS和神经炎症可能存在密切相关性。SOD1突变基因能够激活小胶质细胞TLR4/NF-κB炎性通路,TLR4激活后通过一系列分子反应迅速激活NF-κB,使其在核内释放,细胞核内的NF-κB含量增加,介导IL-1β、IL-2和TNF-α等多种促炎细胞因子表达[25-26],机体出现神经炎症表现。炎症反应会引起神经元的病理坏死,损伤坏死的脊髓前角神经元可再次活化小胶质细胞,加剧炎症反应,从而使ALS病情持续进展。本研究结果显示,与模型组比较,90 d夹脊电针组和60 d夹脊电针组脊髓前角细胞内TLR4、NF-κB和IL-1β表达量均明显降低,且60 d夹脊电针组内各蛋白因子相对表达量低于90 d夹脊电针组,提示夹脊电针可能通过抑制ALS小鼠体内致炎因子和炎症因子的表达以减轻炎症,改善ALS-SOD1G93A小鼠的疾病症状,且发病前的早期干预疗效可能优于发病后干预。
ALS的治疗时机一直以来都是科学界探讨的热点话题,大部分实验研究证明越早进行干预治疗效果越佳,若能够在发病前干预可能对疾病的预后具有积极意义[27-28]。《黄帝内经》强调:“上工治未病,不治已病”,治未病是中医治疗的重要思想,在许多疾病的治疗中都得到了广泛的应用。虽然本实验证实了60 d发病前的早期干预可能优于发病后的90 d干预,但实验设计仅做了干预后相关通路中分子的变化研究,缺少拮抗或激动通路中关键分子的验证实验,机制研究比较初步。课题组后期将进一步深入完善,为临床夹脊电针治疗ALS提供更加全面可靠的实验依据。
综上所述,本研究以TLR4/NF-κB炎症通路为切入点探究夹脊电针不同时间点干预治疗ALS-SOD1G93A小鼠的疾病机制,结果显示夹脊电针可能通过降低TLR4、NF-κB和IL-1β的相对表达量,减轻炎症反应,保护神经元,延缓小鼠发病时间,改善其下肢运动功能,且发病前早期干预疗效更优,为夹脊电针早期介入ALS的治疗提供了相关理论依据。

