PARP1通过调控N-糖基转移酶FUT8影响胃癌AGS细胞的增殖与5-FU耐药
王晶,王宏浩,向田,任文镇,刘杲(.武汉市汉口医院检验科,湖北 武汉 005;.湖北民族大学医学部恩施临床学院暨恩施土家族苗族自治州中心医院 胃肠外科 湖北 恩施 5000;.恩施土家族苗族自治州中心医院 临床检验中心,湖北 恩施 5000;.湖北医药学院恩施培养基地胃肠外科,湖北 恩施 5000)
胃癌是临床上最常见的恶性肿瘤之一,2021年流行病学统计结果[1]显示,在世界范围内,其发病率在所有肿瘤中位于第四位,但病死率高居第三。尽管目前胃癌的诊治技术有了较大的进步,但由于其早期缺乏特异症状、肿瘤侵袭和转移能力较强,多数患者就诊时已是中晚期。术后化疗作为进展期胃癌患者的主要治疗手段的,部分患者易出现多种不良反应难以耐受,且治疗过程中易出现对化疗药物的耐药[2],故患者5年生存率仍相对较低[3]。多聚ADP核糖聚合酶1(poly-ADPribose polymerase 1,PARP1)为一种广泛存在于多数真核细胞内的蛋白核酶,其介导的N-糖基化修饰与肿瘤细胞的恶性生物学行为密切相关,a-1,6-岩藻糖基转移酶8(a-1,6-fucosyltransferase 8,FUT8)是其中的关键酶。ADP-核糖基化的最新进展为人类肿瘤治疗提供了新的方向[4-5]。外源性给予PARP1抑制剂能够显著抑制肺腺癌细胞的DNA损伤修复,增加肺癌细胞对药物的敏感性,诱导细胞发生凋亡[6-7]。在卵巢癌[8]、乳腺癌[9]及宫颈癌[10]等多种肿瘤的研究中也发现,沉默PARP1基因可显著增强放疗敏感性,促进细胞凋亡,但其在胃癌中作用的研究尚少。本研究通过对胃癌患者组织和细胞中PARP1的研究,并结合生物信息学方法探究其对胃癌AGS细胞增殖和耐药性的影响及潜在机制,这对发现新的治疗靶点、改善患者预后等都具有重要的意义。
1 材料与方法
1.1 主要材料与试剂
人胃癌细胞AGS和SGC-7901购自中国科学院细胞库,均采用含10%胎牛血清、1%青霉素和链霉素双抗的DMEM完全培养基于37℃,5% CO2培养箱中培养。DMEM培养基购自美国Gibco公司,胎牛血清购自美国Hyclone公司,PARP1抑制剂AG14361购自美国Sigma-Aldrich公司(用5 μL 4.74%的DMSO溶解后用于细胞实验),DNA Ligation Kit试剂盒购自日本TOYOBO公司,TRIzol和Lipofectamine 2000转染试剂盒均购自美国Invitrogen公司,反转录试剂盒和实时定量PCR试剂盒购自日本TaKaRa公司,RIPA裂解液,BCA蛋白定量试剂盒,MTT、CCK-8试剂盒和AnnexinⅤ-FITC细胞凋亡检测试剂盒均购自上海碧云天公司,一抗[兔抗 PARP1(ab191217)、FUT8(ab191571)、β-actin(ab179467)单克隆抗体]和HRP标记的羊抗兔IgG二抗(ab6721)均购自英国Abcam公司,ECL显色液和PVDF膜购自美国Millipore公司。IX83倒置相差显微镜购自日本Olympus公司,细胞CO2培养箱购自美国Thermo Scientific公司,Agilent 2100 Bioanalyzer生物芯片分析系统购自美国AgilentTechnologies公司,ABI7500型qPCR仪购自美国ABI公司,FACSCantoⅡ流式细胞仪购自美国BD公司,RT-6100全自动酶标分析仪购自深圳雷杜公司,GelDoc XR+凝胶成像系统购自美国Bio-Rad公司。
1.2 临床样本
收集2018年5月至2019年12月间经恩施土家族苗族自治州中心医院病理科医生明确诊断为胃癌的石蜡组织切片72例(其中伴有淋巴结转移的胃癌原发灶组织37例,无淋巴结转移的胃癌原发灶组织35例),同时收集相应距肿瘤边缘5 cm以上的癌旁组织标本切片。入选患者包括男性43例、女性29例,中位年龄52(38~80)岁。纳入标准:标本采集前患者未接受过术前的放疗或化疗治疗,无其他肿瘤病史。排除标准:合并其他胃部疾病的患者,不同意样本采集的患者,信息不全的患者。所有患者术前均告知研究过程并签署知情同意书,研究方案得到所在医院医学伦理委员会的批准。
1.3 免疫组织化学法检测PARP1在胃癌组织中的表达
术后立即将组织标本放入4%多聚甲醛中固定,经全自动免疫组织化学染色仪脱水、石蜡包埋、制成切片等步骤后,加入10 μg/mL的PARP1抗体,然后依次采用生物素化抗小鼠IgG二抗,随后用碱性磷酸酶链霉亲和素和显色原进行染色。经苏木精复染、脱水、透明后用中性树胶封片,采用倒置显微镜观察,在高倍镜下观察样本,每个视野计数100个肿瘤细胞,每张切片观察5个视野。结果判读:PARP1阳性信号定位于细胞核,细胞核内出现棕黄色颗粒即为阳性,无棕黄染色者为阴性;染色呈黄色计为1分,染色呈棕黄色计为2分,染色呈棕色计为3分。同时按每高倍镜视野阳性细胞百分比计分,阳性细胞数<5%计为0分,5%~<26%计为1分,26%~<50%计为2分,50%~<75%计为3分,≥75%计为4分。两种计分的乘积即为阳性强度:<3分为阴性表达,≥3分为阳性表达(最高分为12分)。
1.4 MTT法检测AG14361杀伤AGS细胞的IC50
将AGS细胞培养至对数生长期,经0.25%胰酶消化、洗涤、计数,重悬于10%FBS的DMDM培养液,调整细胞密度为1×104个/mL,按100 μL/孔接种至96孔培养板,37℃、5% CO2培养箱过夜培养,分别加入不同浓度的AG14361,AG14361的终浓度分别为100、50、25、12.5、6.25、3和1.5 μmol/L,同时设阴性对照(加入等体积的DMSO),各组设3个复孔。37℃、5% CO2培养箱培养24 h,培养结束前4 h加入MTT(5 mg/mL),10 μL/孔,待培养结束,用全自动酶标仪检测各孔光密度(D)值,波长为490 nm。根据检测结果计算AG14361对AGS细胞的IC50(50%细胞生长抑制所需的药物浓度),抑制率=(对照组D值-实验组D值)/对照组D值×100%。
1.5 qPCR法检测AG14361对AGS细胞中PARP1和FUT8表达的影响
收集处于对数生长期细胞,采用TRIzol法提取细胞RNA,然后逆转录为cDNA。使用10 μL体系,包括1 μLcDNA、5 μL2×SYBGREEN Mix、1 μL上下游引物混合液(引物混合物浓度为2 μmol/L)、3 μL无RNA酶的水,设置3个复孔。引物由武汉擎科生物合成,引物序列见表1。PCR反应条件为95℃10 min;95℃15 s、60 ℃30 s、72℃1 min,共40个循环。β-actin为内参,采用2-△△Ct法计算目的基因相对表达量。
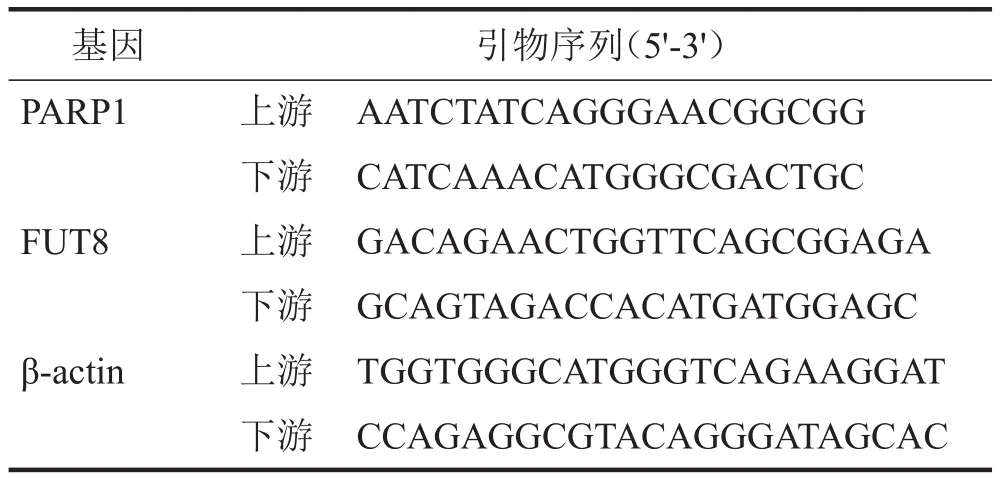
表1 qPCR引物序列
1.6 WB法检测细胞中相关蛋白的表达
采用RIPA裂解液将收集的细胞在冰上进行裂解,BCA蛋白定量法测定蛋白质浓度,随后加入1 mL 5×SDS上样缓冲液混匀,100℃干浴5 min。每样本取15 μg蛋白质行SDS-PAGE,经转膜、5%脱脂奶粉封闭后,加入一抗4℃过夜,1×TBS/T轻洗3遍,加入二抗,室温处理1 h,1×TBS/T轻洗3遍,加入ECL发光剂进行显色及凝胶成像仪显影,采用Image J2x软件分析蛋白条带的灰度值,以GAPDH为内参,计算靶蛋白的相对表达。
1.7 CCK-8法检测AG14361对胃癌细胞增殖的影响
收集对数生长期细胞,按1×103个/孔均匀接种于96孔板,加入AG14361使药物浓度达IC50,每孔总体积为100 μL,37 ℃、5% CO2培养箱23 h,然后每孔加入10 μL CCK-8培养,在细胞培养箱中继续培养1 h,酶标仪检测450 nm处D值,D值反映细胞增殖状况。
1.8 流式细胞术检测AG14361对胃癌细胞凋亡的影响
取对数生长期的细胞,按1×105个/孔均匀接种于6孔板中,然后加入AG14361使药物浓度为IC50,每孔总体积为4 mL,细胞培养24 h后,弃上清,1×PBS轻洗3遍,胰酶消化,800×g离心5 min,弃上清,加入195 μLAnnexinⅤ-FITC结合液重悬细胞;随后依次加入5 μLAnnexin Ⅴ-FITC和10 μL碘化丙啶染色液混匀后室温避光放置20 min,随后置于冰浴中。采用FACS CantoⅡ流式细胞仪进行细胞凋亡检测。
1.9 细胞集落形成实验检测AG14361对胃癌细胞克隆形成的影响
取对数生长期的AGS细胞,进行胰酶消化,制成1×103个/mL的细胞悬液。取1 mL接种于12孔板,轻轻晃动培养皿,使细胞分散均匀,37℃、5% CO2中培养2周,当培养皿中出现肉眼可见克隆时,终止培养,PBS轻洗3次,空气干燥。4%多聚甲醛/甲醇固定15 min,弃甲醇后空气干燥。用0.5%结晶紫溶液染色20 min,PBS洗3次,晾干。在显微镜下以肉眼可见的细胞团作为计数细胞集落的标准,拍照并使用Image J2x软件进行计数。
1.10 AGS细胞基因测序及差异基因富集分析
AGS细胞分别使用DMSO和IC50浓度的AG14361处理24 h后提取总RNA,送北京奥维森科技进行mRNA测序,每组3个生物学重复。样品总RNA经定量、完整性检测后进行测序分析。FPKM(fragments per kilobase of exon model per million mapped reads)是目前最为常用的基因表达水平估算方法,以FPKM>1界定基因表达,用火山图可以展示差异基因的整体分布情况。鉴定差异基因后对差异基因进行功能富集分析。用H-cluster方法对差异基因的相对表达水平值log2(FPKM)进行聚类,做层次聚类分析。差异表达基因KEGG富集分析结果通过散点图进行图形化展示。Rich factor、-log10(Pvalue)和富集到此通路上的基因个数来衡量KEGG富集程度。Rich factor指pathway中富集到的差异表达基因数量与注释基因数量的比值。
1.11 向AGS细胞转染FUT8 siRNA以干扰FUT8 mRNA的表达
siFUT8和siNCRNA由上海英俊公司合成,序列如下 :siFUT8,5'-GGACUGCACAAUCGAUACATT-3';siNC: 5'-GGTTCAACGTTCTTCAGTCAGATCT-3'。siFUT8的转染完全按照转染试剂说明书进行。AGS细胞以2×105个/孔的密度接种6孔板,37℃培养过夜,更换新鲜的DMEM完全培养基。将2.2 pmol的siFUT8 RNA溶于无血清培养基中,颠倒混匀后,加入8 μL的转染试剂转染细胞,同时转染无干扰作用的siNC作为阴性对照。37℃下培养72 h后检测FUT8 mRNA水平,评估转染AGS细胞干扰FUT8表达效果。
1.12 统计学处理
采用SPSS 21.0统计软件进行分析。符合正态分布的计量资料采用±s表示,两组间数据比较采用t检验,两组以上数据比较采用单因素方差分析;两组间率的比较采用χ2检验。以P<0.05或P<0.01表示差异有统计学意义。
2 结 果
2.1 胃癌组织和癌旁组织中PARP1表达水平
Kaplan-Meier Plotter数据库分析PARP1在胃癌及正常胃组织中表达差异,结果(图1A)显示,胃癌组织中PARP1基因表达水平显著高于癌旁组织(P<0.001)。对72对胃癌组织和癌旁组织中PARP1基因和蛋白表达进行检测,qPCR检测结果(图1B)显示,癌组织标本中PARP1基因表达水平显著高于癌旁组织(t=20.91,P<0.001);免疫组化检测结果(图1C)显示,胃癌组织中PARP1阳性表达率显著高于相应癌旁组织(P=<0.001,表2)。

表2 PARP1在胃癌及癌旁组织中表达阳性率状况
2.2 AG14361可抑制胃癌细胞增殖而促进细胞凋亡
MTT法检测结果(图2A)显示,作为PAPP1抑制剂,AG14361杀伤AGS细胞的IC50为17.31 μmol/L。使用IC50的AG14361处理AGS细胞发现,与空白对照相比,细胞增殖水平显著减低(P<0.001,图2B),平板集落形成试验也显示AG14361可显著抑制细胞集落的形成(P<0.001,图2C、D),细胞凋亡水平显著增加(P<0.001,图2E、F),凋亡蛋白BAX表达显著增加、抗凋亡蛋白Bcl2表达显著降低(图2G)。
2.3 AG14361可增强胃癌细胞对5-FU的化疗敏感性
MTT法检测结果显示,5-FU杀伤AGS和SGC-7901 细胞的IC50分别为 5.124 μg/mL 和 1.070 μg/mL(图3A、B)。在用17.31 μmol/L的AG14361处理细胞后再以5-FU杀伤AGS和SGC-7901细胞,IC50分别降为2.009 0 μg/mL和0.586 7 μg/mL(图3C、D)。与单独5-FU处理相比较,在经AG14361处理后5-FU再处理,其杀伤AGS细胞的IC50下降了60.79%、杀伤SGC-7901细胞的IC50下降了41.74%,说明AG14361可增强胃癌细胞对化疗药物5-FU的敏感性。
2.4 AG14361促进AGS细胞N-糖基转移酶FUT8的表达
AG14361处理AGS细胞24 h后提取总RNA,进行mRNA测序。以FPKM>1界定基因表达,共计检测到40 305个基因。将差异基因筛选阈值界定为|Log2(FoldChang)|>1且qvalue<0.005,共筛选到5 496个基因,其中上调基因2 972个、下调基因2 524个(图4A)。差异表达基因KEGG富集分析发现,共有10条肿瘤及胃功能相关信号轴被富集且表达水平具有显著差异,这些信号轴涉及细胞周期、DNA修复、基因同源重组、P53信号轴和核酸剪接修复等,尤其是在N-糖基化修饰方面也显示出重要作用(图4B)。采用KEGG基因聚类进一步分析,热图结果(图4C)显示,AG14361可显著促进N-糖基转移酶FUT8等基因的表达。为验证AG14361对FUT8的调控作用,分别使用qPCR和WB检测AGS细胞经AG14361处理后细胞中FUT8的表达量,结果显示,AG14361处理AGS细胞后,细胞中FUT8基因(P<0.05,图4D)和蛋白(图4E)的表达水平都有所升高。
2.5 PARP1通过调控N-糖基转移酶FUT8促进AGS细胞增殖
为进一步探究FUT8对胃癌细胞的影响,对AGS细胞进行siFUT8干扰处理(见图5A、B),同时使用17.31 μmol/L的AG14361分别处理siNC和siFUT8组的AGS细胞,CCK-8法检测结果(图5C)显示,与siNC组相比,siFUT8组AGS细胞的增殖水平显著升高(P<0.01),而 AG14361处理可显著逆转该影响(P<0.001);平板集落形成实验结果(图5D、E)显示,siFUT8组AGS细胞集落的形成能力较siNC组显著增强(P<0.001),而AG14361处理可显著抑制该影响(P<0.01);流式细胞术检测结果(图5F、G)也显示,AG14361可显著逆转siFUT8所致AGS细胞增殖的增加,而促进细胞凋亡(均P<0.01),同时促进凋亡蛋白BAX表达、抑制抗凋亡蛋白Bcl2表达(图5H)。
3 讨 论
由于绝大多数胃癌患者在确诊时已进入进展期或晚期,因此术后药物治疗便成为胃癌治疗的主要手段[11]。其中化疗药物如氟尿嘧啶类、紫杉醇类、表柔比星类及铂类药物在胃癌的药物治疗中使用最为广泛,它们多是通过损伤肿瘤细胞核酸功能而发挥抗癌作用的[12]。但随着患者用药时间的延长,肿瘤细胞DNA的损伤可以通过激活机体DNA损伤应答机制得以修复,使肿瘤细胞产生耐药,而肿瘤细胞耐药的出现便成为影响患者生存时间和生存质量中最亟待解决的问题[13]。因此,在DNA损伤修复、调节细胞凋亡等方面发挥重要作用的PARP1便成为肿瘤治疗及耐药研究的焦点分子而备受关注。
PARP1在多种肿瘤细胞中呈高表达,通过siRNA技术干扰PARP1基因的表达能够有效抑制肿瘤细胞复制过程中的DNA损伤修复,导致肿瘤细胞DNA损伤的积聚和自我凋亡的启动,进而到达抑制肿瘤细胞增殖的效果[14-15]。本研究首先通过Kaplan-Meier Plotter数据库分析比较胃癌组织与正常组织中PARP1的表达,结果发现PARP1在胃癌组织中表达显著升高。对收集的胃癌患者组织与癌旁组织进行qPCR和免疫组化分析,同样发现PARP1在胃癌组织中呈高表达。王睿等[16]通过ELISA法检测胃癌患者血清中PARP1含量时发现,患者血清中PARP1表达显著升高;同时也有研究[17]显示PARP1可作为胃癌独立预后和疾病诊断和进展的重要生物学标志。这都说明胃癌患者PARP1可能在胃癌的发生发展中具有重要作用。
抑制PARP1的表达可抑制肿瘤细胞DNA修复过程,临床前及临床研究[6-9]均已证明,在多种肿瘤中抑制PARP1的表达均具有增强化疗、放疗等治疗效果的潜力,因此PARP1抑制剂在临床抑制肿瘤耐药中也日益受到关注,被认为是一种很有前景的抗癌策略。奥拉帕利、卢卡帕利、尼拉帕利和他拉唑帕利等4种PARP 1/2抑制剂已获得美国FDA批准,其在治疗与人类乳腺癌易感基因1和2(breast cancer susceptibility gene1/2,BRCA1/2)突变所致的卵巢癌、转移性乳腺癌、晚期前列腺癌和胰腺癌等肿瘤的治疗中均取得了较好的疗效[18]。同时一些PARP1抑制剂(如BMN673、AG14361、NMS-P118和BYK204165等)正逐步进入临床评估[19-20]。AG14361是一种有效的PARP1抑制剂,它可通过诱导caspase 3/7的活化而调控细胞周期异常,并抑制NF-κB信号激活[21]。WANG等[22]使用AG14361处理胃癌细胞时发现,AG14361可增强顺铂耐药的胃癌细胞的化疗敏感性。而5-FU作为胃癌化疗过程中最常见的化疗药物之一,AG14361对其化疗敏感性影响的研究尚少。因此,本研究首先通过对胃癌AGS细胞使用AG14361抑制剂处理,观察其对细胞生物学行为的影响,结果发现,AGS细胞细胞增殖、集落形成能力显著降低,细胞凋亡显著增加。于是使用AG14361联合5-FU分别处理AGS和SGC-7901胃癌细胞系,观察其对5-FU化疗敏感性的影响,结果显示其可显著降低化疗药物5-FU的IC50,这说明AG14361也可显著增强化疗药物5-FU对胃癌细胞的敏感性,这也为PARP1抑制剂AG14361联合放化疗药物治疗胃癌奠定了一定的实验基础。
为探究AG14361抑制胃癌细胞增殖,增强5-FU敏感性的机制,通过AG14361处理AGS细胞后进行mRNA测序,进一步分析差异基因的变化,并通过信号通路的富集分析发现,N-糖基化修饰在PARP1介导的胃癌细胞增殖中起着重要作用,提示AG14361可通过促进胃癌细胞糖基化修饰进而提高胃癌细胞对5-FU的敏感性。糖基化修饰是蛋白翻译后修饰中最重要的加工环节之一,尤其是N-糖基化修饰,占到生物体总糖基化修饰的一半以上,其异常修饰常与细胞癌变、转移、抗原提呈、免疫逃逸等肿瘤生物学行为密切相关[23]。FUT8属于岩藻糖基转移酶家族,是参与N-聚糖核心岩藻糖基化的关键酶[24]。研究结果[25]显示,FUT8在多种肿瘤细胞中表达增高,而胃癌症表达则显著降低;临床研究结果[26-27]也显示,胃癌患者FUT8的表达与胃癌患者生存、淋巴结转移和预后等多种病理临床特征密切相关,即FUT8表达越高,患者总体生存率越好,但具体机制尚不清楚。本研究使用AG14361处理AGS细胞,通过生物信息这方法进行mRNA测序和KEGG基因聚类分析,发现AG14361处理后N-糖基转移酶FUT8等基因的表达显著升高,并且抑制PARP1表达后AGS细胞内FUT8显著升高。
为进一步证实PARP1通过调控胃癌细胞中FUT8的表达介导胃癌细胞的恶行进展,对AGS细胞进行FUT8干扰处理,同时使用AG14361处理,观察胃癌AGS细胞的增殖、集落形成和凋亡状况,结果发现AG14361可以显著逆转AGS细胞FUT8干扰带来的胃癌细胞生物学行为的改变,这进一步说明了PARP1可能通过下调胃癌细胞中FUT8的表达促进胃癌细胞的恶性进展。当然,本研究仅从生物学行为上初步证实抑制PARP1的表达可以通过增加FUT8的表达,抑制胃癌细胞的恶性改变,从而达到抑制胃癌细胞增殖的效果,而其中的具体机制有待进一步深入研究。
综上所述,本研究通过以胃癌组织和胃癌细胞的为研究对象,初步证实了PARP1可通过促进N-糖基转移酶FUT8的表达介导胃癌细胞凋亡和影响化疗药物敏感性,这为AG14361等PARP1抑制剂转化至临床治疗胃癌等肿瘤提供了实验依据。

