EBV阳性鼻咽癌相关性中性粒细胞抑制肿瘤微环境中的CD8+T细胞活化
欧阳蒂君,陈楠,杨洁莹,陈媛媛,向橦,▲,夏建川(.中山大学附属第五医院肿瘤科,广东 珠海 59000;.中山大学肿瘤防治中心实验研究部,华南肿瘤学国家重点实验室,肿瘤医学省部共建协同创新中心,广东省鼻咽癌诊断与治疗重点实验室,广东 广州 50060)
鼻咽癌(nasopharyngeal carcinoma,NPC)是起源于鼻咽黏膜上皮的恶性肿瘤,有三种病理亚型:角化型鳞癌、非角化型鳞癌和基底样鳞癌。非角化型NPC是NPC流行地区主要的病理亚型,且与EBV感染高度相关[1]。EBV阳性的NPC是一种典型的“热”肿瘤,其被大量的淋巴细胞所浸润,淋巴细胞浸润密度越高,患者的预后越好[2]。然而,有研究[3-8]发现,EBV可通过多种方式形成免疫抑制微环境,帮助NPC细胞发生免疫逃逸。肿瘤相关性中性粒细胞(tumor-associated neutrophil,TAN)是肿瘤免疫微环境中的重要组成部分,已被发现在乳腺癌[9-11]、肺癌[12-13]、结直肠癌[14-15]、肝癌[16-17]、胃癌[18-19]、小肠癌[20]等多种癌症中发挥重要作用。但是,有关TAN在NPC中所产生的作用以及EBV感染与NPC TAN之间的关系的研究仍存在缺失。本研究探讨NPC中EBV感染与TAN的关系,探讨NPC中TAN在免疫微环境中所起的作用及其与NPC患者预后和临床特征之间的关系。
1 材料与方法
1.1 实验用细胞与试剂
人NPC细胞株HK1、HK1-EBV细胞均由华南肿瘤学国家重点实验室(暨中山大学肿瘤防治中心)提供。中性粒细胞与CD8+T细胞通过密度梯度离心法从健康志愿者的外周血中分离获得,具体操作步骤见实验方法部分。胎牛血清(16140089)、RPMI 1640无血清培养基(C11875500BT)和CTSTMAIM VTM无血清培养基(A3021002)均购自美国Gibco公司,Q-VD-OPh(1-800-343-7475)购自美国R&D公司,抗人髓过氧化物酶(myeloperoxidase,MPO)一抗(ab9535)购自美国Abcam公司,抗人CD8一抗(ZA-0508-0.2)、抗鼠/兔通用型免疫组化检测试剂盒(GK500710)和EBER检测试剂盒(原位杂交法)(ISH-7001-50)均购自中国中杉金桥公司,人外周血淋巴细胞分离液(LTS1077-1)购自中国天津灏洋公司,红细胞裂解液(CW0613S)购自中国康为世纪公司,CD8磁珠(130-045-201)购自德国美天旎公司,流式用抗人CD15抗体(301904)、抗人CD16抗体(360704)、抗人CD8a抗体(300926)、抗人CD182抗体(551125)和Zombie染料(423107)均购自美国Biolegend公司,流式用抗人CD69抗体(555530)、抗人PD-1抗体(558694)、抗人CD206抗体(321104)及AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒(556547)均购自美国碧迪公司,Transwell小室购自美国康宁公司,人CD3/CD28 T细胞活化添加剂(10971)购自加拿大Stemcell公司。
1.2 细胞培养
使用含有10%胎牛血清的RPMI 1640无血清培养基培养人NPC细胞株HK1,使用含有10%胎牛血清和G418(200 μg/mL,ant-gn-5)的RPMI 1640无血清培养基培养人NPC细胞株HK1-EBV,使用含有10%胎牛血清和3 μmol/LQ-VD-OPh的RPMI 1640无血清培养基培养中性粒细胞,使用含有10%胎牛血清和300 U/mL IL-2的CTSTMAIMVTM无血清培养基培养CD8+T细胞,均置于37°C、5% CO2的培养箱内培养,根据细胞密度和状态及时更换新鲜培养基和传代。
1.3 临床病理组织样本
本研究所使用的NPC石蜡组织切片均由中山大学肿瘤防治中心提供。用于检测NPC组织中CD8+T细胞和TAN浸润情况及用于分析MPO表达水平与患者生存预后关系的石蜡包埋的NPC组织切片均来自2008年至2012年期间中山大学肿瘤防治中心收治的118例初治无转移NPC患者。患者纳入标准:(1)病理检查确诊为NPC;(2)术前未行放疗、化疗、靶向治疗和免疫治疗;(3)临床资料及手术标本组织保存完整;(4)完成随访记录;(5)EBV编码的小RNA(EBER)检测阳性。患者排除标准:(1)失访患者;(2)合并其他系统肿瘤的患者;(3)术后因并发症死亡患者;(4)因其他原因死亡患者。研究方案获医院伦理委员会批准(伦理审批号:GZR2021-029),并取得患者的知情同意和签署知情同意书。
1.4 密度梯度离心法分离中性粒细胞
取健康人外周血样本,用PBS稀释,再将其缓缓倒至人外周血淋巴细胞分离液的上层,1 200×g离心25 min后吸弃上清液,按照体积比3∶1加入红细胞裂解液重悬细胞,于冰上摇晃裂解30 min,400×g离心后吸弃上清液,加入PBS重悬细胞沉淀,400×g离心后吸弃上清液,沉淀即为中性粒细胞。
1.5 密度梯度离心法分离CD8+T细胞
取健康人外周血样本,加入人外周血淋巴细胞分离液后离心,吸取样本中间的白膜层,加入PBS离心后吸弃上清液,按照体积比3∶1加入红细胞裂解液重悬细胞,室温下反应10 min,离心后吸弃上清液,加入PBS清洗细胞沉淀,离心后吸弃上清液,细胞沉淀按照磁珠分选说明书的操作步骤用CD8磁珠分选CD8+T细胞。
1.6 免疫组织化学法检测NPC组织中的MPO和CD8表达
将NPC石蜡组织切片经烤片、脱蜡、梯度水化,pH9.0的EDTA抗原修复液进行修复、37℃封闭1 h,加入抗MPO一抗(1∶100)、抗CD8一抗37 ℃处理1 h,加入二抗37 °C处理30 min,经显色、复染、分化、返蓝、乙醇脱水干燥、封片[21],观察NPC组织中MPO和CD8的表达情况。采用HALO软件对免疫组化染色结果进行病理评分,得H-Score(软件评分系统根据染色强度及阳性染色肿瘤细胞数进行综合评分)。根据H-score的评分结果,用受试者工作特征曲线(ROC)求取其截断值。定义H-score大于等于截断值的组织切片为高表达,定义H-score小于截断值的组织切片为低表达。
1.7 EBER原位杂交法检测NPC细胞和组织的EBV感染情况
细胞处理:将鼻咽癌细胞系HK1细胞悬液滴在防脱处理过的载玻片上,应保证样品是单层细胞,室温干燥30 min,用4%多聚甲醛室温固定细胞10 min,PBS冲洗2 min×3次,逐级乙醇脱水(70%乙醇2 min、95%乙醇2 min、100%乙醇2 min),空气干燥。组织切片处理:石蜡包埋的NPC组织切片经烤片和脱蜡,在新鲜100%乙醇中放置5 min后,空气干燥。将上述处理过后的组织切片和细胞样品每个样品加入300~400 μL新鲜配制的胃酶工作液,于37℃处理,其中石蜡切片处理30 min、细胞样品处理10 min,弃去胃酶工作液后,逐级乙醇脱水(70%乙醇1 min、95%乙醇1 min、100%乙醇1 min),空气干燥。混匀探针溶液,在每张切片上加10~20 μL适量的探针,加盖盖玻片,置于湿盒中37℃处理2 h;将切片浸入PBS缓冲液中10 min,直到盖玻片自然脱落,用PBS缓冲液冲洗切片2 min×3次,取出切片,擦干多余的缓冲液。切片上加入适量辣根过氧化物酶标记的抗地高辛抗体溶液,37 ℃处理30 min,PBS冲洗1 min×3次,用蒸馏水冲洗切片1 min;擦净切片边缘的水分,加入适量配制好的DAB工作液,在显微镜下观察到样品出现棕色时,即可用蒸馏水终止显色。复染和封片,对结果进行判读:无棕色染色的为EBV阴性细胞株,有棕色染色的为EBV阳性细胞株。
1.8 H-E染色法检测NPC组织切片中TAN的核形态
同免疫组织化学染色的步骤,将NPC组织切片进行烤片、脱蜡、梯度水化、复染、分化、返蓝处理;伊红染色1 min,流水冲洗后进行乙醇脱水、干燥、封片,对结果进行判读。
1.9 吉姆萨染色法检测健康人外周血中性粒细胞的细胞核形态
取从健康人新鲜外周血中即时分离出的中性粒细胞,涂在防脱处理过的载玻片上,应保证样品是单层细胞,室温干燥30 min;滴加瑞氏-吉姆萨染液A液于涂片上,染色1 min;再将磷酸盐缓冲液(pH=6.8)滴加于A液上,滴加量为A液的2倍,以洗耳球吹出微风使液面产生涟漪状,使两液充分混合,染色3 min;取蒸馏水以流水冲洗玻片,待玻片干燥后,用中性树胶封片,显微镜观察。
1.10 流式细胞术检测中性粒细胞的纯度、凋亡和极化
HK1、HK1-EBV细胞培养上清液的制备:取2.5×106个HK1和HK1-EBV细胞,均匀地铺在T75的培养瓶中,置于37°C、5% CO2的培养箱内培养。待细胞贴壁后,更换培养基,每个T75瓶中加入20 mL的完全培养基,置于37°C、5% CO2的培养箱内培养3 d后,收集上清液,400×g离心5 min,获取的上清液即作为HK1、HK1-EBV细胞培养上清液。
从健康人外周血中分离出中性粒细胞,取1×105个细胞,加入提前稀释好的Zombie染料(1∶1 000),4 ℃避光处理20 min;离心后弃上清液,加入抗人CD15抗体和抗人CD16抗体,混匀;4℃避光处理15 min;离心后弃上清液,每管加入200 μL预冷的PBS重悬细胞,立即上流式细胞仪检测中性粒细胞的纯度。将分离出的中性粒细胞用加入了HK1、HK1-EBV细胞培养上清液的培养基进行培养(肿瘤细胞培养上清液体积∶完全培养基体积=1∶1),用无血清培养基加完全培养基培养的中性粒细胞作为对照组,置于37°C、5% CO2的培养箱内培养,分别培养24、48和96 h,第72 h时补液。取1×105个经处理过的中性粒细胞,根据细胞凋亡检测试剂盒说明书,加入AnnexinⅤ染料和PI染料,混匀,4℃避光处理15 min,立即使用流式细胞仪上机检测中性粒细胞的凋亡情况;取1×105个经处理过的中性粒细胞离心,加入提前稀释好的Zombie染料(1∶1 000)重悬细胞,4℃避光处理20 min;离心后弃上清液,加入抗人CD182抗体和抗人CD206抗体,4℃避光处理15 min,离心后弃上清液,每管加入200 μL预冷PBS重悬细胞,立即使用流式细胞仪上机检测中性粒细胞的极化标志物表达情况。
1.11 流式细胞术检测CD8+T的CD69和PD-1的表达
从健康人外周血中分离出CD8+T细胞,将分离得到的CD8+T细胞用加入了人CD3/CD28 T细胞活化添加剂(1∶25)的培养基培养24 h,24孔板铺板,每孔加入5×105个细胞。一组中加入同等数量的用HK1、HK1-EBV细胞培养上清液处理过的中性粒细胞;另外一组放入0.4 μm孔径的Transwell小室,在小室上层加入同等数量的用HK1、HK1-EBV细胞培养上清液处理过的中性粒细胞,置于37°C、5% CO2的培养箱内,培养18 h后测CD69的表达,培养96 h后测PD-1的表达。将上述经过处理的T细胞收集离心,加入提前稀释好的Zombie染料(1∶1 000)重悬细胞,4 ℃避光孵育20 min;离心、弃上清液,加入抗人CD8a抗体、抗人CD69抗体或抗人PD-1抗体,混匀;4℃避光处理15 min;离心后弃上清液,加入200 μL预冷PBS重悬细胞,立即使用流式细胞仪上机检测CD8+T的CD69和PD-1的表达。
1.12 统计学处理
采用IBM SPSS Statistics 25.0软件分析结果数据,GraphPad Prism 9.0软件绘制图表,FlowJo V10软件分析流式细胞术实验结果并绘制图片。符合正态分布的计量数据均以±s表示,均数检验采用两独立样本t检验(双侧),等级资料的相关分析采用卡方检验,生存曲线的绘制采用Kaplan-Meier法,单因素分析应用Log-Rank test法,多因素分析采用Cox比例风险模型。以P<0.05或P<0.01表示差异具有统计学意义。
2 结果
2.1 CD8+T细胞和TAN在NPC组织中的浸润情况
为了研究CD8+T细胞的浸润与EBV感染之间的关系,首先对NPC的组织切片进行免疫组织化学染色,初步分析CD8+T细胞的浸润情况。染色结果(图1A、B)显示,相比于EBV阴性的肿瘤组织,CD8+T细胞在EBV阳性的NPC组织中的浸润明显增多(P<0.000 1)。进一步在NPC连续组织切片的H-E染色中发现,EBV阳性NPC组织中有大量多型核细胞浸润,而EBV阴性肿瘤组织中这类细胞出现较少(图1A)。考虑到在肿瘤组织浸润的免疫细胞中,形态呈多型核的细胞主要为TAN。因此,利用相对应的NPC组织切片进行TAN标志物MPO的免疫组织化学染色,结果(图1C、D)证实,在EBV阳性NPC中,肿瘤组织中有更多的TAN浸润(P<0.000 1)。
TAN在NPC组织中不仅呈现出了与CD8+T细胞相同的分布规律,并且与后者的数量存在着明显的负相关关系。分析结果(图1E)显示,在EBV阳性的NPC组织当中,MPO阳性的细胞数越多,CD8+T细胞的数量越少(r=-0.505 1,P=0.005 2),而这种相关性在EBV阴性的肿瘤组织中并未体现。
2.2 MPO的表达与EBV阳性NPC患者的临床特征和生存预后的关系
为了进一步探索EBV阳性NPC肿瘤微环境中浸润增多的TAN与CD8+T细胞之间的关系以及其临床意义,本课题组调取了中山大学肿瘤防治中心在2008年至2012年期间收治的118例经病理确诊、初治且无转移、EBER检测为阳性的NPC患者治疗前的石蜡包埋肿瘤组织切片。将这118例肿瘤组织的连续切片进行MPO和CD8的免疫组化染色。染色结果用HALO分析软件进行病理评分,得到H-score。图2A即MPO染色的代表性组织切片及其相对应的CD8免疫组化染色图。将这118例NPC组织切片的MPO H-score与CD8 H-score进行相关性分析(图2B),进一步证实了在EBV阳性NPC组织中,MPO+细胞的数量与CD8+细胞的数量呈负相关(r=-0.220 2,P=0.016 6)。
根据MPO H-score的结果,用ROC求取其截断值。根据截断值将118例EBV阳性NPC患者分为MPO高表达组(69例)和MPO低表达组(49例),采用Kaplan-Meier生存曲线和Log-Rank检验比较两组患者10年总生存时间(OS)和10年无进展生存时间(PFS)的差异。Kaplan-Meier生存曲线分析结果显示,相比于MPO低表达的患者,MPO高表达的患者具有更短的OS(P=0.025,图2C)和更短的PFS(P=0.027,图2D)。采用Cox比例风险模型评估影响NPC患者10年OS和10年PFS的独立预后因子,纳入的变量包括年龄、性别、T分期、N分期、M分期、临床分期及MPO表达水平。结果(表1)显示,年龄、临床分期和MPO表达水平是影响EBV阳性NPC患者10年OS的独立预后因子,MPO高表达与EBV阳性NPC 患者更短的 OS(P=0.035,HR=3.09,95%CI:1.15~8.29)密切相关,年龄和临床分期还影响了EBV阳性NPC患者10年PFS。将患者的临床基本特征与MPO的表达水平进行分析发现,不同T分期(T1~2和T3~4)患者的MPO表达水平存在显著差异(P=0.028)(表2)。在T1~2分期的EBV阳性NPC患者中,MPO表达水平高的患者所占比例达51.9%;而在T3~4分期的EBV阳性NPC患者中,MPO表达水平高的患者所占比例高达73.0%。
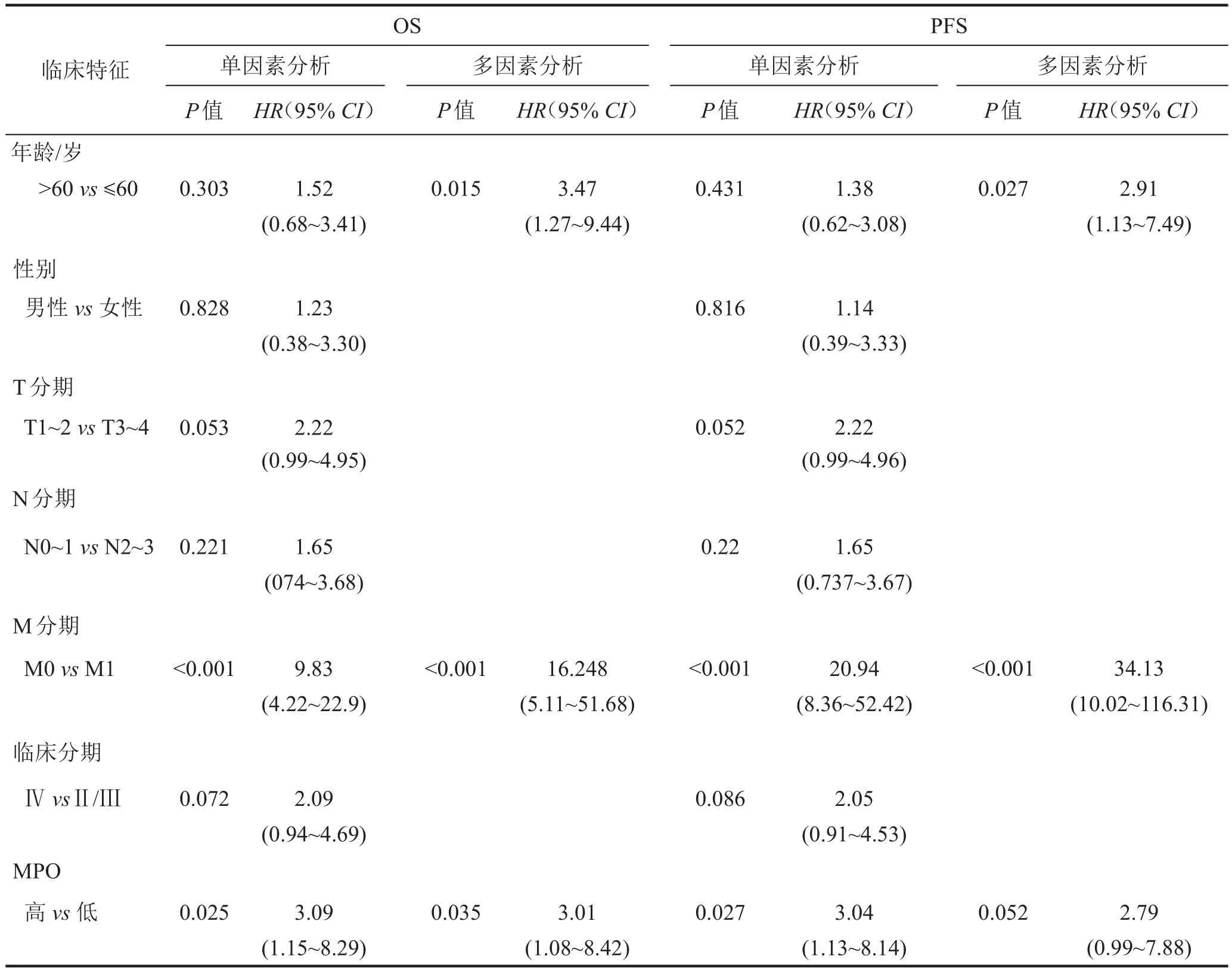
表1 EBV阳性NPC患者10年OS和10年PFS的单因素和多因素分析
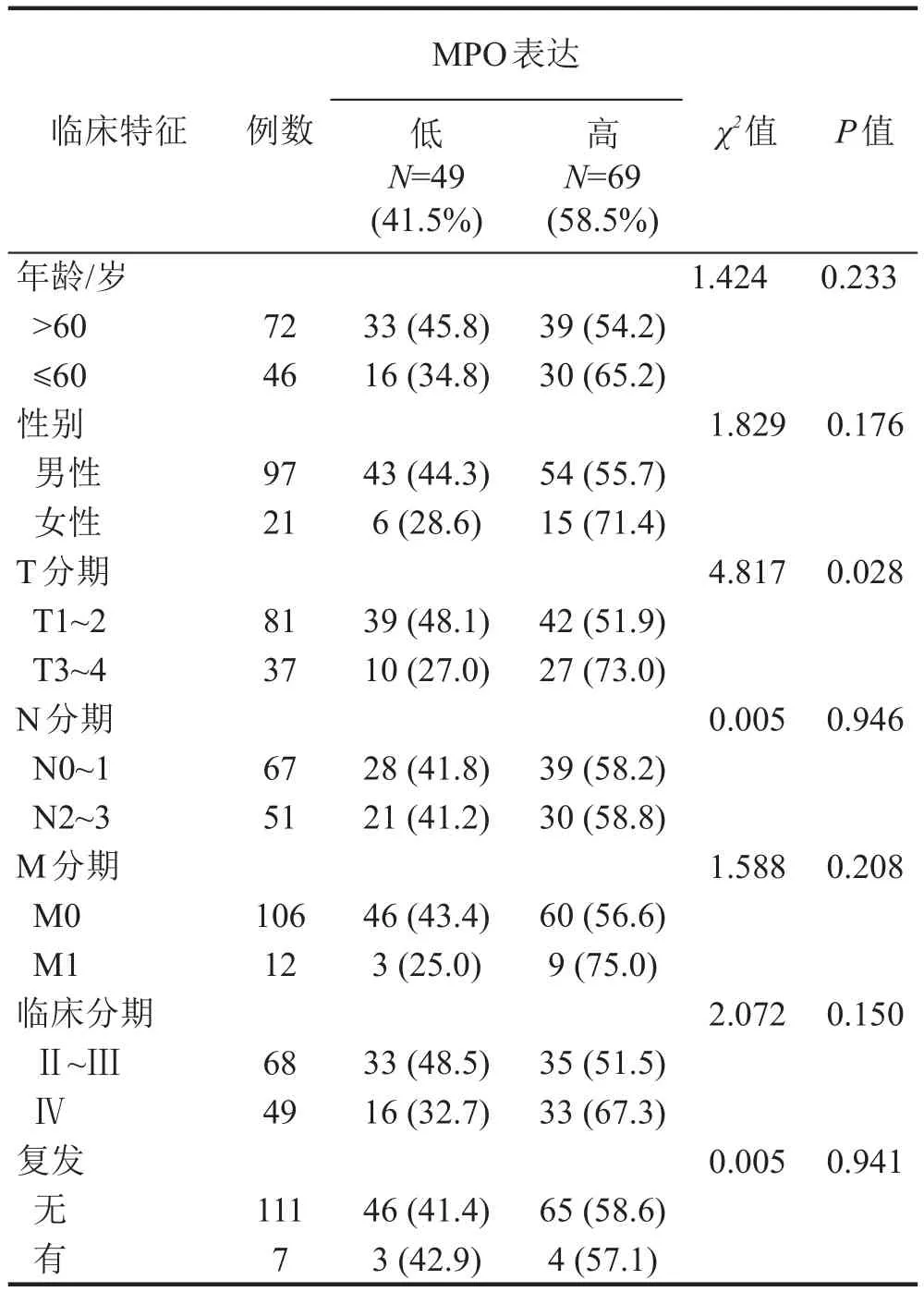
表2 EBV阳性NPC患者临床基本特征与MPO的表达水平之间的关系[n(%)]
2.3 HK1-EBV细胞培养上清液可诱导TAN向N2型方向极化
基于上述研究结果推测,EBV阳性NPCTME中的TAN具有促进肿瘤发生发展的作用,为N2型中性粒细胞。为了证实这一推测,用密度梯度离心法分离出健康志愿者外周血中的中性粒细胞。如图3A、B所示,此方法分离出的细胞中有90%以上的细胞为中性粒细胞,细胞核呈分叶形。考虑到中性粒细胞的存活时间短,在中性粒细胞的培养基中加入了凋亡抑制剂Q-VD-OPh以延长其存活时间。结果表明,在加入凋亡抑制剂的情况下,中性粒细胞存活时间可延长至第4天,其存活率仍可达50%左右。
在此基础上,将无血清培养基和HK1、HK1-EBV细胞培养上清液与完全培养基1∶1混合,培养分离出的TAN,并于培养24、48和96 h后测定其N2型标志物 CD182(图4A、B)和CD206(图4C、D)的表达。结果显示,在培养24 h后,相比于对照组,HK1、HK1-EBV细胞培养上清液培养的TAN表面的CD182和CD206有上升的趋势,EBV阳性组的上升趋势更明显,但是与阴性组之间并无统计学意义的差异;培养48 h后,HK1-EBV细胞培养上清液处理的TAN的CD182和CD206表达进一步升高,并且EBV阳性组的中性粒细胞表达的CD182与对照组产生了具有统计学意义的差异(P<0.05);培养96 h后,各组的TAN表达的N2型标志物均有升高,相比于EBV阴性组,EBV 阳性组中的 TAN 表达的 CD182(P<0.001)和CD206(P<0.01)升高显著。
2.4 HK1-EBV细胞培养上清液极化后的TAN抑制CD8+T细胞的活化
为了在体外验证TAN对CD8+T细胞的影响,将上述用HK1、HK1-EBV细胞培养上清液诱导极化4 d后的TAN和CD8+T细胞共培养,检测其活化的标志物。为了更加明确TAN和CD8+T细胞之间的作用方式,将共培养系统分为了两组:一组采用TAN和T细胞直接混合的共培养方式,另外一组采用了0.4 μm的Transwell小室,上室接种TAN,下室铺同等数量的CD8+T细胞,模拟间接接触的作用方式。结果显示,在间接接触的共培养系统中,与对照组相比,CD8+T细胞受到HK1、HK1-EBV细胞培养上清液极化后TAN的影响,其表面活化标志物CD69的表达呈现出升高的趋势(P<0.01)(图5A)。然而,在直接混合的共培养系统中,CD8+T细胞在与极化后的中性粒细胞共培养18 h后,其表面活化标志物CD69的表达明显下降(P<0.000 1),且EBV阳性组和阴性组之间具有显著差异(P<0.001):与EBV阴性组相比,经HK1-EBV细胞培养上清液处理过后的TAN能更明显地抑制T细胞表面的CD69表达(图5B)。
除此之外,在共培养4 d后,与对照组相比,CD8+T细胞受到HK1、HK1-EBV细胞培养上清液极化后TAN的影响,其细胞表面PD-1表达升高(P<0.001),且EBV阳性组中的PD-1升高程度大于阴性组(P<0.05)(图5C)。当CD8+T细胞与极化后的TAN直接接触培养后,其表面的PD-1的表达升高更加明显(P<0.000 1),且HK1-EBV细胞培养上清液极化后的TAN能够刺激T细胞表达更多的 PD-1(P<0.001)(图5D)。
3 讨论
NPC的分布在地域上极不平衡,好发于东亚和东南亚,中国尤为鼻咽癌高发地区[22]。近年来,随着放疗技术的提升和其他治疗手段的改进,早期NPC患者的生存率大大提高,但是远处转移和局部复发的NPC患者仍无法得到有效的救治[23]。因此,亟待寻找更有效的NPC治疗方法。随着免疫检查点抑制剂的兴起,以PD-1/PD-L1免疫检查点抑制剂为代表的免疫治疗大大改变了目前肿瘤治疗的局面,为患者带来了长期生存的希望。有关PD-1/PD-L1单抗在NPC治疗中的应用研究也在如火如荼地开展。有研究[24]显示,PD-1单抗在治疗晚期或复发的NPC中具有显著的疗效。但是,也有研究[22]表明,仍有部分NPC患者使用PD-1抗体疗效差,其原因尚不清楚。研究[25]发现,EBV阳性NPC患者的肿瘤微环境中有大量耗竭的CD8+T细胞和调节性T细胞。EBV感染可激活ATR通路,加速TAM向M2的转化[7]。这些发现提示,EBV感染在形成NPC免疫抑制微环境,帮助NPC细胞发生免疫逃避的过程中发挥了重要的作用。因此,深入了解NPC肿瘤微环境发生的变化,对认识免疫治疗在NPC中的作用具有重要意义。
本研究首先通过免疫组织化学染色发现,在EBV阳性NPC组织中有更多的CD8+T细胞和TAN浸润,更为重要的是,这两者在数量上呈负相关关系。通过对118例人EBV阳性NPC组织标本进行染色,发现EBV阳性NPC组织中高表达的TAN与患者的不良预后密切相关,且TAN是EBV阳性NPC患者总生存时间的独立预后因子。中性粒细胞是一种多型核固有免疫细胞,也是肿瘤微环境中的重要组成部分[26]。近年来,人们将肿瘤组织中的中性粒细胞统称为TAN。根据TAN对肿瘤产生的作用,可分为N1型和N2型。N1型TAN起抗肿瘤作用,N2型TAN起促肿瘤作用[27-28]。因此推测,EBV阳性NPC肿瘤微环境中的TAN为N2型。本研究进一步证实,与HK1细胞培养上清液相比,HK1-EBV细胞培养上清液可使TAN表达更多的N2型标志物:CD182、CD206。N2型TAN是抑制性肿瘤微环境中的一个重要组成部分,可通过多种机制发挥免疫抑制作用,例如N2型TAN可抑制CD8+T细胞和NK细胞的功能[29],并可促进其凋亡[30];可分泌促肿瘤发生发展的物质,例如N2型TAN分泌的MMP9能通过VEGF-A的作用,诱导肿瘤血管的生成[31];N2型TAN可分泌细胞外网,促进肿瘤细胞的转移[9,10,32]。本研究发现,经HK1-EBV细胞培养上清液极化后的N2型TAN可以抑制CD8+T细胞的活化,降低其CD69的表达并促进其PD-1的表达。
越来越多的研究[7,21,33-34]证明,EBV感染影响了肿瘤细胞和肿瘤微环境之间的相互作用。本研究首次发现:在EBV阳性NPC中,中性粒细胞浸润增多并极化成为N2型TAN,可抑制CD8+T细胞的活化,参与形成免疫抑制微环境,与NPC患者的不良预后密切相关。本课题组将进一步深入研究N2型TAN通过抑制CD8+T细胞参与肿瘤免疫逃逸的具体机制并通过N2型TAN相关的靶向清除剂进一步提高针对EBV阳性NPC的临床肿瘤免疫治疗疗效。

