ITGB2在肾细胞癌组织中的表达及其对ACHN细胞恶性生物学行为的影响
王琦,樊博,刘彬,马永良,任宗涛,张爱莉(河北医科大学第四医院 泌尿外科,河北 石家庄 050011)
据统计,肾细胞癌(renal cell carcinoma,RCC)的发病率在全世界男性肿瘤发病率中排名第九,在女性肿瘤发病率中排名第14位[1]。2018年,全球约有40万人被诊断为RCC[2],尽管总体发病率有所增加,但在过去的三十年中,相对存活率有所提高[3]。有报道[4]显示,早期RCC的5年生存率为93%。由于肾的解剖位置隐蔽,相当一部分RCC患者发现时已是晚期,可能出现“肾癌三联征”(血尿、腰痛、腹部肿块),且伴有远处器官转移,失去了治疗的最佳时机。目前,局限性RCC的治疗方法治疗包括肾切除术、放射消融、局部栓塞和主动监测,而转移性RCC(metastatic RCC,mRCC)需要手术与全身治疗相结合。由于RCC对传统放化疗并不敏感,所以近些年出现了许多针对mRCC的新疗法,包括靶向治疗和免疫治疗[5]。但靶向治疗、免疫治疗仍有一定局限性,因此迫切需要进一步探索RCC进展的分子机制,并找到更为有效的治疗靶点。
整合素 β2(integrin β2,ITGB2)也称为 CD18,位于人染色体21q22.3,是一种细胞表面穿膜受体,参与细胞与细胞外基质的交互作用,具有内外双向信号转导能力[6]。多项研究[7-9]表明,ITGB2在乳腺癌、结肠癌、卵巢癌等多种肿瘤中异常高表达,其高表达可促进肿瘤的侵袭及转移。但ITGB2在RCC中的表达及恶性生物学行为在国内外文献中罕有报道,本研究通过检测ITGB2在RCC组织的表达情况,分析了其相对表达量与临床各参数间的关系;同时,用shRNA干扰ACHN细胞中ITGB2的表达,检测体外环境中敲低ITGB2对ACHN细胞增殖、迁移和侵袭能力的影响,分析ITGB2在RCC发生发展中的作用及特点,为治疗RCC寻找潜在靶点。
1 资料与方法
1.1 组织标本、细胞及主要试剂
选取2016至2020年河北医科大学第四医院生物标本库留存的66例RCC患者的手术标本,所有患者术前均未接受任何治疗。每例标本均取RCC原发病灶组织及距癌组织3 cm处癌旁组织。所有标本的切取和使用经河北医科大学第四医院伦理委员会批准通过(伦理审批编号:2020086)。所有研究对象均签署知情同意书。患者相关信息采集自临床病历,病理资料收集自病理诊断报告。
标本一部分采用福尔马林固定,常规蜡块切片留做免疫组化染色;另一部分新鲜状态下放入RNALater™动物组织RNA稳定保存液中置于4℃冰箱保存24 h后转入-80℃低温冰箱中长期保存,用于后期提取组织RNA。肾上皮细胞293T、RCC细胞786-O、ACHN由河北省肿瘤研究所留存并传代,均在含10%胎牛血清的DMEM培养基中,放置于37℃、5% CO2的培养箱中进行常规培养。
逆转录试剂盒购自Roche公司,Lipofectamine 2000购自Invitrogen公司,胎牛血清购自PAN-Biotech公司,DMEM培养基购自Gibco公司,ITGB2抗体购自Abcam公司,敲低ITGB2的shRNA由上海吉玛基因公司设计,MTS试剂购自Promega公司,BCA蛋白浓度测定试剂盒购自Solarbio公司,细胞周期试剂盒购自联科生物公司,免疫组化试剂盒购自中杉金桥公司。
1.2 通过网络大数据库分析ITGB2在RCC组织中的表达
通过整合公共数据库(GEPIA)(http://gepia.cancer-pku.cn/index)中癌症基因表达的数据,以进行生物信息学分析,比较RCC和癌旁组织之间ITGB2的表达情况。
1.3 qPCR法检测RCC组织和细胞中ITGB2的表达
按照TRIzol试剂说明书,逐步提取RCC组织、癌旁组织、肾上皮细胞293T及肾癌细胞786-O、ACHN的总RNA,然后将总RNA逆转录成cDNA,以cDNA为模板,以GAPDH为内参,进行qPCR检测ITGB2的表达。ITGB2上游引物为5'-CTCCAACCAGTT TCAGACCG-3',下游引物为5'-CGTCATCAGTGG CAAACACC-3';内参GAPDH上游引物为5'-AGG TGAAGGTCGGAGTCAACG-3',下游引物为5'-AGGGGTCATTGATGGCAACA-3'。qPCR反应条件:95℃预变性10min;95℃变性15 s、57℃退火15 s、72℃延伸30 s,共40个循环,72℃终延伸7 min。每个样本设3个复孔。根据每孔荧光信号达到阈值时经历的循环数记为该组织中ITGB2和GAPDH基因转录水平的CT值,采用相对定量法:△CT=CTITGB2-CTGAPDH,△△CT=△CT癌组织-△CT癌旁组织,以N=2-△△CT法计算目的基因的相对表达量,其数值表示癌组织相对癌旁组织的相对倍数。
1.4 构建敲低ITGB2的shRNA转染至ACHN细胞
2条敲低ITGB2的shRNA序列分别命名为shITGB2-1(序列为5'-GCATTGGCTTCGGGTCCT TCG-3')、shITGB2-2(序列为 5'-GCAGGTGTGACA CTGGCTACA-3'),并以shNC作为对照。选择生长状态良好的ACHN细胞用胰酶消化,将细胞均匀接种于6孔板内。待细胞密度达80%左右时,利用Lipofectamine 2000转染试剂分别将shITGB2-1、shITGB2-2、shNC转染至ACHN细胞中,在DMEM培养基中饥饿6 h后更换为含10%胎牛血清的DMEM培养基,继续培养,共培养48 h。收集转染后的ACHN细胞,提取总RNA,并逆转录为cDNA,应用qPCR法检测转染后细胞中ITGB2的表达情况。
1.5 MTS实验检测敲低ITGB2对ACHN细胞增殖能力的影响
将上述各组细胞转染24 h后常规消化悬浮于培养基中,调整细胞密度后分别接种于96孔板(1.0×103个/孔),每组设置6个复孔。分别于细胞贴壁后的0、24、48、72和96 h在每孔中加入MTS试剂20 μL,培养箱孵育2 h。酶标仪测检测各组细胞在492 nm波长处的光密度(D)值,代表其增殖水平。
1.6 划痕愈合实验检测敲低ITGB2对ACHN细胞迁移能力的影响
将上述各组细胞转染24 h后常规消化悬浮于培养基中,调整细胞密度后分别接种于6孔板(5×105个/孔)。待细胞生长至完全汇合时,用移液枪头垂直6孔板均匀划痕,PBS洗去划落细胞,并加入2 mL无血清培养基继续培养。分别于划痕后的0、12、24 h在显微镜下观察各组细胞的划痕间距,计算细胞迁移率,细胞迁移率=(原始划痕宽度-实时划痕宽度)/原始划痕宽度×100%。
1.7 Transwell实验检测敲低ITGB2对ACHN细胞侵袭能力的影响
将上述各组细胞转染24 h后常规消化悬浮于培养基中,Transwell小室上层加20 μL基质胶过夜,调整细胞密度后接种于小室内(1.0×105个/孔),加入无血清培养基至上室内补齐至200μL;下室内加入600 μL含10%胎牛血清的培养基。培养箱中培养36~48 h后取出小室,用棉签拭去基质胶和上室内细胞,PBS冲洗2次,以4%多聚甲醛固定、0.1%结晶紫染色20 min,显微镜下计数5个随机视野内的细胞数,计算平均数并比较各组间侵袭细胞数的差异。
1.8 流式细胞术检测敲低ITGB2对ACHN细胞周期的影响
将上述各组细胞转染48 h后常规消化悬浮于离心管中,收集1.0×106个细胞,无水乙醇固定,检测当天水化,加PI染液500 μL避光处理30 min,流式细胞仪检测细胞周期。
1.9 WB法检测敲低ITGB2对ACHN细胞中相关蛋白质表达的影响
用蛋白裂解液提取细胞总蛋白,BCA蛋白浓度测定试剂盒检测蛋白浓度,每孔蛋白上样量为30 μg,经SDS-PAGE分离蛋白,转膜90 min,5%的脱脂奶粉封闭1 h,加入一抗(抗ITGB2单抗1∶1 000稀释,抗β-actin单抗1∶2 000稀释),4℃摇床过夜。第2天,加入二抗(山羊抗兔多抗1∶15 000稀释),ECL增强化学发光显色,凝胶成像系统曝光。使用Gel-pro软件对条带进行定量分析,目的条带与β-actin条带灰度值的比值即代表目的蛋白的相对表达量。
1.10 免疫组化SP染色法检测RCC组织中ITGB2蛋白的表达
石蜡标本脱蜡,梯度乙醇脱水各5 min,EDTA(pH 9.0)高压修复10 min,冷却至室温,避光修复,于温箱内用山羊血清封闭,加入一抗(1∶200),4℃冰箱过夜。第2天,滴加生物素化二抗、辣根过氧化物酶标记的三抗,DAB液显色,蒸馏水终止反应,苏木素复染,常规脱水、透明、封片。用显微镜观察染色后的切片,染色为淡黄、棕黄至黄褐色视为阳性细胞。依据随机原则选取切片中5个视野(放大倍数:×400),按以下标准进行评分。总分=细胞膜染色强度评分×视野中阳性细胞占比评分。其中,细胞膜染色强度以无染色为0分、淡黄色为1分、棕黄色为2分、黄褐色为3分。而视野中阳性细胞占比评分以≤10%为0分、>10%~30%为1分、>30%~50%为2分、>50%为3分。总分0~9分,评分>2分为阳性表达,≤2分为阴性表达。
1.11 统计学处理
采用SPSS 22.0统计学软件,符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,多组间的均数比较采用单因素方差分析,非符合正态分布的计量资料用M(Q)表示,采用Wilcoxon或Kruskal-Wallis秩和检验;计数资料以例数和百分比表示,组间比较采用四格表χ2检验。以上结果均采用双侧检验,以P<0.05或P<0.01表示差异有统计学意义。
2 结 果
2.1 ITGB2在RCC组织及RCC细胞中呈高表达
qPCR法检测结果显示,RCC组织中ITGB2 mRNA的相对表达量显著高于癌旁组织(P<0.01,图1A),与GEPIA数据库中的结果相似(图1B)。另外,ITGB2在2株RCC细胞中相对于正常肾上皮细胞表达量均升高(均P<0.01,图1C),且细胞ACHN细胞的ITGB2表达水平较786-O细胞更高,故选取ACHN细胞构建敲低ITGB2的细胞株。
免疫组织化学染色结果显示,ITGB2在RCC组织中阳性表达,在相应癌旁组织中阴性表达(图2)。
2.2 ITGB2在RCC组织中的表达及其与临床参数之间的关系
不同临床分期的RCC组织中ITGB2的表达水平差异有统计学意义(P<0.05)。但按照性别、年龄、有无吸烟史、有无高血压、有无糖尿病、有无淋巴结转移、有无远处转移及病理分化程度进行统计分析,各组RCC组织中ITGB2的表达水平差异均无统计学意义(均P>0.05),见表1。
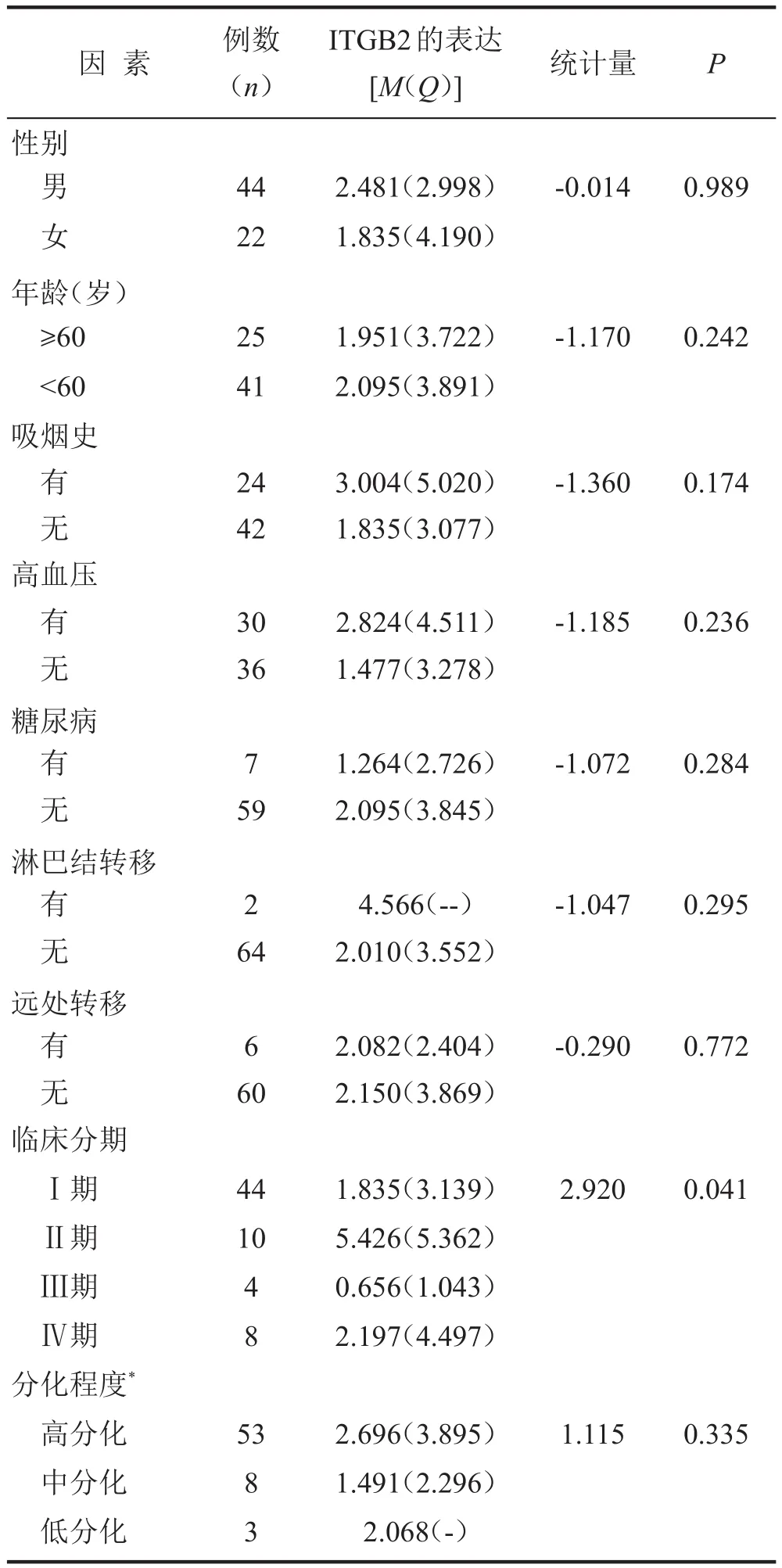
表1 ITGB2在RCC组织中的表达与临床参数之间的关系(N=66)
2.3shRNA-ITGB2转染后敲低ACHN细胞中ITGB2基因和蛋白的表达
qPCR法检测结果(图3)显示,ACHN细胞转染shITGB2-1、shITGB2-2后ITGB2的相对表达量均低于shNC组(均P<0.01),且shITGB2-1、shITGB2-2转染组干扰效率相近,均可进行后续实验。
WB法检测结果(图4)显示,shITGB2-1组、shITGB2-2组的ACHN细胞中ITGB2蛋白表达明显低于shNC组[(0.56±0.18)、(1.89±0.33)vs(4.14±0.41),均P<0.01],表明敲低ITGB2抑制了ACHN细胞ITGB2的蛋白的表达。
2.4 敲低ITGB2抑制ACHN细胞的增殖能力
MTS实验结果(图5)显示,与shNC组相比,72 h时,敲低ITGB2的细胞的D值均显著降低(P<0.05),表明敲低ITGB2抑制了ACHN细胞的增殖能力。
2.5 敲低ITGB2抑制ACHN细胞的迁移能力
划痕愈合实验结果(图6)显示,与shNC组相比,在24 h时,shITGB2-1组、shITGB2-2组细胞的迁移率均显著降低[(51.33±1.88)%、(48.02±2.12)%vs(87.24±3.51)%,均P<0.01],表明敲低ITGB2抑制了ACHN细胞体外迁移能力。
2.6 敲低ITGB2抑制ACHN细胞的侵袭能力
Transwell实验结果(图7)显示,与shNC组相比,每视野中shITGB2-1组、shITGB2-2组穿过人工基底膜的细胞数均显著降低[(110.63±17.38)、(101.89±12.67)vs(389.44±35.03)个,均P<0.05],表明敲低ITGB2抑制了ACHN细胞的体外侵袭能力。
2.7 敲低ITGB2对ACHN细胞周期无明显影响
流式细胞术检测细胞周期结果(图8)示,shITGB2转染组G0期细胞数与shNC组接近,差异无统计学意义(P>0.05),表明敲低ITGB2对ACHN细胞周期无明显影响。
3 讨论
既往研究[10]表明,巨噬细胞介导的炎症反应是许多心血管疾病的关键病理生理过程,ITGB2可通过调节巨噬细胞的运输,参与心肌肥厚的发生,因此ITGB2也被认为是炎症的调节因子。约80%的RCC患者存在肾脏炎症,ITGB2可以将T细胞转移到肠系膜淋巴结,进而促进慢性肾炎的发展[11]。慢性炎症能够促进肿瘤发生、发展的主要原因是慢性炎症的刺激能够导致肿瘤释放许多直接促进肿瘤自身生长的因子[12]。而微环境的改变是炎症发展到肿瘤的关键环节,在一个富含炎性细胞的肿瘤微环境中,失衡的生长因子、激活的黏附分子(如ITGB2等)及胞外基质、促DNA损伤介质增加了细胞失控生长,当细胞长期受到这些失衡的炎症因素调控后可能会导致肿瘤的发生[13]。另外,ZHANG等[14]研究发现,ITGB2通过PI3K/AKT/mTOR通路增强癌症相关成纤维细胞糖酵解活性,从而促进口腔鳞癌细胞增殖。WEI等[15]发现,急性髓系白血病患者中ITGB2的过表达可导致患者预后不良。在鼻咽癌中,既往研究[16]亦发现,STC2/ITGB2/FAK/SOX6信号轴可能是鼻咽癌潜在的一个治疗靶点。在神经胶质瘤中,证实了ITGB2高表达水平的患者有更好的免疫治疗反应[17]。以上研究为本实验打下了良好的理论基础。
本研究通过qPCR检测发现课题组收集的66例RCC组织中ITGB2的表达情况与大数据库中的表达情况一致,从而更好地印证了ITGB2在RCC组织中高表达。在临床病理资料的统计中,本研究发现分期较晚、瘤负荷较大的肿瘤ITGB2表达量更高,因此ITGB2有望成为肾癌分期诊断的新的肿瘤分子标志物。与食管癌等组织淋巴结转移强相关不同[18],肾癌淋巴结转移较少见,肾癌诊疗指南中提出局限性肾癌患者不行淋巴结清扫[19],只有临床可见的区域肿大淋巴结,需要行淋巴结清扫术。MTS实验、划痕实验、Transwell实验结果表明,ITGB2与肾癌细胞增殖、迁移和侵袭能力相关,癌细胞的恶性生物学行为与其转移等不良预后紧密相关。流式细胞术检测显示,ITGB2对细胞周期的影响差异无明显统计学意义,可能该基因不参与调节细胞周期。免疫组化的结果显示,在RCC组织中ITGB2的表达也明显高于癌旁组织,且均为细胞膜染色,表明ITGB2为一种细胞膜表面受体,可能参与细胞与细胞外基质之间信号转导。
综上,本研究从RNA和蛋白质水平均验证了ITGB2与RCC的相关性,为寻找RCC治疗的特异性靶点提供了新的思路,也为RCC的肿瘤标志物探索提供了理论基础,但具体机制仍不明确,有待进一步研究。

