羟丁基壳聚糖联合生物矿化硅复合水凝胶修复小鼠皮肤创伤实验研究
吕宁宇,李 冀,赵之栋,王 琪,白晓伟,傅仰木,李众利
1 解放军医学院,北京 100853;2 解放军总医院第四医学中心 骨科,北京 100048;3 解放军总医院海南医院 骨科,海南三亚 572013
皮肤是人体的保护屏障,外伤或疾病导致的皮肤创伤可引发多种并发症甚至死亡[1]。皮肤创伤的修复第一步是止血,然后经历炎症反应、组织形成、结构与功能重塑,是一个连续性调整的动态过程[2-3]。如何基于该动态过程构建具有复合活性功能、可兼顾止血和皮肤结构重建的创面敷料,是临床亟待解决的问题。复合水凝胶材料充分考虑到了皮肤生长环境因素,同时兼顾有效性、患者可接受性和临床可操作性三个要素,被认为是皮肤创伤修复领域最具应用前景的生物材料之一[4-5]。壳聚糖(chitosan,CS)是一种由甲壳类生物外壳提取物制备的线性多糖,具有生物可降解性、生物相容性、细胞黏附性、抗菌性且无毒[6-7]。羟丁基壳聚糖(hydroxybutyl chitosan,HBC)是对CS分子链的羟基和氨基进行羟丁基化所形成的一种衍生物,其具备CS上述特性的同时,还具有水溶性和温敏性[8-10]。由HBC制备的水溶液在常温下呈液态,在体温环境下形成水凝胶,是创面敷料的良好基质[11]。生物矿化硅(biosilica,BS)是通过对天然海洋硅藻进行转基因修饰、功能筛选、分离纯化得到的硅藻外壳,其微观多孔结构与红细胞之间的界面效应可以促进红细胞的聚集与黏附,从而达到止血的目的[12]。本研究旨在观察和评估HBC/BS复合凝胶敷料对小鼠全层皮肤创伤的修复效果。
材料与方法
1 实验动物 SPF级雄性9周龄C57BL/6J小鼠20只,体质量20 ~ 26 g,购自斯贝福生物技术有限公司。
2 主要试剂 冻干HBC海绵和BS由中国海洋大学冯超教授团队制备提供。CMC-Na/PG水凝胶敷料购自施乐辉公司(Smith & Nephew)。HE染色试剂盒购自生工生物工程(上海)股份有限公司,Masson染色试剂盒购自索莱宝生物技术有限公司,羟脯氨酸(HYP)测定试剂盒购自南京建成科技有限公司,BruU检测的Goat anti-Rabbit二抗工作液购自Abcam公司。
3 HBC水凝胶和HBC/BS复合水凝胶的制备4℃环境下,1.5 g HBC冻干海绵加入48.5 mL去离子水,磁力搅拌,在4℃环境中静置4 h后,再次磁力搅拌,之后在4℃环境下静置24 h,得到质量比为3%的HBC水溶液。称量1 g纯化BS,转移至离心管中,向离心管中加入47.5 mL去离子水,将离心管封口后置于超声环境处理5 min,确保BS均匀分散于去离子水中。超声结束后,向离心管中加入转子,在搅拌情况下将1.5 g冻干HBC海绵加入溶液中以加速HBC的溶解。在4℃下低温搅拌12 ~ 24 h,使溶液混合均匀,可得到HBC/BS水溶液,终体系中HBC浓度为3%,BS浓度为2%,均为质量比。HBC水溶液和HBC/BS水溶液在环境温度达到33℃以上时均可形成均一稳定的水凝胶。
4 皮肤创伤模型制作 小鼠在24℃恒温下单笼饲养。术前准备、麻醉、脱毛后,使用无菌的6 mm活检打孔器在小鼠背部中线两侧腰部水平刻两个直径6 mm的圆形轮廓,齿镊提起轮廓中间的皮肤,眼科剪剪开全层皮肤并切除圆形部分组织,中线另一侧的对称位置重复此操作。因小鼠皮下存在一层可以收缩创面的肉膜肌,故需用固定板来防止创面收缩。固定板制备:用12 mm活检打孔器在1 mm厚的硅胶板上取下直径12 mm的圆,并用8 mm活检打孔器在12 mm圆形硅胶板的中央打孔,形成一个圆环,消毒后作为创面固定板。将固定板圆心对准创面圆心,并用缝线间断缝合的方法将固定板缝合在所有创面外周。
5 分组和处理 小鼠随机分为A、B两组。A组小鼠右侧创面设为HBC/BS组,即实验组;A组小鼠左侧创面为空白对照组;B组小鼠右侧创面为CMC-Na/PG组;B组小鼠左侧创面为HBC组。小鼠单笼饲养,所有创面均每3 d给予1次常规消毒处理并更换固定板。每次消毒后,空白对照组创面直接覆盖透气透明膜,其余各组创面均给予相应的水凝胶200 mg,均匀涂布后覆盖透气透明膜。在15 d和21 d时分别对各组半数小鼠创面组织取样。
6 创面观察和愈合率计算 持续观察组创面出血和愈合情况,在建模后3 d、6 d、9 d、12 d、15 d时分别对创面进行拍照,使用AutoCAD 2020图像分析软件(美国Auto desk公司)测量未愈合创面面积并计算创面愈合率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积 × 100%。
7 创面标本采集 建模后15 d,A、B组各随机抽取5只小鼠,置入二氧化碳箱进行安乐死,对双侧创面进行取样。建模后18 d给予剩余小鼠换药处理,21 d对A、B两组小鼠各自剩余的5只小鼠双侧创面进行取样。两次取样范围一致:以创面圆心为中心,1 cm × 1 cm正方形皮肤全层。即分2个时间节点在4组共取40个创面标本。延中轴将各标本切开,取各标本的50%组织固定于体积分数为10%的甲醛中;另外50%组织切去建模前未损伤的外周部分,将重建的创面放入冻存管做好标记,立即放置于-80℃液氮中。
8 病理学观察 取甲醛中固定的各组各时间点创缘皮肤及创面组织,石蜡包埋后切片(厚5 µm),并分成3部分。第一部分行HE染色,100倍光学数码显微镜下观察炎症细胞浸润、血管新生、再上皮化等情况。第二部分行Masson染色,100倍光学数码显微镜下观察胶原纤维再生和重塑情况。第三部分行5-溴-2-脱氧尿苷(5-bromo-2'-deoxyuridine,BrdU)免疫荧光染色,可直观反映新生的毛囊上皮细胞和角质细胞的密度,于100倍荧光显微镜下观察细胞增殖情况。
9 羟脯氨酸分子检测 取液氮中冻存4组小鼠在建模后15 d和21 d取样的创缘皮肤和创面组织,常规裂解、匀浆,按羟脯氨酸(hydroxyproline,HYP)测定试剂盒操作流程加入试剂混匀后,60℃水浴15 min,冷却后3 500 r/min离心10 min,取上清200 µL加入酶标板中,波长550 nm,测定吸光度值。羟脯氨酸含量(µg/mg,湿重)=(测定OD-空白OD)/(标准OD-空白OD) × 标准品含量(5 µg/mL) × 水解液总体积(10 mL)/组织湿重(mg)。
10 统计学方法 采用SPSS25.0统计软件进行数据分析。计量数据均符合正态分布,以±s表示,多组比较应用单因素方差分析,组间两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
结 果
1 创面愈合观察 伤后各时间点,HBC/BS组创面渗血较空白对照组显著减少,较HBC组和CMC-Na/PG组有所减少;HBC/BS组和HBC组创面均未结痂,肉芽组织生长良好,无分泌物,无异味;CMC-Na/PG组创面少许结痂,肉芽组织生长较好,无分泌物,无异味;而空白对照组创面可见结痂,有少许分泌物。各组均未见明显感染现象。随着建模后时间的延长,各组创面面积均不断缩小。建模后15 d,HBC/BS组和HBC水凝胶创面基本愈合,凝胶组和空白对照组仍可见残余创面。建模后21 d时HBC/BS组、HBC组CMC-Na/PG组创面完全愈合,已愈合的创面中心存在少量瘢痕组织,其中HBC/BS组、HBC组可见大量新生毛发覆盖,空白对照组仍可见残余创面。见图1。

图1 创面大体观。A ~ F分别为A组小鼠建模后0 d、3 d、6 d、9 d、12 d和15 d的创面愈合情况,其中右侧创面给予HBC/BS水凝胶,左侧创面为空白对照;G ~ L分别为B组小鼠建模后0 d、3 d、6 d、9 d、12 d和15 d的创面愈合情况,其中右侧创面给予CMC-Na/PG水凝胶,左侧创面给予HBC水凝胶。B和H为固定板示例Fig.1 Wound healing conditions of mice in group A at day 0, 3, 6, 9, 12 and 15 after modeling (A-F). The right wounds were treated with HBC/BS hydrogel, and the left wounds were blank control. Wound healing conditions of mice in group B at day 0, 3, 6, 9, 12 and 15 after modeling (G-L). The right wounds were treated with CMC-NA /PG hydrogel, and the left wounds were treated with HBC hydrogel.B and H were examples of fixed plates
2 创面愈合率 实验组在建模后3 d、6 d、9 d、12 d、15 d时的创面愈合率均显著高于空白对照组(P<0.01);在3 d、6 d、9 d时的愈合率显著高于CMC-Na/PG组(P<0.01),12 d和15 d时两者无统计学差异(P>0.05);各时间点实验组与HBC组创面愈合率均无统计学差异(P>0.05)。见图2。

图2 各组创面各时间点愈合率比较(n=10,%;aP<0.05, vs HBC/BS group)Fig.2 Comparison of wound healing rates between different groups at each time point (n=10, %; aP<0.05, vs HBC/BS group)
3 病理学观察 HE染色显示,建模后15 d,空白对照组和CMC-Na/PG组创面仍可见少量炎症细胞浸润,实验组和HBC组创面炎症细胞浸润消失,且可见复层鳞状上皮结构已完整覆盖创面。建模后21 d,空白对照组创面未完全愈合,CMCNa/PG组创面见少量炎细胞浸润,可见表皮层、真皮层,但皮肤附属器修复效果较差;实验组和HBC组创面未见炎症细胞浸润,可见皮肤修复完整、层次清晰,其中实验组创面毛囊等皮肤附属器密度较高,接近正常皮肤。见图3。
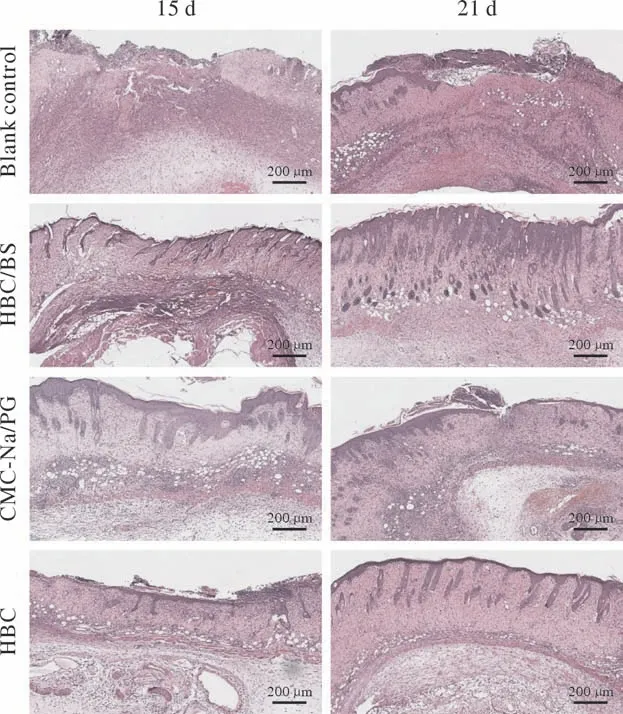
图3 HE染色显示各组创面组织在建模后15 d和21 d的愈合情况(标尺=200 µm)Fig.3 HE staining showed the healing of wound tissue in each group at 15 d and 21 d after modeling (scale bar=200 µm)
Masson染色显示,空白对照组的胶原纤维分布欠均匀,组织相对疏松,排列较为无序,其余3组在建模后15 d和21 d的胶原纤维分布均匀,更加致密,排列整齐有序,其中实验组和HBC组修复程度更高,更接近正常皮肤组织。见图4。
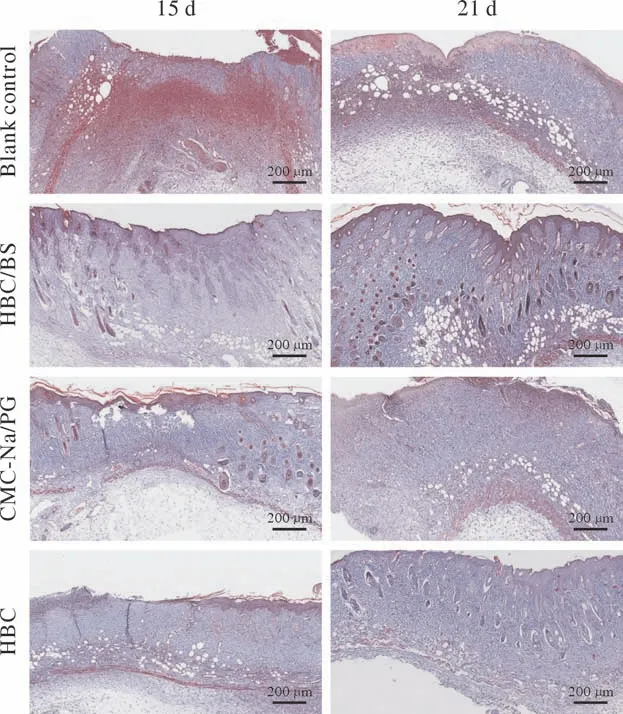
图4 Masson染色显示各组创面组织在建模后15 d和21 d的胶原修复情况(标尺=200 µm)Fig.4 Masson staining showed the collagen repair in wound tissue in each group at 15 d and 21 d after modeling (scale bar=200 µm)
BrdU免疫荧光显示,建模后15 d,空白对照组的未愈合创面中心BrdU荧光密度较低,可见少许新生上皮细胞,未见周围已愈合皮肤组织新生附属器的荧光分布,CMC-Na/PG组的未愈合创面中心BrdU荧光密度较空白对照稍高,周围已愈合皮肤组织可见少许新生附属器的荧光分布,实验组和HBC组未愈合创面中心BrdU荧光密度较高,可见大量新生上皮细胞,周围已愈合皮肤组织可见大量新生附属器的荧光分布;建模后21 d,空白对照组与CMC-Na/PG组的未完全愈合的创面中心BrdU荧光密度较15 d时有所提高,周围已愈合皮肤组织可见少许新生附属器的荧光分布,实验组和HBC组新生皮肤侧的荧光密度高,平整均匀,可见大量新生上皮细胞,其中实验组新生皮肤附属器的荧光分布较其他组更密集。见图5。
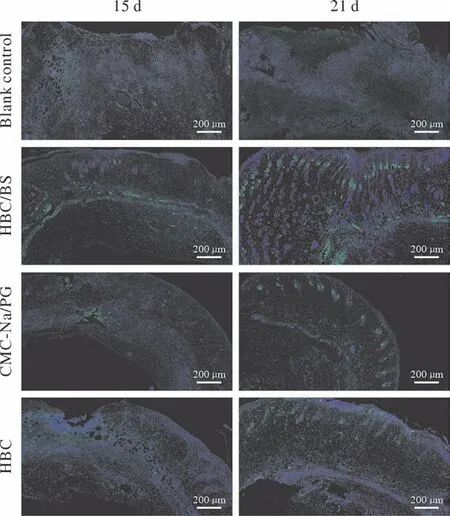
图5 BrdU免疫荧光染色显示各组创面组织在建模后15 d和21 d毛囊上皮细胞和角质细胞的增殖情况(标尺=200 µm)Fig.5 Masson immunofluorescence staining showed the proliferation of hair follicle epithelial cells and keratinocytes in wound tissue in each group at 15 d and 21 d after modeling (scale bar=200 µm)
4 创面组织羟脯氨酸含量比较 建模后15 d,HBC/BS组创面组织的羟脯氨酸的含量高于空白对照组和CMC-Na/PG组(P<0.05),与HBC组无统计学差异(P>0.05);建模后21 d,各组的羟脯氨酸含量无统计学差异(P>0.05)。见表1。

表1 各组各时间点创面组织羟脯氨酸含量比较(µg·mg-1,湿重)Tab. 1 Comparison of hydroxyproline content in wound tissue at each time point (µg·mg-1, wet weight)
讨 论
既往的研究证实,由HBC和BS混合制备的止血海绵具有良好的止血效果[13]。但干燥的海绵剂型并非创面愈合的最佳微环境。大量研究表明,在创面修复中创造一个潮湿的环境可以防止细胞脱水,刺激胶原蛋白合成和血管生成,从而加速愈合[14-17]。有研究证实,HBC水凝胶可有效促进创面愈合[18]。因此,利用HBC水溶液可形成促创面愈合的温敏性水凝胶的特性,结合BS促进红细胞聚集与黏附的微观多孔结构,制备复合水凝胶敷料,是结合二者各自优点的理想方案。
大体观水平上,本研究HBC/BS组、HBC组创面愈合情况良好。其中HBC/BS组较其他各组渗血少,考虑与添加了BS有关。本研究中使用的BS为人工培养的微型硅藻——圆筛藻中分离纯化得到的硅藻外壳,具有纳米层级多孔结构。近年来国内相关研究结果表明,用钙离子结合生物矿化硅制备的Ca-BS,在大鼠尾部出血模型的实验中,凝血时间与美军采用的沸石止血粉较为接近,而Ca-BS治疗组的失血量仅为沸石止血粉组的1/3[19-21]。
不同时期的创面愈合率,与空白对照组相比,HBC/BS水凝胶对创面愈合全程均有明显的促进作用;与CMC-Na/PG水凝胶组相比,实验组水凝胶在建模后9 d内都具有较明显的优势,建模后12 d后的影响未见明显差异。可初步判断,HBC/BS水凝胶相比CMC-Na/PG水凝胶有更好的促进皮肤创伤愈合效果。单纯HBC水凝胶与添加了BS的HBC水凝胶加速创面愈合的作用无明显差异,就愈合速率而言,添加了BS的HBC水凝胶没有显著提升。
创面愈合依赖于表皮细胞等的再生,该过程通过来自创缘的表皮细胞向创伤表面的增殖和迁移来完成[22-23],还需要毛囊表皮细胞、成纤维细胞和血管内皮细胞的大量增殖,其中皮肤附属器的再生修复对皮肤外观、功能的恢复有重要意义[24-26]。本研究HE染色提示HBC/BS组和HBC组在建模后21 d复层鳞状上皮结构已完整覆盖创面,可明显区分表皮层、真皮层、毛囊等皮肤附属器,两者修复效果均优于CMC-Na/PG组,其中实验组皮肤附属器增殖情况优于HBC组。BrdU免疫荧光可观察创面基底层新生细胞和新生毛囊表皮细胞的分布情况[27]。本研究的BrdU免疫荧光提示HBC/BS组在建模后15 d表现为创面中心表面增殖活跃,已愈合部分有大量新生皮肤附属器,21 d表现为创面已完全愈合,皮肤各层荧光和皮肤附属器荧光分布与正常皮肤组织接近,皮肤附属器的重建修复效果要优于同一时期的HBC组。CMC-Na/PG组和创面基底层新生细胞荧光稀疏,创面中心及周围已愈合组织未见毛囊表皮细胞;建模后21 d创面基本愈合,基底层新生细胞荧光较建模后15 d有所改善,视野中有少量毛囊表皮细胞荧光信号。可推知,HBC/BS水凝胶对于皮肤创面生发层细胞和皮肤附属器的增殖促进作用比CMC-Na/PG水凝胶更好,而添加了BS的HBC水凝胶相比单纯HBC水凝胶有更好的促进附属器修复的效果,这一现象考虑与BS提供的纳米微观界面有利于高分化潜能细胞的附着、再生和分化有关。
胶原是机体非常重要的结构蛋白之一,在创面修复的过程中构成创面的基质[28]。在Masson染色中,HBC/BS水凝胶和HBC水凝胶保护下的皮肤创面,胶原纤维分布均匀,更加致密,排列整齐有序。凝胶组修复程度更高,更接近正常皮肤组织,修复程度优于同一时间节点的CMC-Na/PG组和空白对照,可初步考虑HBC/BS水凝胶和HBC水凝胶相比于CMC-Na/PG水凝胶有更好的皮肤创面修复促进作用。胶原是极少数含有羟脯氨酸的蛋白质之一,通过测定创面组织的羟脯氨酸含量可反映创面胶原的含量[29]。建模后15 d的羟脯氨酸含量检测结果与Masson染色镜下表现基本一致,进一步证明HBC/BS水凝胶和HBC水凝胶相比于CMC-Na/PG水凝胶有更好的皮肤创面修复促进作用。建模后21 d各组的羟脯氨酸含量较建模后15 d有所降低,考虑与恢复正常皮肤结构过程中新生的大量表皮层细胞和皮肤附属器替代胶原纤维有关[30]。近期有研究证明,HBC水凝胶在创面愈合的不同阶段,可提高创面组织的转化生长因子-β1和白细胞介素-6含量,从而加速创面的愈合;并能够调节创面组织的胶原酶Ⅰ含量,促进新生胶原纤维的有序排列,从而提高创面愈合质量和强度[31]。其机制可能与HBC调节细胞因子分泌量有关,具体机制尚待进一步研究明确。
综合以上信息,可得出以下结论:HBC/BS水凝胶和HBC水凝胶相较于已应用于临床的CMCNa/PG水凝胶,均有更好的促进创面愈合效果;添加了BS的复合水凝胶可有效促进皮肤附属器的修复再生,相较于HBC水凝胶有更为全面的促修复愈合能力。可认为HBC/BS复合水凝胶敷料在创面修复方面有较好的应用前景。HBC/BS水凝胶促进创面胶原生成、皮肤各层次重建修复和皮肤附属器修复再生的具体机制尚待进一步研究。
利益冲突声明:作者声明本文无任何利益冲突。

