新疆山羊肉的食用品质及差异蛋白质分析
于红,马晓琳,刘永峰,张瑞*
1(新疆特殊环境物种保护与调控生物学实验室,新疆特殊环境物种多样性应用与调控重点实验室,干旱区植物逆境生物学实验室,中亚区域有害生物联合控制国际研究中心,新疆 乌鲁木齐,830054)2(陕西师范大学 食品工程与营养科学学院,陕西 西安,710062)
当动物被屠宰取肉时,肌肉组织不会立即停止代谢过程。肌肉作为独立结构,缺失了氧气和外来营养的供给,开始发生相应的物理和化学变化,最终影响死后肉质的发展和成熟。宰后成熟过程中的能量代谢与肌原纤维蛋白的降解将会影响肉质的嫩化,进而直接影响肉质的嫩度、色泽等。肌原纤维蛋白也被称为结构蛋白,主要支撑着肌纤维的形状,其包括肌球蛋白、肌动蛋白和肌钙蛋白等[5]。这些肌原纤维蛋白都与肌肉收缩有关,直接影响宰后肉的嫩度、保水性和肉色等品质[6]。有研究表明,肌内能量和代谢水平差异会调控肌内蛋白酶系的活力释放,进而影响宰后的嫩度[7]。但目前关于宰后成熟过程中,有哪些差异蛋白在何时间段如何影响肉质的嫩度仍然存在争议。因此深入研究新疆山羊不同成熟时间中的蛋白质表达水平,探讨肉质成熟的机理,有助于新疆山羊的开发和利用,进而实现新疆农牧区的经济增值。
课题组前期对陕西横山羊的背部最长肌与胸腹肌肉进行宰后成熟机理的相关研究,在此研究基础上发现背部最长肌是山羊肉中较为优质的部位[8],且在肌肉转化为肉的过程中,肌肉在死后48 h内的代谢发生了重大变化,从根本上决定了生肉的大部分重要品质(颜色、pH、保水能力和嫩度)。本研究选取新疆特有品质绒山羊的背部最长肌为实验对象,研究新疆山羊肉成熟过程中的pH值变化以及相关差异蛋白的调节机制,探索宰后成熟过程中的差异蛋白对新疆山羊肉质嫩化的影响,明确肉质较好的最适成熟时间。
1 材料与方法
1.1 材料与试剂
实验材料:羊肉样品,新疆乌鲁木齐市华凌畜牧屠宰基地。选取6只约8月龄健康的新疆绒山羊(公)的背部最长肌为研究对象。
实验试剂:氯化钾,乌鲁木齐科华伟业生物科技有限公司;三氯乙酸、KH2PO4、蛋白酶抑制剂、胰蛋白酶、二硫苏糖醇(分析纯)、尿素(分析纯)、甲酸、乙腈、三乙基碳酸氢铵(分析纯)、三氟乙酸(分析纯)、蛋白质定量试剂盒(bicinchonininc acid,BCA)、串联质量标签(tandem mass tags,TMT)标记试剂盒、预染标记物、二甲苯(分析纯)、柠檬酸(分析纯)、醋酸铀(分析纯)等试剂,艾博抗(上海)贸易有限公司。
1.2 仪器与设备
Testo 205便携式pH计,德国德图公司;PROTE-ANⅡ型凝胶电泳系统,美国Bio-Rad公司;IMARK酶标仪,上海旦鼎国际贸易有限公司;Velocity 18R离心机,天美仪拓实验室设备(上海)有限公司;LC-20AB HPLC型Offline HPLC高校液相色谱,杭州瑞析科技有限公司;Q-Exactive质谱仪,百泰派克生物科技;JEM-1011透射电子显微镜,日本JEOL公司。
1.3 实验方法
1.3.1 样品处理
采集6只8月龄的新疆绒山羊(来自同一养殖场,饲养方式相同),均由乌鲁木齐华凌畜牧基地提供。按照DB 37/T 3878—2020(肉样屠宰操作规程)进行屠宰,并分割取背部最长肌10 g用锡纸包好放置于液氮中迅速冷却,用于0 h样品,其余肉样包装后放置4 ℃冰箱进行宰后成熟过程,用于pH和蛋白组检测。
下一步将在引入优良谷子品种基础上,进行谷子种业、谷子规模化种植、谷子及秸秆饲料化、小米深加工产品开发及产业化,全面发展小米“种植、养殖、加工”全产业链,立足保加利亚,形成可复制的盈利模式,并逐步辐射到欧洲其它国家,为我国农业“走出去”做出贡献。
1.3.2 pH值测定
按照国标GB/T 5009.237—2016进行调整,分别将羊肉样品剔除筋膜、剪成碎末,称取约4 g肌肉样置于烧杯中,加入40 mL 0.1 mol/L KCl溶液,用玻璃棒搅拌,常温下放置30 min,使用校正后的pH计进行测值,每组测量3次,结果取平均值。
1.3.3 蛋白质提取和肽段酶解
每个样品采用SDT[40 g/L十二烷基硫酸钠,100 mmol/L Tris/HCl pH 7.6,0.1 mol/L二硫苏糖醇]裂解法提取蛋白质,然后采用BCA法进行蛋白质定量。每个样品取适量蛋白质,采用辅助过滤样品制备(filter aided proteome preparation, FASP)方法进行胰蛋白酶酶解[9]。
1.3.4 TMT 标记
各样品分别取100 μg肽段,按照Thermo公司TMT标记试剂盒说明书进行标记,标记信息如表1所示。该项目设计组别4个,每个组别含有3个生物学重复样本,共计12个样本。

表1 肽段标记信息Table 1 Peptide labeling information
1.3.5 标记肽段的强阳离子交换器(strong cation exchanger,SCX)分级
将每组标记后的肽段混合,采用AKTA Purifier 100进行分级。色谱柱以缓冲液A液(10 mmol/L KH2PO4,25% 乙腈,pH 3.0)平衡,样品由进样器上样到色谱柱进行分离,流速为1 mL/min。洗脱过程监测214 nm的吸光度值,每隔1 min收集洗脱组分,分别冻干后采用C18 Cartridge脱盐。
1.3.6 LC-MS/MS数据采集
每份样品采用纳升流速的HPLC液相系统进行分离。缓冲液A液为0.1%(体积分数)甲酸水溶液,B液为0.1%(体积分数)甲酸乙腈水溶液。样品经色谱分离后用Q-Exactive质谱仪进行质谱分析。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描后采集20个碎片图谱,MS2的激活类型是高能碰撞碎裂,二级质谱在200m/z处的分辨率为17 500,破碎能量为30 eV。
1.3.7 蛋白质鉴定和定量分析
质谱分析原始数据采用软件Mascot 2.2和Proteome Discoverer 1.4进行查库鉴定及定量分析。相关参数和说明如表2所示。
1.4 统计分析
首先对目标蛋白质集合的定量信息进行归一化处理(归一化到-1~1区间)。使用亚细胞定位预测的方法,预测待检索蛋白亚细胞定位信息。采用Blast2GO对目标蛋白质集合进行基因本体特征(gene ontology,GO)注释,以及用京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)自动注释服务器软件进行KEGG通路注释。采用Fisher精确检验对目标蛋白进行GO注释或KEGG通路富集分析。

表2 蛋白质鉴定和定量分析的相关参数Table 2 Parameters related to proteins identification and quantitative analysis
2 结果与分析
2.1 成熟过程中pH值的变化
宰后羊肉成熟过程中的肌肉pH变化的幅度和速度除了影响肌肉色泽、嫩度和多汁性外[10],同时也影响宰后山羊肌糖元的酵解速度和强度。由于动物体内有完善的缓冲体系,pH值基本保持在中性。而屠宰后,动物体内有氧呼吸停止,供氧途径被阻断,体内肌肉代谢变成糖酵解为主的无氧代谢,糖酵解的产物乳酸和ATP降解所产生的无机磷酸的累积,使肌肉pH不断下降[11]。选取宰后不同成熟时间的新疆山羊背最长肌进行肉品质的测定,如图1所示,宰后0~24 h内的pH显著下降(P<0.05),这可能是因山羊成长过程中的运动导致肌肉中的乳酸沉积和神经兴奋导致宰后初期的pH较高,此结果与张利霞等[12]和SEN等[13]的研究结果一致。而宰后48 h内新疆山羊的pH偏低则可能与宰后糖酵解有关[14],也可能是成熟过程中参与H+转换的相关差异蛋白的活性决定。
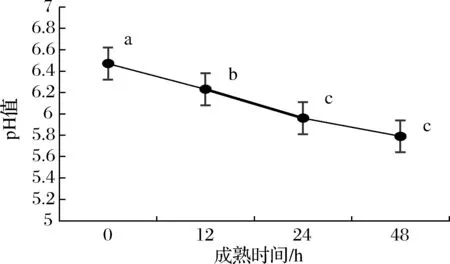
图1 不同宰后成熟时间对羊肉的pH变化Fig.1 Changes of mutton pH at post-mortem in different maturation time注:不同小写字母表示差异显著(P<0.05)
2.2 质量控制
本实验采用具有高质量精度、高分辨率的Q Exactive质谱仪,在数据采集过程中可以保持良好的质量偏差,并最终获得高质量的MS1和MS2图谱。如图2所示,所有鉴定肽段的质量偏差主要分布在10 ppm以内,说明鉴定结果准确可靠。图3是结合MASCOT的分析工具对MS图谱数据进行分析所得到的肽段离子得分分布图,MS2的MASCOT得分较为理想,约50.27%以上的修饰肽段得分在20分以上,肽段得分中位数为20分。每一套TMT数据在定性分析工作中均使用FDR≤0.01作为筛选标准,结合所得的优秀肽段得分分布情况,进一步说明MS实验数据质量较高。图4表明,等量标记的2组样品中大部分蛋白质的丰度比值接近1。肽段进行质量检测后结果良好,能够增加蛋白质鉴定与分析结果的可靠性,为探索肌肉向食用肉的转化过程中参与的重要差异蛋白的鉴定提供科学依据。
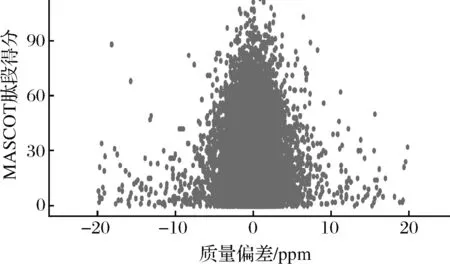
图2 肽段离子质量偏差分布Fig.2 The mass deviation distribution of peptide ions注:横坐标为肽段离子理论质荷比和质谱实验测得质荷比的质量偏差,单位ppm即百万分之一,是一个相对单位
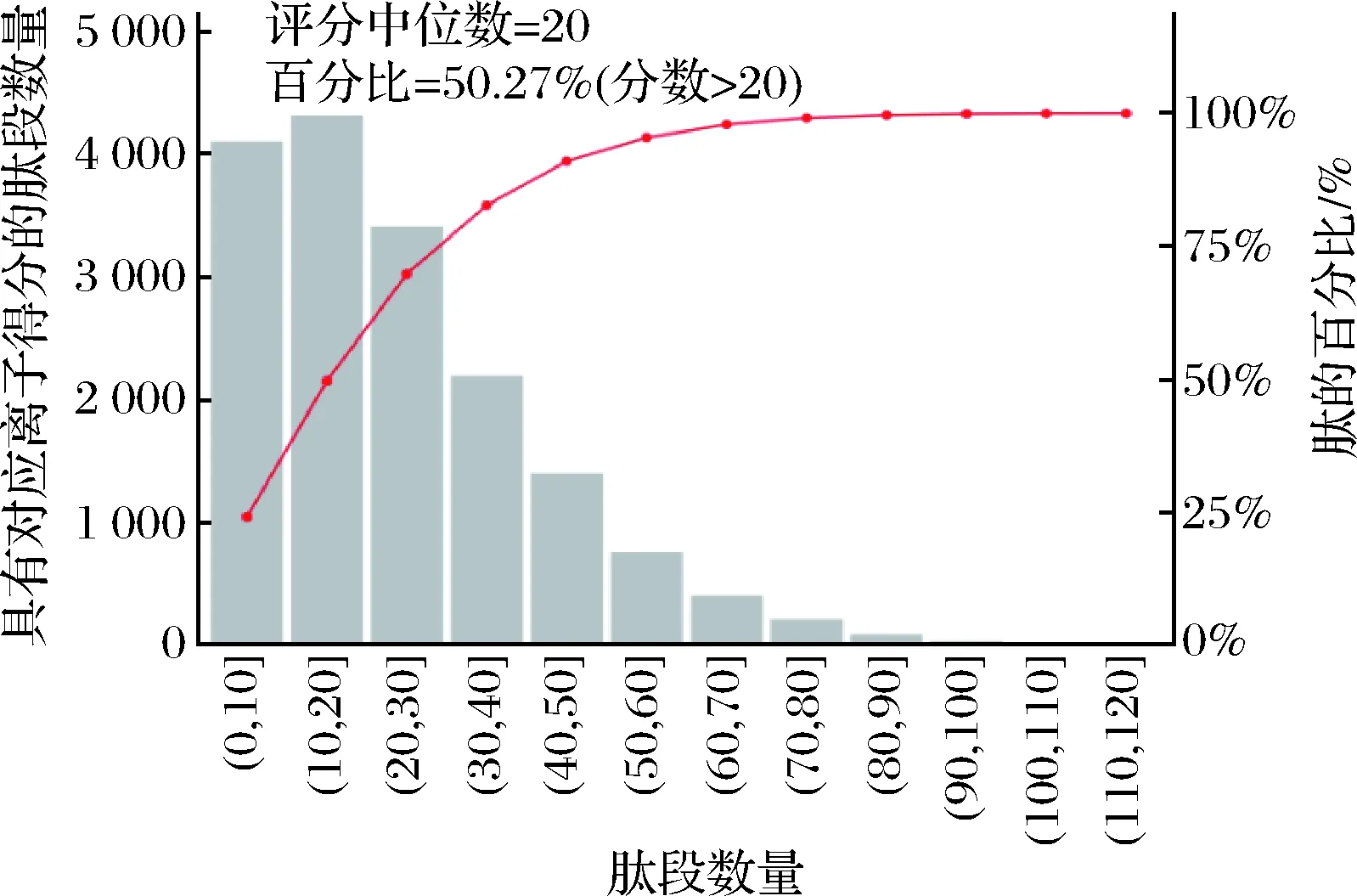
图3 肽段离子得分分布Fig.3 Peptide ion score distribution注:横坐标为肽段得分;主纵坐标表示鉴定到的具有对应离子得分的肽段数量;次纵坐标表示不高于对应离子得分的肽段累积百分比

a-12 h/0 h比较组的肽段丰度比分布;b-24 h/0 h比较组的肽段丰度比分布;c-48 h/0 h比较组的肽段丰度比分布图4 肽段丰度比分布Fig.4 Abundance ratio distribution of peptide segment注:差异倍数(以2为底的对数变换)
2.3 差异表达蛋白的定量与筛选
采用TMT技术研究了宰后48 h内新疆山羊的背部最长肌样品的差异表达蛋白结果情况,质谱实验中共得到级质谱谱图总数518 230个,通过Mascot软件进行分析后,匹配到的谱图总数量为47 666张,其中唯一肽段总数14 466个,蛋白质总数2 526个,鉴定到的显著差异表达蛋白155个。具体3个比较组的差异蛋白表达量变化如图5所示,在宰后不同阶段,差异蛋白的表达有所不同。3个比较组中,上调蛋白的数量均高于下调蛋白的数量,说明差异蛋白在山羊肉嫩化过程中更为活跃。且在屠宰12 h后,这些蛋白的表达差异更为显著,进一步说明随宰后成熟时间的延长,相关差异表达蛋白的数量逐渐增加,对肉质的调控程度也逐渐增强。细胞器是细胞质中具有一定形态和功能的小器官,也是蛋白质发挥不同功能的重要场所。不同的亚细胞器通常执行不同的细胞功能。因此,分析蛋白质的亚细胞定位有助于进一步探索蛋白质在细胞中的功能,结果如图6所示。宰后成熟过程0 h/12 h、0 h/24 h、0 h/48 h 3个比较组的差异表达蛋白主要分布在细胞质和细胞核中,结果表明,成熟过程中作用的差异蛋白大多数来自于细胞核与细胞质,可能为这些参与调控肉品质的差异蛋白的合成及相关功能表达,提供了场所保障。
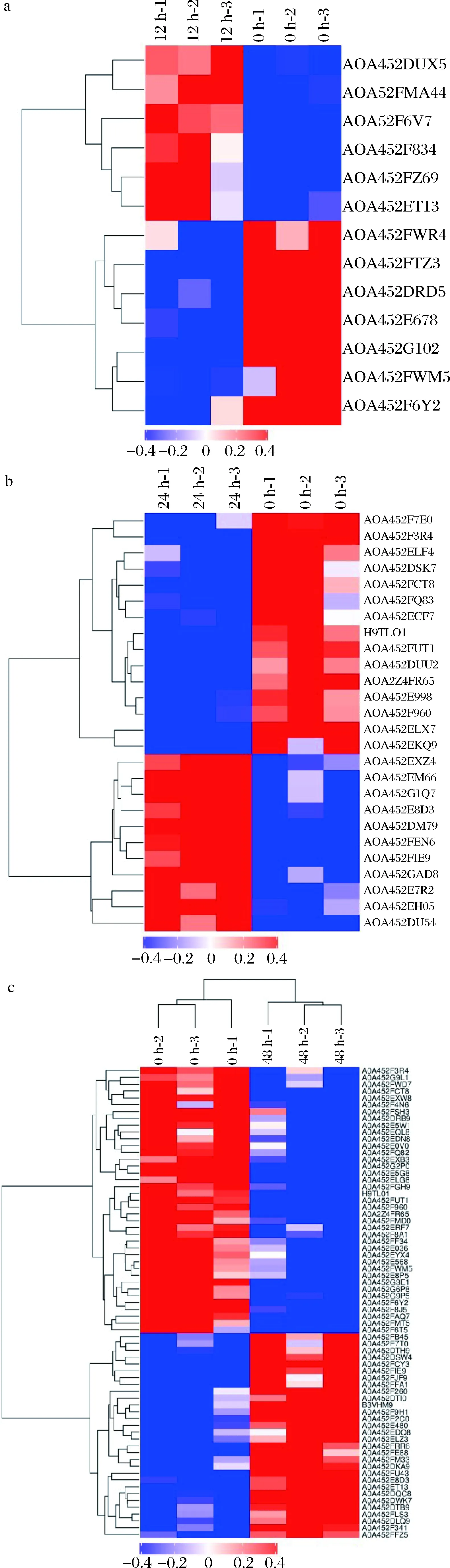
a-0 h/12 h组差异表达蛋白质聚类分析结果图;b-0 h/24 h组差异表达蛋白质聚类分析结果图;c-0 h/48 h组差异表达蛋白质聚类分析结果图图5 三组差异表达蛋白质聚类分析结果Fig.5 Clustering analysis of three groups of differentially expressed proteins注:横坐标为样品信息,纵坐标为显著性差异表达的蛋白质,红色代表显著性上调的蛋白质,蓝色代表显著性下调的蛋白质,灰色部分代表无蛋白质定量信息

图6 相关差异表达蛋白质的亚细胞定位Fig.6 Subcellular localization of differentially expressed proteins
2.4 差异表达蛋白的结构域富集、GO功能注释与KEGG分析
对差异表达蛋白服从Fisher′s exact test进行验证,在GO功能项显著富集分析中对差异表达蛋白的认识、功能类别以及它们之间的相关性,并对这些差异蛋白质的富集GO条目层级关系进行展示,为深入了解影响山羊肉品质的变量进行了重要补充。本研究的GO功能注释结果主要分为三类:生物过程(BP)、细胞成分(CC)和分子功能(MF)[15]。并发现随宰后成熟时间的延长,新疆山羊肌肉中的一些差异蛋白主要参与调节生物过程、调节细胞过程和代谢调控,并且较为集中的参与催化活性和结合功能。此外,这些差异蛋白的主要分布在细胞部分、细胞和细胞器部分。对于细胞成分组,WEI等[16]观察到山羊组的差异蛋白主要分布在细胞器和细胞外泌体中,与本试验结果存在少许差别,这可能是因为不同品种的山羊,差异蛋白的表达及其分布存在地区差异。
为了进一步分析不同比较组中的关键代谢通路,执行KEGG通路富集提取与差异表达蛋白相关的生物通路[17]。宰后成熟48 h内某些差异表达蛋白参与糖酵解的代谢通路如图7所示,结果显示大多数差异表达在山羊宰后成熟中下调表达,其中只有2个差异蛋白(PGM1,LDHB)上调表达。代谢过程表明,葡萄糖磷酸变位酶-1(phosphoglucomutase 1,PGM1)参与α-D-一磷酸葡萄糖向α-D-六磷酸葡萄糖的转化过程。因此,PGM1在糖代谢中起着重要的作用,能通过影响糖原降解、ATP的产生、乳酸的积累调控宰后肉品质的pH值。此外,有研究表明,PGM1是肌间脂肪(intramuscular fat,IMF)合成的还原性辅因子,其基因表达量高的样品中IMF含量高,汁液流失率低[18]。由此可知,PGM1可能是改变宰后肉品质嫩化的重要因素之一。

图7 宰后成熟过程中的糖酵解代谢Fig.7 Glycolytic metabolism during postmortem maturation注:图中红底方框表示发生差异的蛋白质为上调,绿底方框表示发生差异的蛋白质为下调,黄底方框表示有多个蛋白;小圆圈表示小分子代谢物,大圆框代表其他通路
LDHB参与三羧酸循环后期的丙氨酸与L-乳酸相互转化过程,通过调控宰后成熟过程中的pH值变化改善肉品质。也有研究表明,LDHB能够促进肉色的稳定性[19-20]。而本研究结果显示宰后48 h时,该酶上调表达,可以解释LDHB在稳定正常肉色中的作用。动物宰后的糖酵解速率是影响最终肉品质的重要因素之一。JIA等[21]利用2-DE蛋白组学研究了牛背最长肌从体内到宰后早期(宰后1 h)的蛋白质变化。鉴定到24个差异表达蛋白,其中5个蛋白(烯醇酶、醛脱氢酶、磷酸甘油酸激酶、ATP特异性琥珀酰辅酶a合成酶和异柠檬酸脱氢酶)为酵解和三羧酸循环的关键,这些结果反映了宰后肌肉中无氧代谢为机体提供ATP,同时应激蛋白是肌纤维结构变化潜在的生物指示剂。JIA等[22]研究了宰后1、2、3、6、10、24 h的蛋白质组学变化,结果发现,与之前的文献相比,代谢蛋白(酵解酶和与ATP产生途径相关的酶)、应激和防御蛋白、蛋白水解酶在丰度上发生了变化。
2.5 能量代谢相关差异蛋白对肉品质的影响
在本研究中,在0 h/12 h组中检测到的线粒体核糖体蛋白L46(MRPL46)显著上调。在0 h/24 h组中,线粒体核糖体蛋白S15(MRPS15)、39S核糖体蛋白L41(MRPL41)、线粒体核糖体蛋白L22(MRPL22)显著上调,这些差异蛋白主要参与宰后能量物质的运输作用,说明宰后成熟早期的能量代谢,促进宰后肉质嫩化过程。也有相关研究表明,核糖体蛋白是调节肌肉冻融的关键蛋白,且冻融过程抑制了蛋白质的消化及脂肪分解[23]。在0 h/48 h组中检测到的差异蛋白中无机焦磷酸酶2(PPA2)显著上调。依据GO注释和KEGG结果表明,这些差异表达蛋白质主要与线粒体有关,并参与氧化代谢过程,对山羊肉的嫩化过程起着重要作用。线粒体是细胞有氧活动的重要位点,并参与三羧酸循环和氧化磷酸化反应,这些与线粒体相关差异蛋白在成熟过程中上调表达,生成的ATP与H+有助于调节肉质的pH和成熟。有研究也表明,由细胞有氧呼吸产生的NADH(nicotinamide adenine dinucleotide)有助于肉的颜色的稳定[24-25]。
本研究中,在分子功能方面主要富集了参与有氧代谢的跨膜运输蛋白。例如,在0 h/12 h组中检测到的差异蛋白中,跨膜蛋白14C(TMEM14C)显著下调。在0 h/24 h组中检测到的差异表达蛋白中,跨膜蛋白205(TMEM205)显著上调。在0 h/48 h组中,氧甾醇结合蛋白相关蛋白10(OSBPL10)、雷汀醇结合蛋白4(RBP4)显著上调,糖质膜相关蛋白(SLMAP)显著下调。这一结果表明,与跨膜运输相关差异蛋白在成熟后期上调表达,这些差异蛋白可能与蛋白的初始浓度和宰后成熟过程中的能量代谢有关,说明有氧代谢在山羊宰后48 h内的成熟中发挥了作用。涉及肌肉结构的差异蛋白的某些分子功能在死后48 h与死后0 h不同,这可能是宰后成熟过程的嫩度不同导致的。因为结构蛋白质尤其细胞骨架蛋白的降解是宰后成熟过程中肌肉嫩化的主要原因[26]。对比其他2组,0 h/48 h组中该类差异蛋白下调表达,说明肌肉结构蛋白的变化可能导致48 h山羊肌肉嫩度降低。肌肉结构和能量代谢与影响肉类质量的蛋白质有关,由LAMETSCH等[27]和KARLSSON等[28]证实。
3 结论
本研究以新疆山羊的背部最长肌为实验对象,较为深入地探索了影响肉质成熟的差异表达蛋白的作用机理。采用TMT标记蛋白质组学技术比较死后不同成熟时期的蛋白质组变化,这一结果使本研究更好地了解宰后成熟过程中的蛋白质组差异。与糖酵解相关的差异蛋白在宰后48 h时仍上调表达,这些蛋白可调控宰后肌肉的pH值变化,且对pH值的影响结果与前期pH值的检测结果相一致。这说明山羊宰后的糖代谢过程维持到48 h之后,可以促进肉色的稳定和肉质的嫩化。山羊宰后肌肉转化为肉的过程中有不同的代谢模式,而线粒体作为能量代谢的关键部位,可能间接地调节肉质嫩度的变化。本研究结果显示,24 h内的线粒体相关差异蛋白均上调表达,表明新疆山羊肉的背部最长肌成熟期间肉质逐渐嫩化,且24 h时嫩化程度最高,进一步表明宰后成熟起到嫩度优化的作用。通过生物信息学分析出了一些差异蛋白质和糖酵解途径为肉品质调控机制的研究奠定了基础。

