人参皂苷Rd对人脐静脉内皮细胞凋亡保护的作用研究
赵汴霞,宛 蕾
(1.河南医学高等专科学校药理学教研室,郑州 451191;2.贵州医科大学药理学教研室,贵阳 550025)
心脑血管疾病(cardiovascular disease,CVD)是当今世界上威胁人类最严重的疾病之一。《中国心血管病报告2018》[1]推算CVD患病人数达2.9亿,脑卒中占据1 300万,2016年城乡居民死亡构成比中,CVD病死率仍居首位,高于肿瘤及其他疾病,并且在今后的10 a里CVD患病人数由于社会老龄化、城市化进程的加快、居民不健康生活方式等因素的影响仍将快速增长。
在人类CVD发生和发展过程中,内皮细胞发挥着重要作用,氧化应激是细胞损伤和血管老化的重要影响因子[2],内皮细胞损害是CVD发病的重要危险因素[3]。而细胞凋亡是涉及一系列基因的激活、表达、调控等因素作用的一种主动死亡过程,其目的是维持内环境稳定[4]。
血管内皮细胞(vascular endothelial cells,VECs)生长在血管系统的最内层,是血液与血管壁组织之间的天然屏障,发挥着保持人体生理平衡和维持血管正常功能的作用,其功能改变与CVD的发生发展有密切关系[5-6],是缺血缺氧再灌注损伤的前沿细胞[7]。当其受缺氧等因素损伤后,VECs释放多种促凝血因子及血管收缩因子,发挥促凝作用,使血小板黏附、聚集等,引起血栓形成[8]。因此,一旦VECs出现损伤,则可能导致CVD的发生[9]。所以保护血管内皮功能,是防治CVD的关键环节。
人参皂苷Rd为从名贵中药三七中分离而得的单体化合物,纯度在90% 以上,对CVD具有较好的干预作用[10-12],现探讨人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)对缺氧凋亡机制的作用,为人参皂苷Rd治疗CVD提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 HUVEC购自ATCC 公司(美国)。
1.1.2 药品与主要试剂 人参皂苷Rd(贵州信邦制药股份有限公司,纯度90% 以上);尼莫地平注射液(德国拜耳医药保健股份公司,规格50 mL:10 mg);Fluo-3/AM(碧云天生物技术研究所);兔抗人细胞色素C抗体(武汉博士得生物技术有限公司);SP系列试剂盒(美国ZYMED公司);DAB染色试剂盒(北京博奥森生物技术有限公司TrizolInvitrogen公司);荧光混合物(美国ABI公司);RNA逆转录仪(德国Eppendorf);实时荧光定量PCR仪(美国BIO-RAD)。
1.1.3 主要仪器设备 Biomias2001图像分析系统(四川大学图象图形研究所);TU1810紫外分光光度计(北京谱析仪器有限责任公司);流式细胞仪FACS-Cabiber(美国BD)。
1.2 方法
1.2.1 HUVEC缺氧损伤模型建立 按照文献[13-14]建立HUVECs缺氧损伤模型,调HUVECs密度为5×104mL-1接种,分为空白对照组和连二亚硫酸钠(Na2S2O4)损伤组。空白对照组加入100 μL无血清DMEM培养基和100 μL PBS培养;Na2S2O4损伤组加入100 μL无血清DMEM培养基,100 μL不同浓度(1、2、4、8、16 mmol·L-1)的Na2S2O4,每个浓度设8个复孔,至培养箱中37 ℃密闭孵育1、2、3、4、5 h,实验重复3次。MTT法[15]检测细胞存活率,最终以终浓度为8 mmol·L-1Na2S2O4溶液,至培养箱中37 ℃孵育4 h,存活率为60%左右确定为损伤模型的浓度和时间。
1.2.2 实验分组与药物干预 将HUVECs分为:空白对照组(n=8);溶媒对照组(n=8);缺氧损伤组(n=8);尼莫地平对照组(50 μmol·L-1,n=8);人参皂苷Rd各浓度组(25、125、625 μmol·L-1,n=8)。质量分数10%血清培养细胞24 h,之后换用无血清培养基继续培养24 h。溶媒对照组加质量分数0.4%的丙二醇DMEM,Rd各浓度组加入不同浓度的人参皂苷Rd、50 μmol·L-1尼莫地平,每组细胞培养24 h,除空白对照组和溶媒对照组外,其余组加入终浓度为8 mmol·L-1Na2S2O4溶液,至培养箱中37 ℃孵育4 h后,检测指标,AO/EB双染法测定细胞凋亡,流式细胞术测定细胞内游离钙([Ca2+]i)浓度,免疫细胞化学法测定细胞色素C含量,实验重复3次。
1.2.3 AO/EB双染法测定细胞凋亡 于6孔培养板中接种HUVECs,配成浓度为5×105~6×106mL-1细胞悬液,将AO和EB等体积混合,吸取25 μL的细胞悬液与1 μL的混合染料轻轻混匀,吸取上述混合液置于一洁净的载玻片,并用盖玻片盖上细胞,立即于荧光显微镜510 nm激发波长观察拍照,并记录200个细胞中凋亡的细胞数,计算细胞凋亡率。通过在荧光显微镜下观察细胞显色和形态的不同,可以将正常细胞、坏死细胞、凋亡早期细胞和凋亡晚期细胞区分开来。
1.2.4 流式细胞术测定细胞内[Ca2+]i浓度[16]细胞悬液接种于25 cm2培养瓶中,待细胞缺氧损伤4 h后,用胰酶将细胞消化下来,离心收集细胞,用40 μL PBS制备内皮细胞悬液,加入荧光指示剂Fluo-3/AM,使其终浓度为5 μmol·L-1,于37 ℃培养箱中避光孵育45 min,2 000 r·min-1离心15 min后,弃上清液,用PBS洗涤2次以洗除细胞外荧光指示剂,再以80 μL PBS重悬细胞孵育20 min,然后用流式细胞仪检测,激发波峰为506 nm,发射波长为526 nm,细胞荧光强度值的平均值为各组测定值。
1.2.5 免疫细胞化学法测定细胞色素C含量 按照S-P免疫组化法染色,显微镜下观察分析。在40×10倍光学显微镜下,通过SONY摄像头将免疫组化图像采集并输入Biomias 99图像分析系统进行图像分析。平均灰度值(mean gradation,MG):每张切片随机选取5个区域(视场),每个视场选取5个阳性表达区域测量MG,代表其阳性表达率,切片染色越浅MG越大,阳性表达率越低,取其均数和标准差进行分析。

2 结果
2.1 人参皂苷Rd对Na2S2O4损伤后HUVECs凋亡的影响(AO/EB荧光染色) AO/EB染色后用荧光显微镜观察,空白对照组HUVECs成圆形,胞质被AO均匀染成绿色,有几个早期凋亡细胞,见图1-1;缺氧损伤组出现早期凋亡细胞、晚期凋亡细胞及坏死细胞,早期凋亡细胞,细胞膜完整,但细胞核呈现较强的黄绿色荧光,浓集成新月形或团块状;晚期凋亡细胞,细胞核浓集染成橘红色;死亡细胞,细胞均一染成橘红色,见图1-3;缺氧损伤组与空白对照组比较,差异有统计学意义(P<0.01)。随着药物Rd干预组浓度的增加,晚期凋亡细胞及坏死细胞明显减少,见图1-4、1-5、1-6;与缺氧损伤组比较,差异有统计学意义(P<0.01)。见表1,见图2。
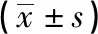
表1 人参皂苷Rd对Na2S2O4损伤后HUVECs凋亡的影响

图1 人参皂苷Rd对Na2S2O4损伤后HUVECs凋亡的影响—AO/EB免疫荧光染色结果(10×10倍)
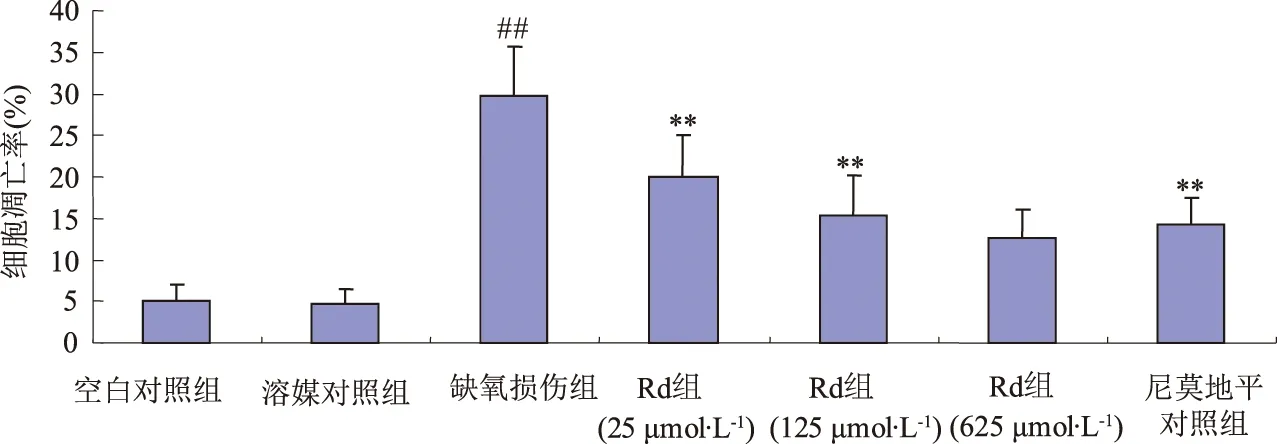
注:##:与空白对照组比较,P<0.01;**:与缺氧损伤组比较,P<0.01。
2.2 人参皂苷Rd对HUVECs [Ca2+]i浓度的影响 用Fluo-3/AM 流式细胞分析检测HUVECs内[Ca2+]i水平,结果发现Na2S2O4作用于HUVECs 4 h后可引起细胞内钙荧光强度明显加强,细胞内[Ca2+]i浓度升高,缺氧损伤组与空白对照组比较差异有统计学意义(P<0.01)。给予Rd可使钙荧光强度有不同程度下降,与缺氧损伤组比较,差异有统计学意义(P<0.01)。见表2,图3。
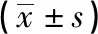
表2 人参皂苷Rd对Na2S2O4损伤后HUVECs内[Ca2+]i的影响

注:##:与空白对照组比较;P<0.01;**:与缺氧损伤组比较,P<0.01。
2.3 人参皂苷Rd对HUVECs细胞色素C表达的影响 正常状态下细胞色素C定位于细胞的线粒体中,显微镜下可见细胞胞质内棕黄色染色较浅或无着色,提示细胞色素C蛋白表达阳性率较低;Na2S2O4损伤使HUVECs线粒体内细胞色素C释放到细胞质中,可见细胞质中弥漫性棕色着染,呈现较强的细胞色素C抗原抗体反应。经图像分析测定,缺氧损伤组的MG较空白对照组低,差异有统计学意义(P<0.01),Rd各剂量组的MG较缺氧损伤组不同程度增高,差异有统计学意义(P<0.05或0.01)。见表3,见图4-5。

图4 人参皂苷Rd对Na2S2O4损伤后HUVECs 细胞色素C表达的影响(DAB染色×400)

注:##:与空白对照组比较;P<0.01;*:与缺氧损伤组比较,P<0.05;**:与缺氧损伤组比较,P<0.01。
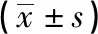
表3 人参皂苷Rd对Na2S2O4损伤后HUVECs 细胞色素C表达的影响
3 讨论
组织、细胞缺氧是临床多种疾病发生发展所共有的病理生理基础。缺氧通过加速内皮细胞凋亡,破坏内皮结构,使内皮功能出现异常,产生一系列CVD,如高血压、冠心病、动脉粥样硬化、心力衰竭等。
细胞内Ca2+是重要的第二信使,机体细胞的许多生理活动均依赖于Ca2+的参与。线粒体参与Ca2+信号形成,为细胞内局部Ca2+缓冲器,能够快速摄取大量钙,防止细胞质内Ca2+水平过度升高,抑制钙超载[18]。线粒体氧化损伤导致线粒体通透性改变、线粒体肿胀和促凋亡蛋白的释放,离子稳态失衡及收缩功能障碍等一系列功能障碍、结构功能变化,最终引起细胞凋亡和坏死[19]。胞浆[Ca2+]i升高或分布改变可通过信号转导、激活蛋白酶、激活核酸内切酶、激活转谷氨酰胺酶等方式诱导细胞凋亡。钙超载加重细胞膜破裂、氧化应激诱发的内质网损伤和线粒体膜电位异常。本研究结果显示,Na2S2O4作用于HUVECs 4 h后可引起细胞内[Ca2+]i荧光强度明显加强,细胞内钙浓度升高,缺氧损伤组与空白对照组比较,差异有统计学意义。实验预先加入人参皂苷Rd,可使钙荧光强度有不同程度的下降,能显著抑制缺氧诱导的内皮细胞[Ca2+]i浓度升高,防止细胞内钙超载,与缺氧损伤组比较,差异有统计学意义。
死亡受体途径及线粒体途径是两种主要的凋亡信号转导途径[21],线粒体由于各种因素受损后,参与了坏死及凋亡途径[22],细胞色素C是线粒体呼吸链中细胞色素氧化酶的重要成分,是线粒体受损伤时自细胞核内释放到细胞质内的一种蛋白质,细胞色素C由胞核释放到胞浆,与半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)、凋亡激活因子(Apaf-1)结合形成凋亡小体,进一步激活半胱氨酸天冬氨酸蛋白酶-3(Caspase-3),Caspase-3是Caspase级联“瀑布”下游的最关键调节蛋白酶,在各种因素启动的凋亡程序中起最后的枢纽作用,最终导致DNA降解成寡聚核苷酸片段和染色体进步的浓缩,细胞发生凋亡。
本研究结果发现,Na2S2O4作用于HUVECs 4 h后可引起细胞内钙荧光强度明显加强,细胞色素C含量增高,缺氧损伤组与空白对照组比较,差异有统计学意义,应用人参皂苷Rd干预后发现细胞色素C蛋白表达量显著降低,经图像分析测定,缺氧损伤组的MG较空白对照组低,与空白对照组比较,差异有统计学意义,Rd各剂量组的MG较缺氧损伤组不同程度增高,与缺氧损伤组比较,差异有统计学意义;AO/EB染色法发现随着干预组药物Rd浓度的增加,晚期凋亡细胞及坏死细胞明显减少,与缺氧损伤组比较,细胞凋亡减少。以上结果提示,人参皂苷Rd保护VECs损伤与其缓解细胞钙超载、抑制细胞色素C从线粒体释放到细胞质中有关。

