结核分枝杆菌Rv3873抗原的同源表达及其在结核病血清学诊断中的应用
顾雯菲,吴娟,胡志东,范小勇
1.温州医科大学检验医学院 生命科学学院,浙江 温州 325035;2.上海市(复旦大学附属)公共卫生临床中心,上海 201508
结核病(tuberculosis,TB)是一种由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的重大传染病,严重威胁全球公共卫生安全。根据2021年最新的WHO结核报告统计,全球新发TB患者约990万,发病率127/10万,死亡率达17/10万。中国作为全球最大的发展中国家,人口数量居世界第一,更是全球结核高负担国家之一[1]。早期快速诊断对控制和预防TB传播至关重要。
目前TB诊断的实验室检查方法主要包括结核菌素皮肤试验(tuberculin skin test,TST)、γ-干扰素释放试验(interferon gamma release assay,IGRAs)、涂片镜检、细菌培养和GeneX-pert MTB/RIF[2-6]等。尽管这些诊断方法应用广泛,但仍存在一定的局限性[7]。其中,TST通过皮内注射结核菌素精制蛋白衍生物(purified protein derivative,PPD),根据皮肤出现的硬结大小来判断是否感染TB。但PPD所含成分复杂,不仅存在于Mtb等高致病性分枝杆菌中,而且BCG及环境中非结核分枝杆菌(nontuberculosis mycobacteria,NTM)也表达同源蛋白,因此,其检测结果阳性可能是感染Mtb,也可能是接种BCG或感染NTM导致,限制了其临床诊断价值。IGRAs是一种基于T细胞免疫的体外检测方法,能快速报告Mtb感染结果,但不能用于鉴别活动性结核病和潜伏性结核感染(latent tuberculosis infection,LTBI)。涂片法灵敏度较低,检出率在20%~80%不等[8],且特异性也不高,无法准确区分Mtb与非致病分枝杆菌。细菌培养阳性是诊断TB的金标准,但细菌培养耗时长,需2~8周,不利于TB的早期诊断与治疗[9]。GeneX-pert MTB/RIF是利用PCR方法进行核酸扩增,可同时检测Mtb和利福平耐药突变,在诊断TB方面具有较高的敏感性和特异性,但操作需要先进的仪器设备,检测成本高,阻碍其在低收入国家的广泛应用[10-11]。因此,新型诊断试剂的研发仍是TB防控的重要研究方向。
血清学诊断作为一种免疫诊断方法,通过检测血清中Mtb抗原特异性抗体来诊断TB。其检测方法操作简单,且耗时短。随着对Mtb研究的深入,用于血清学诊断特异性抗原的研究取得了一定进展[12]。有研究显示,38 kD抗原用于TB血清学诊断的敏感性为50%,特异性为100%;而与Rv1860抗原联合检测可将敏感性提高至66.6%,特异性则下降至92.2%[13]。但Mtb抗原种类繁多,且成分复杂,血清学检测易出现假阴性和假阳性,一定程度上限制了其临床应用。因此,寻找提高诊断效能的新型抗原或抗原组合仍TB血清学诊断研究的关键。
与Mtb相比,BCG有16个基因差异区域(regions of difference,RD)从其基因组中缺失,即RD1~RD16。其中RD1区仅存在于致病性分枝杆菌中,而在BCG及其他环境NTM中均缺失。研究发现,RD1区的Rv3873能诱导机体产生细胞免疫应答,分泌Th1型细胞因子,有助于快速诊断TB和LTBI[14],是Mtb免疫优势抗原之一。但基于该抗原的血清学诊断研究鲜有报道[15],也尚无研究比较过耻垢分枝杆菌(M.smegmatis,Msm)与E.coli中表达纯化的重组蛋白在TB诊断中的差异。有研究发现,Msm中表达纯化的重组分枝杆菌蛋白的免疫原性优于从E.coli表达系统中纯化的蛋白[16],能诱导更强的免疫反应。
本研究利用分枝杆菌同源表达系统[16]在Msm中表达并纯化具有自然构象以及免疫原性良好的Mtb特异性抗原Rv3873(mRv3873),与E.coli表达的Rv3873(rRv3873)及其主要的免疫优势抗原Ag85A进行比较,以评价分枝杆菌同源表达的mRv3873在TB血清学诊断中的作用。
1 材料与方法
1.1 基因组、菌株及质粒Mtb标准株H37Rv基因组、E.coli克隆菌株Top10、E.coli表达菌株BL21(DE3)、Msm mc2155、原核表达载体pMF406、Ag85A和rRv3873重组表达质粒(利用Ni2+亲和层析柱纯化获得重组蛋白A85A和rRv3873)均为上海市公共卫生临床中心结核病感染与免疫课题组保存。
1.2 血清标本2021年3—10月上海市公共卫生临床中心收治,通过结核病史、临床表现、胸部CT或细菌学检查及病理组织学检查等临床诊断确诊为活动性TB的病例27例及健康体检者31例的血清。所有入选对象均对本实验知情并签署同意书。
1.3 主要试剂 限制性内切酶BamHⅠ、EcoRⅠ、T4 DNA连接酶、Pfu DNA Polymerase和低相对分子质量蛋白标准均购自美国Thermo公司;亲和层析所用介质Ni Sepharose为美国GE Hea1thcare公司产品;HRP标记的羊抗鼠IgG和鼠抗His-tag单克隆抗体为美国CST公司产品;HRP标记的羊抗人IgG为美国BETHYL公司产品。
1.4 rv3873基因的扩增 根据GenBank公布的Mtb H37Rv序列,利用Primer Premier 5.0软件设计引物,rv3873上游引物F:5′-CGCGGATCCATGCTGTGGCACGCAATG-3′(下划线部分为BamHⅠ酶切位点),rv3873下游引物R:5′-CCGGAATTCTCACCAGTCGTCCTCTTCGTCCCAG-3(′下划线部分为EcoRⅠ酶切位点)。引物由苏州金唯智生物科技有限公司合成。以H37Rv基因组DNA为模板,PCR扩增rv3873基因,扩增片段大小为1 100 bp,扩增条件为:94℃预变性5 min;94℃30 s,58℃30 s,72℃40 s,共30个循环;72℃再延伸5 min。PCR产物经1%琼脂糖凝胶电泳分析。
1.5 重组表达质粒的构建 用BamHⅠ和EcoRⅠ双酶切PCR产物,回收的目的基因片段,与同样双酶切的pMF406载体连接,连接产物转化E.coli Top10感受态细胞,筛选阳性克隆,提取质粒,经BamHⅠ和EcoRⅠ双酶切鉴定正确后,送苏州金唯智生物科技有限公司进行序列测定。
1.6 目的基因的诱导表达 将重组表达质粒转化Msm mc2155感受态细胞,挑取含阳性菌落接种于5 mL含50 μg/mL卡那霉素的LB液体培养基中,置37℃摇床,220 r/min振摇至菌液A600值达0.6左右时,加入10%乙酰胺溶液至终浓度为0.02%,诱导7 h,离心弃上清,加入500 μL PBS重悬,菌液置于冰上超声破碎至澄清,12 000×g离心30 min,分别取上清和沉淀,经12% SDS-PAGE分析目的蛋白的表达形式。
1.7 目的蛋白的纯化 大量培养并诱导表达后收集菌体沉淀,加15 mL平衡缓冲液(300 mmol/L NaCl,50 mmol/L NaH2PO4,10 mmol/L咪唑,10 mmol/L Tris,pH 8.0)重悬,将菌液置于冰上超声破碎。超声后的蛋白溶液于4℃,4 000×g离心30 min后收集上清,用含不同浓度咪唑(40、80、120、160、200 mmol/L)的平衡缓冲液依次洗脱目的蛋白。12% SDS-PAGE分析蛋白纯度,透析除去咪唑和其他盐类物质,并经PEG8000浓缩后,BCA法检测蛋白浓度,最后加入终浓度10%的无菌甘油,分装冻存于-80℃冰箱。
1.8 纯化蛋白的Western blot分析 将纯化的Rv3873重组蛋白经10% SDS-PAGE分离后,半干转至PVDF膜上,以5%脱脂奶粉于室温下封闭2 h;加入鼠抗His-tag单克隆抗体(1∶5 000稀释),4℃孵育1 h;TBST缓冲液(含1×TBS,0.05% Tween-20)洗涤,加入HRP标记的羊抗小鼠IgG(1∶5 000稀释),室温下孵育1 h;充分洗涤后,ECL显影。
1.9 Rv3873抗原的血清学评价 采用ELISA法。分别以0.25 μg/mL mRv3873、Ag85A抗原和rRv3873抗原包被96孔酶标板,100 μL/孔,4℃包被过夜;加入健康体检者和TB患者血清(用PBS 1∶200稀释),室温下孵育2 h;TBST缓冲液(含1×TBS,0.05% Tween-20)洗涤,加入HRP标记的羊抗人IgG(1∶5 000稀释),室温下孵育30 min,通过酶标仪在波长450 nm处测定27例TB病患者和31名健康体检者血清中抗结核IgG抗体水平。
1.10 统计学分析 利用GraphPad Prism 8.0软件作图,绘制ROC(receiver operator characteristic)曲线,采用t检验分析基于此抗原IgG抗体水平,以P<0.05为差异有统计学意义。
2 结果
2.1 rv3873基因扩增产物的鉴定rv3873基因PCR扩增产物经1%琼脂糖凝胶电泳分析,可见约1 100 bp的特异性条带,大小与预期相符,见图1。
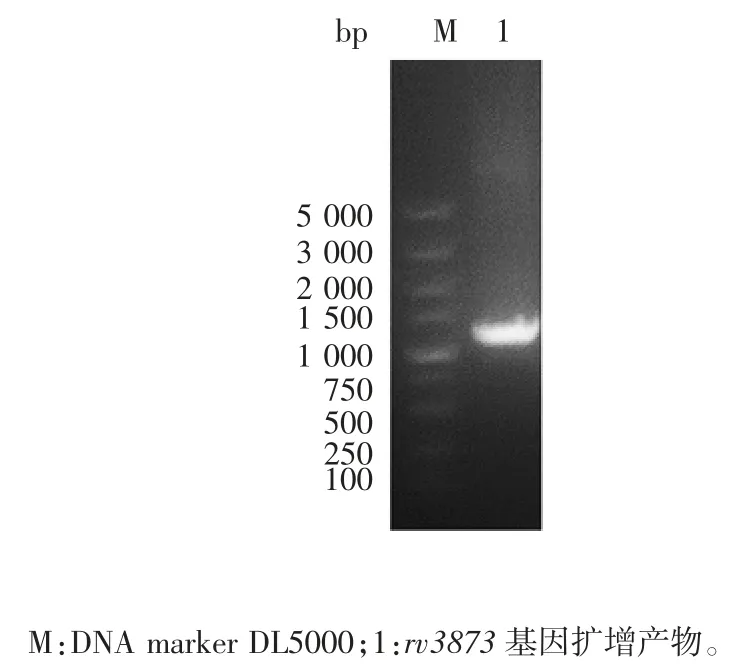
图1 rv3873基因PCR扩增产物电泳图Fig.1 Electrophoretic profile of PCR product of rv3873 gene
2.2 重组表达质粒的鉴定 重组表达质粒pMF406-rv3873的双酶切(BamHⅠ/EcoRⅠ)产物经1%琼脂糖凝胶电泳分析,可见大小与预期相符的载体pMF406片段和rv3873基因片段,见图2。测序证实,碱基序列与Mtb H37Rv基因完全一致,提示目的基因原核表达载体构建正确。
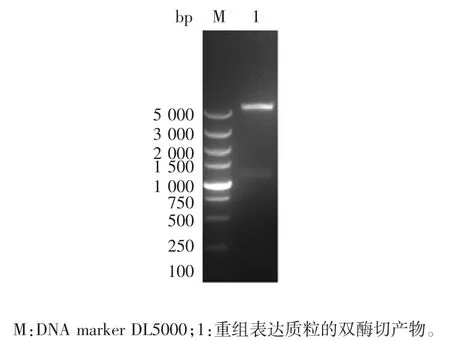
图2 重组表达质粒pMF406-rv3873的双酶切(BamHⅠ/EcoRⅠ)鉴定Fig.2 Restriction map of recombinant expression plasmid pMF406-rv3873(BamHⅠ/EcoRⅠ)
2.3 表达产物的鉴定12% SDS-PAGE分析显示,重组蛋白Rv3873主要以可溶性形式表达,部分为包涵体形式存在,相对分子质量约为40 000,见图3。
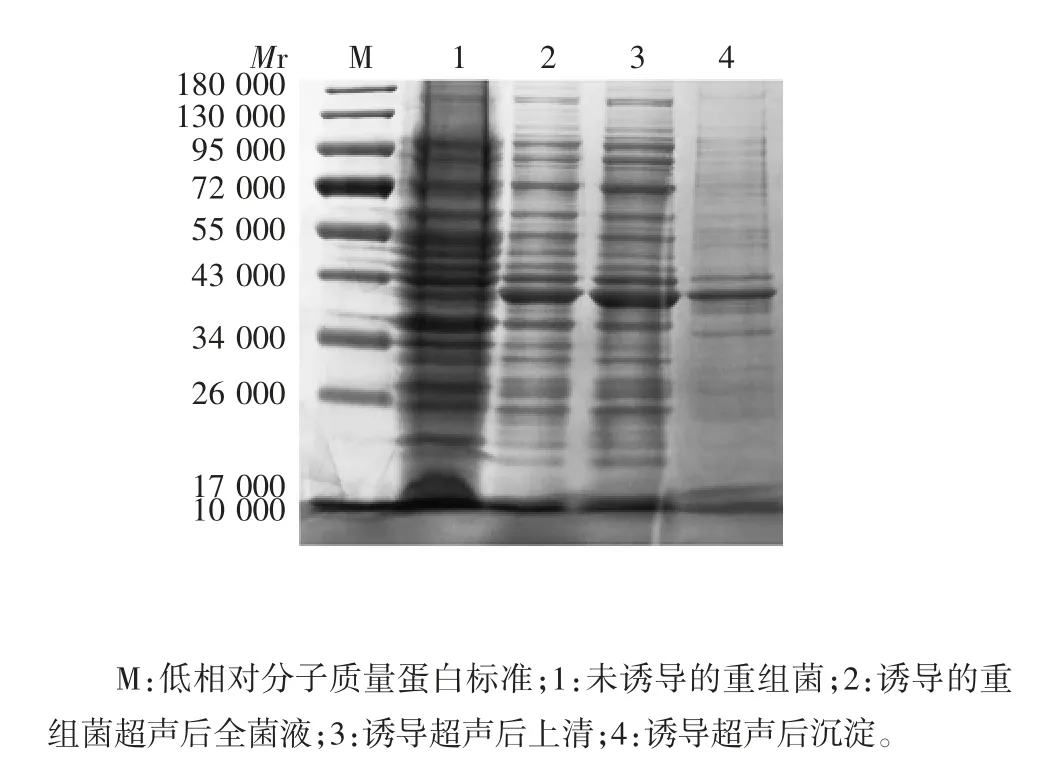
图3 表达产物的SDS-PAGE分析Fig.3 SDS-PAGE profile of expressed product
2.4 纯化产物的鉴定
2.4.1 纯度及浓度12% SDS-PAGE分析显示,纯化的重组蛋白纯度为95%,浓度为2.0 mg/mL,见图4。稀释至1.0 mg/mL,分装保存。

图4 纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified product
2.4.2 抗原特异性Western blot分析显示,纯化的重组Rv3873蛋白可与鼠抗His-tag单克隆抗体反应,在相对分子质量约40 000处可见特异性条带,见图5。表明重组Rv3873蛋白具有较好的抗原特异性。

图5 纯化产物的Western blot分析Fig.5 Western blotting of purified product
2.5 Rv3873抗原的血清学诊断评价ELISA结果显示,TB组mRv3873和Ag85A抗原特异性IgG水平均明显高于健康人组(t分别为3.967和4.190,P<0.05),而rRv3873抗原特异性IgG水平两组差异无统计学意义(t=1.460,P>0.05)。见图6。
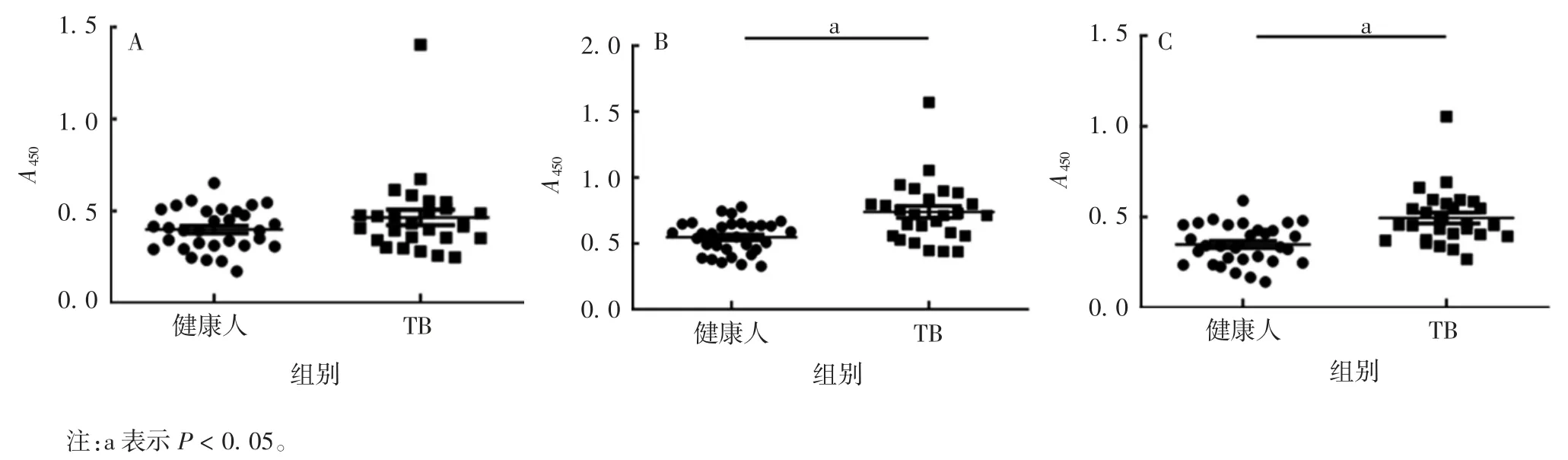
图6 ELISA法检测血清中rRv3873(A)、mRv3873(B)和Ag85A(C)抗原特异性IgG抗体水平Fig.6 ELISA of serum IgG levels against rRv3873(A),mRv3873(B)and Ag85A(C)
2.6 ROC曲线分析mRv3873曲线下面积(0.776 0,95% CI:0.653 9~0.898 1)与Mtb主要免疫优势抗原Ag85A(0.778 4,95% CI:0.661 4~0.895 3)相当,而rRv3873曲线下面积仅为0.586 6(95% CI:0.439 0~0.734 3),见图7。
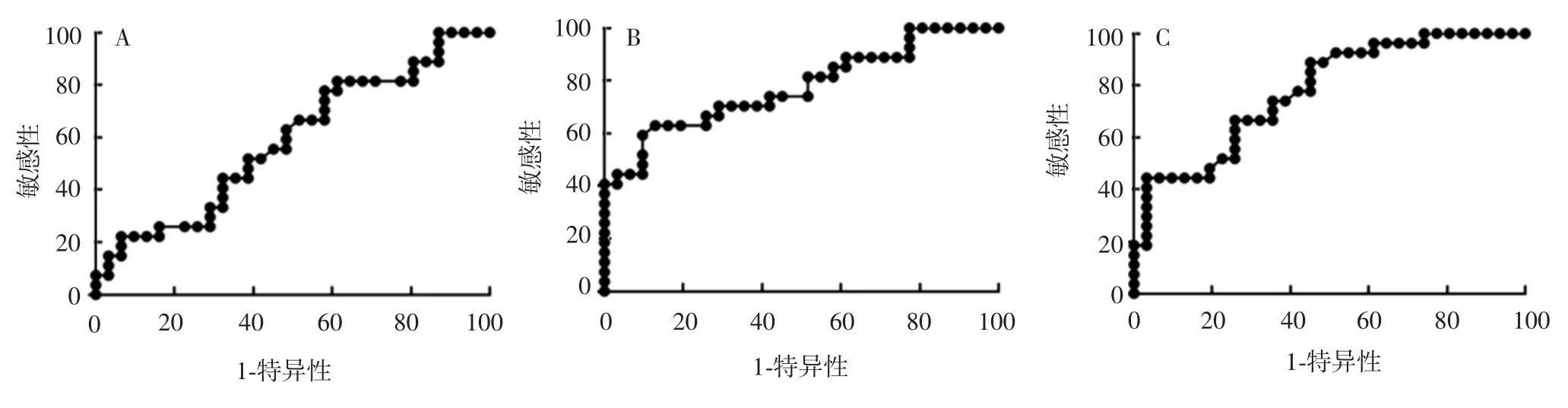
图7 抗原rRv3873(A)、mRv3873(B)和Ag85A(C)检测IgG的ROC曲线Fig.7 ROC curves of IgG antibodies against rRv3873(A),mRv3873(B)and Ag85A(C)
3 讨论
血清学检查简单、快速、价廉,是TB实验室诊断的重要手段之一。但特异性抗原的缺乏在一定程度上限制了血清学检测的临床价值及应用范围。目前用于血清学诊断TB的抗原主要为脂阿拉伯甘露糖(lipoarabinomannan,LAM)[17-18]、分泌蛋白38 kD抗原[19]、MPT64[20-21]、ESAT-6[22]和Ag85复合物等。其中,Ag85A作为Mtb一种分泌蛋白,可诱导机体发生较强的免疫反应,研究发现,Ag85A可与TB患者血清发生反应,在血清学诊断TB中具有重要价值[23]。但现有抗原作为诊断试剂均无法达到临床应用水平,因此,寻找新型抗原仍是TB血清诊断研究的重要方向之一。
Rv3873(PPE68)是PPE家族中的一员,由Mtb中RD1区基因编码,在协助病原体宿主吞噬细胞中存活起重要作用[24]。研究发现,Rv3873具有较好的免疫原性,能刺激机体产生IFNγ特异性T细胞反应[14,24],表明Rv3873对TB诊断具有一定的价值。在血清学诊断研究中,以重组蛋白PPE68(Rv3873)、CFP10和融合蛋白CFP10-PPE68作为包被抗原检测TB患者血清中特异性抗体,发现3种蛋白在TB中均有较好的诊断效果,且重组融合蛋白CFP10-PPE68检测效果最佳;尽管这3种蛋白在TB血清学诊断中特异性均较高,但敏感性低[15]。因此,尽管该抗原具有作为TB血清诊断的潜力,但其效果还需进一步加强。
Mtb生长缓慢,极大阻碍了分枝杆菌遗传学的发展。相比较下,Msm生长快,因此,利用分枝杆菌同源表达系统可在Msm中表达并纯化免疫原性良好的Mtb特异性抗原[25]。本研究将构建的分枝杆菌重组表达质粒pMF406-rv3873电转化至快速分枝杆菌Msm,成功实现了其在分枝杆菌中的同源表达,并纯化了重组蛋白mRv3873。本实验构建所用的分枝杆菌表达系统pMF406具有6×His标签,可与重组蛋白N-端融合表达,通过形成配位键而与金属螯合亲和层析柱上固定化的二价金属离子(如镍)结合,使重组蛋白得到纯化,该方法简便易行。本研究制备的重组蛋白mRv3873大部分以可溶形式表达,且研究发现,在TB患者体内抗同源表达抗原mRv3873和Ag85A抗原特异性IgG水平明显高于健康人群(P<0.05),而异源表达抗原rRv3873特异性IgG水平则与健康人群差异无统计学意义(P>0.05)。进一步的ROC曲线分析发现,mRv3873抗原的诊断效能与对照组Ag85A相当,其曲线下面积与对照抗原Ag85A相当,明显高于rRv3873,表明同源表达的mRv3873在TB血清学诊断中具有较好的诊断效能,其效果与Ag85A相当;而异源表达抗原rRv3873在TB患者与健康人中无差异,诊断效能一般。
综上所述,本研究提供了Mtb RD1区特异性抗原Rv3873在快速生长Msm中的表达和纯化方法,并证明同源表达的mRv3873诊断效能优于异源表达的rRv3873,可作为TB血清学诊断的优选抗原之一。
——一道江苏高考题的奥秘解读和拓展

