超声引导下RFA与GnRH-a和LNG-IUS联用治疗子宫腺肌病的临床疗效观察
王微,吴改娜,王玉娇,赵小萌,邢兰兰,王纪元,杨平芳
子宫腺肌病(adenomyosis,AM)是育龄期女性常见病,资料显示AM发病率不断升高,且发病年龄较年轻[1]。已有研究指出,AM影响女性生育能力,患者不孕症发生率高[2]。临床可供选择的治疗方法较多,包括外科手术、药物治疗等[3]。然而,多数育龄期女性强烈要求保留生育功能,因此,在帮助其提高生育能力的同时精准清除病灶是临床医生亟待解决的重点、难点。腹腔镜内异症保守性手术能精准掌握宫内、外情况,在治疗AM的同时能妥善处理妇科其他疾病,尤其适用于有生育需求的AM患者[4]。越来越多学者推荐术后进行后续治疗。有研究尝试将促性腺激素释放激素激动剂(gonadotrophin releasing hormone agonist,GnRH-a)与左炔诺孕酮宫内缓释系统(levonorgestrel-releasing intrauterine system,LNG-IUS)联用治疗AM,其中GnRH-a能减轻患者痛经程度、缩小子宫体积等,但可能造成骨矿物质流失等多样化不良作用;LNG-IUS通过持续、缓慢释放左炔诺孕酮,作用时间持久,能抑制子宫内膜异常增长,但不良反应明显(例如腰疼、乳房胀痛),且可能脱落[5]。可见,GnRH-a、LNG-IUS单独应用时利弊并存,往往受到一定限制。近些年,超声引导下经皮射频消融(percutaneous radiofrequency ablation,RFA)是颇具应用前景的非侵入性外科手段,已成功应用于外科实体瘤的治疗[6]。有研究指出,超声引导下RFA治疗良、恶性肿瘤兼具安全性、有效性[7]。然而,采用超声引导下RFA单独治疗在减轻AM症状方面不甚理想,有可能造成病灶组织无法全面坏死吸收,故有必要与其它方法联用以取得更满意的治疗效果。本研究将超声引导下RFA与GnRH-a和LNG-IUS联用治疗AM,尝试找寻疗效佳且能有效保留AM患者生育功能的综合保守治疗策略。
1 资料与方法
1.1 临床资料
选取2018年7月至2020年6月在保定市妇幼保健院诊治的106例AM患者,根据不同手术术式将患者分为两组,每组各53例。A组年龄25~44岁,平均(36.54±3.49)岁,病程3~31个月,平均(8.72±2.43)个月;B组年龄26~45岁,平均(35.73±3.73)岁,病程4~30个月,平均(8.53±2.36)个月。两组资料比较差异无统计学意义(P>0.05)。本研究经河北省保定市妇幼保健院伦理委员会批准(伦理批准号:20180422)。
1.2 纳入与排除标准
纳入标准:① 符合AM诊断标准[8],且经临床检查、实验室检查、影像学检查证实;② 有渐进性痛经和(或)月经过多史;③ 患者均要求保留子宫;④ 均签署知情同意书。
排除标准:① 存在宫颈或子宫内膜恶性病变;② 其他慢性疾病造成的贫血,或存在凝血功能障碍;③ 未婚患者,或妊娠期女性患者,或非育龄期女性患者;④ 有原发性痛经史;⑤ 重要器官器质性病变;⑥ 存在GnRH-a、LNG-IUS放置等禁忌;⑦ 患恶性肿瘤;⑧ 治疗前6个月内曾接受过激素治疗,或其他手术治疗;⑨ 患精神疾病;⑩ 糖尿病患者。
1.3 方法
A组采用超声引导下RFA联合GnRH-a和LNG-IUS治疗。超声引导下RFA实施方案:① 协助AM患者完成超声检查,明确病灶位置,常规消毒(阴道或腹部)、麻醉,在超声引导下进行RFA;② 取射频消融针,对准病灶中心精准刺入;③ 超声引导下RFA参数设置:消融温度60℃~80℃,功率26W,消融时间0.5 h,消融范围控制在病灶周边1.5 cm左右,术毕即刻行超声造影,用于评估消融范围。
B组采用腹腔镜内异症保守性手术联合GnRH-a和LNG-IUS治疗。腹腔镜内异症保守性手术实施方案:① 气管插管全麻,进腹后需细致探查盆腔,按序检查子宫直肠窝、双侧输卵管、卵巢等各部位,可视黑色病灶、紫蓝色病灶均是内异症,并确定分期(依据美国生育学会1985年修订评分标准);② 钝、锐性分离盆腔粘连,卵巢囊肿较大情况下,建议穿刺吸尽囊内容物,再剪开卵巢皮质,剥离囊壁,装进取物袋,小心取出体外,及时送检;③ 肉眼能观察到的病灶尽量进行电凝或切除;④ 本研究选取的AM病例均有生育要求,因此在术中常规行输卵管通液术,取Foly导尿管,并精准置放在宫腔内,注入适量已稀释的亚甲蓝,密切观察双侧输卵管伞端,如没有观察到蓝色液体流出,同时伞端未堵塞,需要遵照医嘱行宫腔镜下输卵管插管术,伞端堵塞情况下,需实施输卵管造口术,在以上手术结束后均需要再次通液;⑤ 术毕,取大量生理盐水冲洗盆腹腔,创面注入透明质酸钠凝胶;⑥ 术后处理:遵照医嘱常规给予缩宫素、预防感染等措施。
两组患者于第1次月经来潮第3天行GnRH-a治疗,每隔28 d注射1次,视患者病情实际,个性化注射2~6次。术后12周,待患者月经来潮7 d内,行LNG-IUS治疗,具体操作参照LNG-IUS放置操作规范。病例均有生育要求,因此,在停药4周后可尝试妊娠,可自主选择自然受孕或行体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)。
1.4 观察指标
1.4.1 子宫体积 治疗前和治疗后6个月、12个月,行超声检查,子宫体积计算公式为(长径×前后径×横径×π/6)。
1.4.2 痛经程度与月经量 治疗前和治疗后6个月、12个月,用视觉模拟评分法(visual analogue scale,VAS)[9]评估患者痛经程度,VAS评分范围0分(痛经程度最轻)~10分(痛经程度最重);全部患者均使用同品牌卫生巾,月经失血图(pictorial blood loss assessment chart,PBAC)[10]评分>100分表明月经过多。
1.4.3 激素水平 治疗前和治疗后3个月、6个月、12个月,均采集患者空腹静脉血5 mL,离心处理,用酶联免疫吸附法检测血清卵泡刺激素(follicle-stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)、催乳素(prolactin,PRL)、雌二醇(estradiol,E2)、孕酮(progesterone,P)水平。
1.4.4 复发情况 复发标准:如患者出现“痛经复发、妇检发现触痛结节、B超发现盆腔肿块”中任意一项且除外其他疾病(痛经复发定义:治疗有效的患者VAS评分高于治疗前80%以上)。
1.4.5 妊娠情况 统计总体妊娠率,包括自然妊娠率、IVF-ET妊娠率。但不考虑停经6~8周B超发现宫内妊娠。依据患者症状、体征、妊娠试验、超声检查等综合判断妊娠情况。
1.4.6 并发症情况 轻度皮肤红斑,无发生尿路感染,大便正常,双下肢活动自如。月经正常,无异常子宫出血。
1.5 统计学方法

2 结果
2.1 两组中各1例典型病例情况
根据治疗效果愈后,图1(见下页)具有典型性和代表性,对文章的分析差异化有较好的支撑。A组1例治疗前宫体大小约63 mm×58 mm×52 mm,体积增大,形态饱满,后壁增厚,边界不清,肌层回声增粗不均,余肌层回声均匀,宫腔线前移,内膜厚约6 mm。其内见点条状血流信号。双侧附件区未见明显异常回声。治疗后1月复查,子宫大小约 58 mm×50 mm×49 mm,较术前稍减小,但后壁血供明显减少。子宫内膜线完整,无缺损,子宫内膜无损伤。双侧附件区未见明显异常回声。
B组1例治疗前宫体大小约61 mm×57 mm×53 mm,体积增大,形态不规则,肌层回声增粗增强,以后壁为甚,宫腔线明显前移,内膜厚约8 mm。宫体后壁可见不均质回声团,边界不清。双侧附件区未见明显异常回声。治疗后1月复查,子宫较术前稍减小,后壁血供消失。子宫内膜线完整,无缺损,子宫内膜无损伤。双侧附件区未见明显异常回声。
2.2 两组子宫体积比较
治疗后6个月、12个月,两组子宫体积均小于治疗前(P<0.05),且不同时间点两组间子宫体积比较差异无统计学意义(P>0.05)。详见下页表1。12个月随访期间内无失访患者。

表1 两组子宫体积比较
2.3 两组痛经程度与月经量比较
治疗后6个月、12个月,两组的VAS评分、PBAC评分均小于治疗前(P<0.05),且不同时间点两组间VAS评分、PBAC评分比较差异无统计学意义(P>0.05)。详见下页表2。
2.4 两组激素水平比较
治疗后3个月、6个月、12个月,两组血清FSH、LH、PRL、E2、P均低于治疗前(P<0.05),治疗后6个月、12个月,两组血清FSH、LH、PRL、E2、P均低于治疗后3个月(P<0.05),且不同时间点两组间血清FSH、LH、PRL、E2、P水平比较差异无统计学意义(P>0.05)。详见下页表3。

表2 两组痛经程度与月经量比较分)
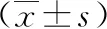
表3 两组激素水平比较

图1 两组中各1例典型病例情况
2.5 两组复发与痛经缓解情况比较
治疗后与治疗后12个月两组痛经缓解情况组间比较,差异无统计学意义(P>0.05)。治疗后随访12个月,A组复发6例,B组无复发病例,B组复发率0%(0/53)低于A组11.32(6/53)(P=0.027)。详见下页表4。

表4 两组痛经缓解情况
2.6 两组妊娠情况比较
治疗后随访12个月,两组患者均保留生育功能。A组总妊娠率58.49%(31/53),其中自然妊娠率45.28%(24/53),IVF-ET妊娠率13.21%(7/53);B组总妊娠率79.52%(42/53),其中自然妊娠率69.81%(37/53),IVF-ET妊娠率9.43%(5/53)。两组间总妊娠率比较差异有统计学意义(χ2=5.324,P=0.021)。
2.7 两组并发症情况比较
两组患者均未出现严重并发症。
3 讨论
AM是女性多见的子宫良性疾病,痛经、子宫增大、经量增多等均是AM的特征性临床表现,不及时、不正确救治很可能影响其生育功能,发生不孕、流产等[11]。本研究表1、表2结果说明,超声引导下RFA与GnRH-a和LNG-IUS联合适用于治疗AM,能缩小子宫体积、减轻痛经程度、减少月经量。分析原因可能是,超声引导下RFA是应用前景较好的微创术式,能使病灶组织凝固性坏死,达到有效消融。不仅如此,RFA治疗全程均由超声引导,定位准确性显著提高,能有效调整治疗区域局限于病灶,以防损伤邻近正常组织,即通过提高靶向治疗准确性实现安全消融的目的。然而,在保守性治疗(包括本研究中的超声引导下RFA与腹腔镜内异症保守性手术)后,通常需要长期管理。本研究在AM患者保守性治疗后辅助给予GnRH-a与LNG-IUS联合治疗,其中,GnRH-a能直接影响垂体促性腺激素释放过程,进而调节机体激素水平,抑制卵巢雌、孕激素释放,消除雌激素对AM病灶的刺激,发挥药物性卵巢去势作用,辅助使用GnRH-a能有效促进子宫内膜萎缩,进而缩小子宫体积、减轻痛经程度、减少月经量,有效控制病情进展。徐锋等[12]做过相似研究,与仅采用高强度聚焦超声消融比较,高强度聚焦超声联合GnRH-a治疗AM能更有效地缩小病灶体积和子宫体积,同时改善痛经症状。LNG-IUS属于宫内节育器,能局部稳定持续释放左炔诺孕酮(约20 μg/d),进而减轻患者痛经、缩小子宫体积等。邹艳芬[13]研究表明,腹腔镜病灶切除术联合LNG-IUS治疗AM能够显著改善患者的各项临床症状。提示,GnRH-a、LNG-IUS均能巩固保守性治疗(对应本研究中超声引导下RFA与腹腔镜内异症保守性手术)的效果。
FSH、LH、PRL、E2、P均是衡量卵巢功能的有效指标[14-16]。本研究表3结果提示,超声引导下RFA与GnRH-a和LNG-IUS联合用于治疗AM能调节激素水平。分析原因可能是,超声引导下RFA因定位准确,在实施过程中能更精准治疗,避免损伤卵巢;腹腔镜内异症保守性手术同样如此,能较准确避开子宫卵巢血运,良好保留AM患者生育功能,降低盆底功能障碍发生概率。超声引导下RFA或腹腔镜内异症保守性手术术后给予GnRH-a与LNG-IUS联合治疗,随着时间延长,FSH、LH、PRL、E2、P等多项指标检测结果趋于平稳状态。与国内一项研究结论相似[17],GnRH-a联合宫腔镜及曼月乐治疗围绝经期子宫腺肌病有助于提高治疗效果,且能改善性激素水平。
本研究中,患者治疗后随访12个月,B组复发率显著低于A组。分析原因可能是,腹腔镜内异症保守性手术能精准切除AM局部病变组织,因此,能降低AM持续性病变风险。而超声引导下RFA虽然能使病灶组织凝固性坏死,但很可能遗漏局部微小病灶,AM患者术后仍有复发可能。因此,安全消融的前提条件下建议最大化消融面积,以确保足够的消融范围。AM患者在腹腔镜内异症保守性手术或超声引导下RFA治疗后,均进行长期管理,术后辅助应用GnRH-a与LNG-IUS,同样能达到预防复发的目的。
AM的发生、发展,均可能导致患者继发性不孕[18]。本研究选取的AM病例均有生育意愿,故均以保守性治疗为主,在患者治疗后随访12个月,B组总妊娠率显著高于A组,提示超声引导下RFA与GnRH-a和LNG-IUS联合用于治疗AM可能降低总妊娠率。猜测与此综合治疗策略远期效果欠佳有关。有研究指出,GnRH-a的作用具有可逆性,合理应用利于提高卵质量、妊娠率[19]。建议对有生育需求的AM患者,如采取超声引导下RFA与GnRH-a和LNG-IUS联用治疗方案,在治疗后尽快妊娠,短期内不能自行受孕者,可借助IVF-ET。另外,本研究发现两组患者均未出现严重并发症。提示超声引导下RFA与GnRH-a和LNG-IUS联合用于治疗AM安全性高。
综上所述,超声引导下RFA与GnRH-a和LNG-IUS联合用于治疗AM疗效肯定,能缩小子宫体积、减轻痛经程度、减少月经量、调节激素水平,无卵巢损伤,但复发率高、妊娠率低。由于本研究为单中心小样本分析,且由于研究时间及研究经费限制,导致本研究分析可能不够充分,研究结果还有待进一步通过开展多中心、大样本、多角度进行验证。

