TRIM59 通过结合BCLAF1 调控人皮肤黑色素瘤SK-MEL-2 细胞的恶性生物学行为
刘建敏,周亚净,何润之,段春胜(邢台市人民医院 手足外科,河北 邢台 054001)
黑色素瘤是由产生色素的黑色素细胞恶性转化、增殖而来。当黑色素瘤位于皮肤表皮的基底层,则被称为皮肤黑色素瘤,这是最常见的黑色素瘤[1-2]。皮肤黑色素瘤的发病率在世界范围内呈逐年上升的趋势[3]。因此,关于皮肤黑色素瘤发病的分子机制研究对其高效诊断、治疗甚至预防十分有必要。近年来发现,三结构域(tripartite motif,TRIM)家族蛋白通过调控肿瘤细胞的生物学行为来参与肿瘤的发生发展。三结构域蛋白59(tripartite motif-containing 59,TRIM59)是TRIM 家族成员之一,其能够识别、结合特定的靶蛋白,调节蛋白的泛素化修饰,诱导靶蛋白进入蛋白酶体依赖的泛素降解过程,从而进一步调节靶蛋白参与的许多生物过程[4]。研究[4]发现,TRIM21 可通过调控Wnt/β-catenin 信号通路增强卵巢癌细胞的增殖能力。TRIM59 在肿瘤的发展过程中既具有促癌作用也有抑癌作用[6],而其在皮肤黑色素瘤中的作用尚未可知。Bcl2相关转录因子1(Bcl2-associated transcription factor 1,BCLAF1)在多种细胞中发挥抗凋亡作用,但其在癌症中具有双重作用,其在皮肤黑色素瘤中的功能也尚不十分清楚。据以往研究[7]推测BCLAF1 在皮肤黑色素瘤中发挥致癌作用。通过Starbase 网站分析发现,在黑色素瘤中TRIM59 与BCLAF1 的表达存在负相关性,采用RBPsuite 预测到BCLAF1 为TRIM59 的蛋白结合基因之一。本研究旨在探究TRIM59 调控黑色素瘤细胞增殖、凋亡、迁移侵袭的潜在机制,及其与BCLAF1之间的关系。
1 材料与方法
1.1 主要材料与试剂
36 例人皮肤黑色素瘤组织来自2019 年2 月至2021 年7 月间于邢台市人民医院接受手术的皮肤黑色素瘤患者。本研究经医院伦理委员会审批通过[院科伦审:(2019)伦审第(04)号],所有患者均签署知情同意书。人表皮黑色素细胞HEMn-LP、人皮肤黑色素瘤细胞SK-MEL-2、UACC903 和A375 均购自美国菌种保藏中心,DMEM 培养基购自北京索莱宝生物科技公司,总核糖核酸提取试剂(TRIzol)、LipofectamineTM3000 脂质体均购自美国Invitrogen 公司,qPCR检测试剂盒购自南宁建成生物科技有限公司,兔抗TRIM59、周期蛋白D1(cyclin D1,CCND1)、细胞周期素依赖性激酶2(cyclin dependent kinase 2,CDK2)、人肿瘤抑制蛋白(human tumor protein P53,TP53)、Bcl2 相关转 录因子1(Bcl2-associated transcription factor 1,BCLAF1)多抗、HRP 标记的二抗均购自上海艾博抗贸易有限公司,Annexin VFITC/PI细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,细胞计数试剂盒(CCK-8)购自日本同仁化学研究所,迁移、侵袭Transwell 小室购自美国Corning公司。
1.2 细胞培养与分组转染
HEMn-LP、SK-MEL-2、UACC903、A375 细胞均使用含10%胎牛血清和1%的青链霉素双抗的DMEM培养基于37 ℃、5%CO2的饱和湿度恒温细胞培养箱中常规培养,每2 d更换一次培养液。
通过qPCR 实验检测SK-MEL-2、UACC903 和A375 细胞中TRIM59 mRNA 的表达水平,选择与HEMn-LP 细胞相比TRIM59水平变化幅度最大的细胞(SK-MEL-2细胞)进行后续研究,进行分组、转染。采用siDirect version 2.0 软件(http://sidirect2.rnai.jp/design.cgi)设 计si-TRIM59 序 列(5′-CCCUGAACAUUA CAGGCAATT-3')及其对照片段si-con,委托上海吉玛公司合成。将SK-MEL-2 细胞分为3 组,使用LipofectamineTM3000 脂质体分别将si-TRIM59、si-con转染入细胞作为si-TRIM59组、si-con组,另一组不进行任何转染为Normal 组,转染12 h 后更换新培养基再继续培养36 h,共培养48 h,qPCR法检测干扰是否成功。
1.3 qPCR 法检测TRIM59、BCLAF1 mRNA 在黑色素瘤组织与细胞中的表达
TRIzol液提取对数生长期细胞RNA或充分研磨的肿瘤组织中的总RNA,并将其反转录为cDNA,作为模板,-20 ℃保存备用。使用qPCR试剂盒检测模板中TRIM59的表达情况。GAPDH为内参,2-△△Ct法计算TRIM59的相对表达量。GAPDH的正向引物为5'-CACCCACTCCTCCACCTTTG-3',反向引物为5'-CCACCACCCTGTTGCTGTAG-3';TRIM59 的正向引物为5'-CACCCACTCCTCCACCTTTG-3',反向引物 为5'-CCACCACCCTGTTGCTGTAG-3';BCLAF1的正向引物为5′-TCTGGAATAGAAGGCACTCT AGG-3′,反向引物为5′-ACCCTCGTCTTTTAG AAACAGGA-3′。反应程序:95 ℃预变性50 s;95 ℃变性5 s,60 ℃退火并延伸50 s,共进行40次循环。
1.4 WB 法检测沉默TRIM59 对SK-MEL-2 细 胞TRIM59、CCND1、CDK2、TP53、BCLAF1蛋白表达的影响
使用RIPA 裂解液充分裂解各组细胞,并提取总蛋白。使用BCA 定量试剂盒对蛋白定量,100 ℃沸水浴中使蛋白变性,结束后,用上清液做蛋白电泳上样模板行SDS-PAGE,再用转膜仪在0 ℃下将胶上的蛋白转移至PVDF膜,用5%脱脂奶粉封闭液于37 ℃封闭膜2 h,PBS 洗膜3 次,浸入10 mL 稀释的一抗溶液中,37 ℃反应3 h,洗膜后再浸入稀释的二抗溶液,37 ℃反应1.5 h,洗膜,用ECL 试剂盒显影、曝光。Image J 软件分析蛋白条带的灰度值,用目的蛋白灰度与内参蛋白灰度之比表示蛋白的相对表达量。
1.5 CCK-8 法检测沉默TRIM59 对SK-MEL-2 细胞增殖的影响
调整对数期的各组细胞至0.5×105个/mL,接种至96 孔板,每孔200 μL。细胞培养箱中分别培养24、48、72、96 h。取出细胞加入10 μL/孔的CCK-8溶液,震荡混匀,避光反应25 min。用酶标仪检测490 nm处细胞悬液的光密度(D)值,以D值代表细胞增殖水平。
1.6 流式细胞术检测沉默TRIM59 对SK-MEL-2 细胞周期与凋亡的影响
细胞周期:收集对数期各组细胞,用PBS洗涤3 次。用预冷的70%乙醇固定,4 ℃固定30 min。洗涤,用RNase A 除去RNA,加入PI 染色(50 μg/mL),4 ℃避光培养30 min。上流式细胞仪分析细胞周期的分布情况。
细胞凋亡:用预冷的PBS 溶液洗涤对数期的各组细胞5次,再用结合缓冲液(500 μL)悬浮。先加入5 μL 的Annexin V-FITC 室温避光反应20 min,再加入5 μL的PI继续培养15 min,终止反应。300目筛过滤,上细胞流式仪检测分析细胞凋亡。细胞总凋亡率=早期凋亡率+晚期凋亡率。
1.7 划痕愈合实验检测沉默TRIM59 对SK-MEL-2细胞迁移能力的影响
取对数期的细胞,更换细胞培养液为含1%胎牛血清的DMEM培养液。培养约12 h,细胞铺满单层,汇合度达90%以上,用灭菌牙签垂直板底划线。洗去划痕脱落的细胞,用低血清培养基继续培养24 h,显微镜下观察划痕愈合的抑制情况。划痕抑制率=(si-TRIM59 组宽度0h-si-TRIM59 组宽度24h)/(si-con组宽度0h-si-con组宽度24h)×100%。
1.8 Transwell 实验检测沉默TRIM59 对SK-MEL-2细胞迁移、侵袭能力的影响
将对数期的各组细胞,用含1%胎牛血清的DMEM 培养液饥饿处理12 h,调整细胞密度至0.5×104个/mL,待用。用含人工基膜的Trasnwell 小室检测细胞侵袭能力,不含人工基膜的小室检测细胞迁移能力。按照Transwell 小室说明书要求操作,上室铺细胞,下室加含5%胎牛血清的培养基,培养12 h。结束后,4%多聚甲醛固定,0.5%结晶紫溶液染色,显微镜下观察细胞穿膜情况,采用五点法计数穿膜细胞,取平均值代表细胞的迁移或侵袭能力。
1.9 Co-IP实验检测TRIM59与BCLAF1的蛋白结合能力
将对数期的各组细胞,经RIPA处理后充分裂解,8 500×g离心10 min,取上清。将上清分别设为input组、IP:TRIM59组、IP:BCLAF1组。其中input组不添加任何抗体,IP:TRIM59 组加入TRIM59 抗体,IP:BCLAF1组加入BCLAF1抗体,混匀,4 ℃反应过夜。取出,加入蛋白A/G,继续反应5 h,离心,收集沉淀。PBS充分清洗沉淀,用上样缓冲悬浮细胞,煮沸变性,取上清液,用WB 法检测TRIM59、BCLAF1 的表达情况。
1.10 统计学处理
实验中的数据均用SPSS23.0处理。计量资料用均数±标准差表示,多组数据比较用单因素方差分析,组内两两比较用LSD-t检验。两组数据比较用独立样本t检验。以P<0.05 或P<0.01 表示差异具有统计学意义。
2 结果
2.1 TRIM59 在人皮肤黑色素瘤细胞和黑色素细胞中的表达及其与患者存活率的关系
WB 法(图1)和qPCR(表1)检测结果显示,与HEMn-LP 组相比,SK-MEL-2、UACC903、A375 组细胞TRIM59 的mRNA 和蛋白表达均显著升高(均P<0.01)。gepia.cancer网站分析结果(图2)显示,TRIM59高表达患者的存活率降低。
表1 TRIM59 mRNA在人皮肤黑色素瘤细胞和黑色素细胞中的表达(,n=9)
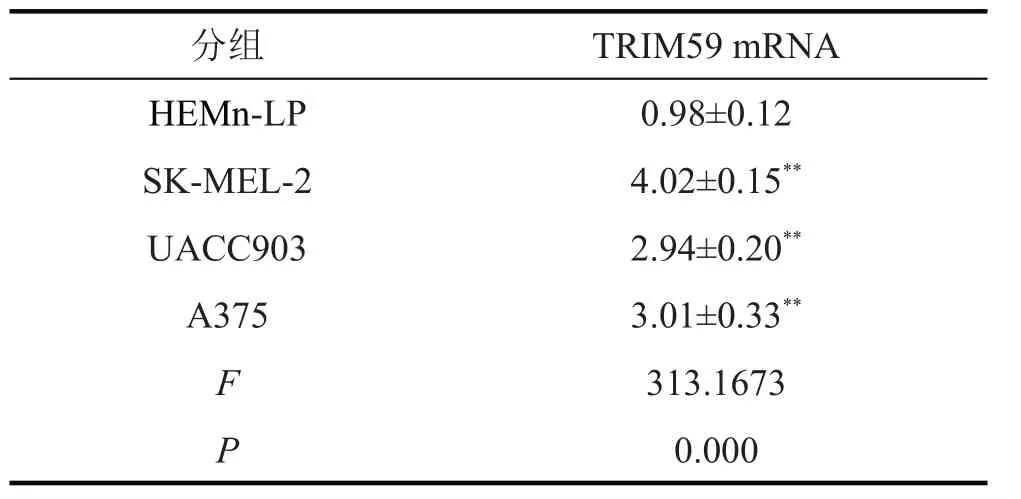
表1 TRIM59 mRNA在人皮肤黑色素瘤细胞和黑色素细胞中的表达(,n=9)
与HEMn-LP组比较,**P<0.01
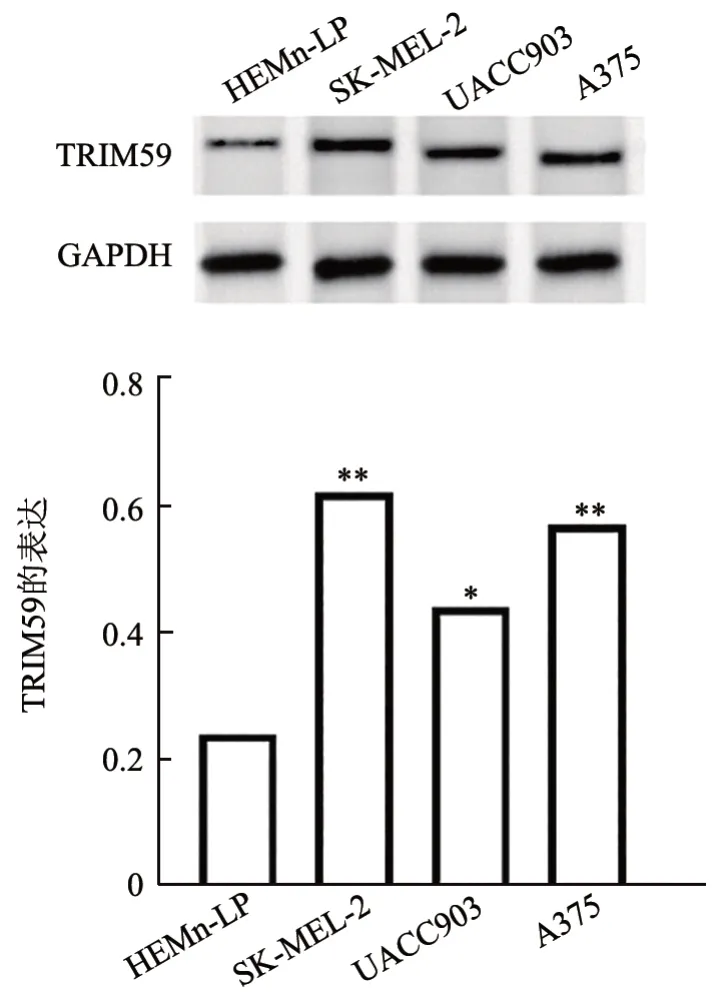
图1 人皮肤黑色素瘤细胞和黑色素细胞中TRIM59蛋白表达及其对患者存活的影响
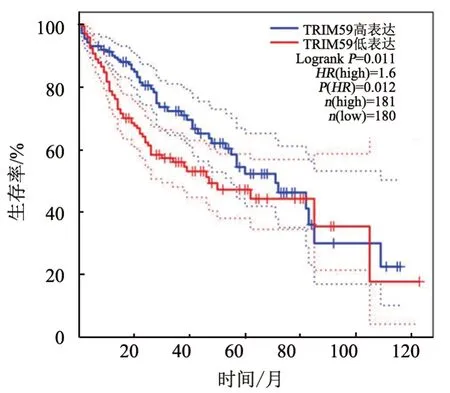
图2 TRIM59蛋白表达水平对黑色素瘤患者生存率的影响
2.2 沉默TRIM59抑制SK-MEL-2细胞的增殖
WB 法(图3)、qPCR(表2)检测结果显示,与sicon 组相比,si-TRIM59 组细胞TRIM59 的mRNA 和蛋白表达均显著降低(均P<0.01);CCK-8 法检测结果(图4)显示,在48、72、96 h 时si-TRIM 组细胞增殖水平显著降低(均P<0.05)。
表2 转染si-TRIM59后SK-MEL-2细胞中TRIM59 mRNA的表达显著降低(,n=9)
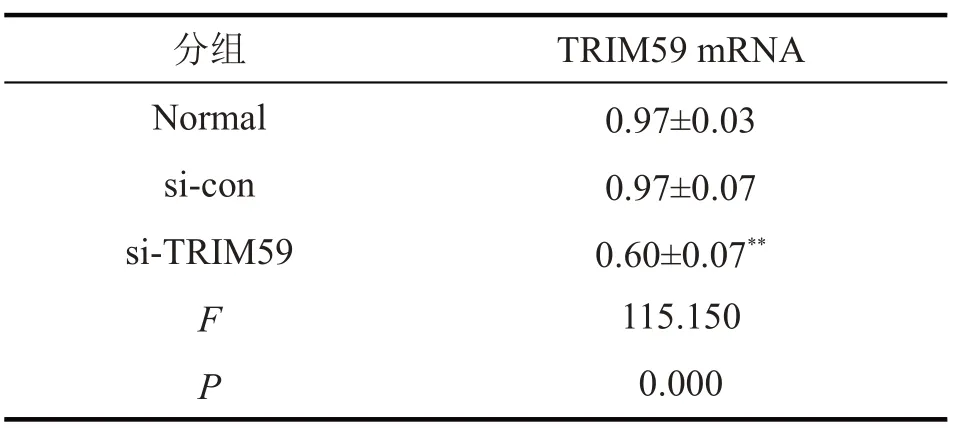
表2 转染si-TRIM59后SK-MEL-2细胞中TRIM59 mRNA的表达显著降低(,n=9)
与si-con组和Normal组比较,**P<0.01

图3 转染si-TRIM59抑制SK-MEL-2细胞中TRIM59蛋白的表达
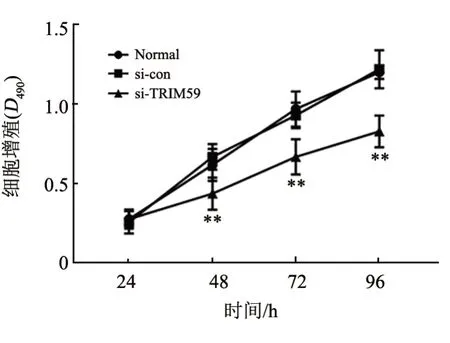
图4 沉默TRIM59抑制SK-MEL-2细胞的增殖
2.3 沉默TRIM59诱导SK-MEL-2细胞周期阻滞
WB 法检测结果(图5A、B)显示,与si-con 组和Normal 组相比,si-TRIM59 组SK-MEL-2 细 胞CCND1、CDK2 蛋白表达显著降低(均P<0.01);流式细胞术检测结果(图5C)显示,si-TRIM59 组SKMEL-2细胞周期阻滞于G2期(P<0.05)。
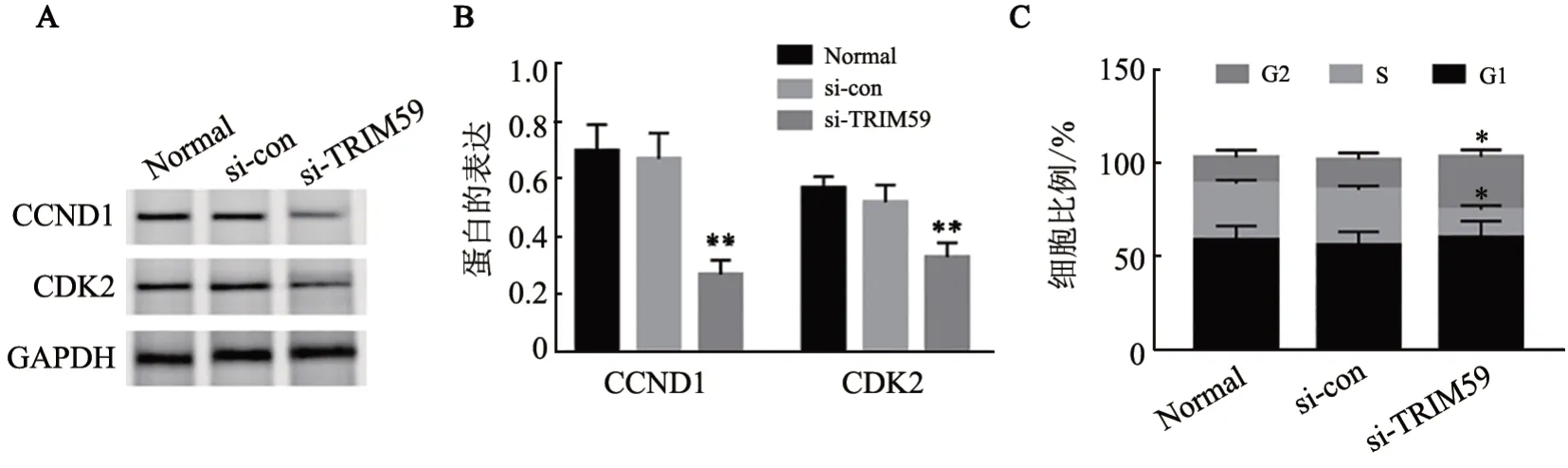
图5 沉默TRIM59诱导SK-MEL-2细胞周期阻滞并抑制CCND1和CDK2表达
2.4 沉默TRIM59促进SK-MEL-2细胞的凋亡
WB 法检测结果(图6A、B)显示,与si-con 组和Normal 组相 比,si-TRIM59 组SK-MEL-2 细 胞TP53蛋白表达显著升高(均P<0.01);流式细胞术检测结果(图6C)显示,si-TRIM59组SK-MEL-2细胞凋亡率较si-con 组和Normal 组显著升高[(13.35±1.87)%vs(5.10±0.78)%、(4.51±1.13)%,P=0.000、F=122.534]。
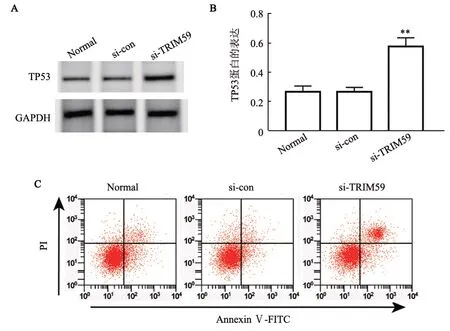
图6 沉默TRIM59促进SK-MEL-2细胞的凋亡与TP53的表达
2.5 沉默TRIM59抑制SK-MEL-2细胞的迁移和侵袭
划痕愈合实验(图7A)、Transwell实验(图7B)检测结果显示,与si-con 组和Normal组相比,si-TRIM59组细胞划痕抑制率显著升高(P<0.01、F=602.589),迁移(P<0.01、F=32.866)和侵袭(P<0.01、F=40.398)细胞数均显著降低。

图7 沉默TRIM59抑制SK-MEL-2细胞的迁移和侵袭
2.6 TRIM59 与BCLAF1 间存在相互作用及其在黑色素瘤患者体内表达的相关性
RBPsuite 预测发现BCLAF1 能够与TRIM59 结合(图8A)。免疫共沉淀实验结果(图8B)显示,TRIM59 与BCLAF1 之间存在相互作用。WB 法(图8C)、qPCR法(表3)检测结果显示,与HEMn-LP细胞相比,SK-MEL-2、UACC903、A375 细胞中BCLAF1的mRNA和蛋白表达均显著升高(均P<0.01)。36例癌组织中TRIM59 与BCLAF1 的表达之间呈明显的正相关(r=0.878,P<0.001,图8D)。利用Starbase 网站(https://starbase.sysu.edu.cn/pan GeneCoExp.php#)分析黑色素瘤患者体内TRIM59 和BCLAF1 表达相关性,结果(图8E)显示,两者呈明显的正相关(r=0.561,P<0.001)。
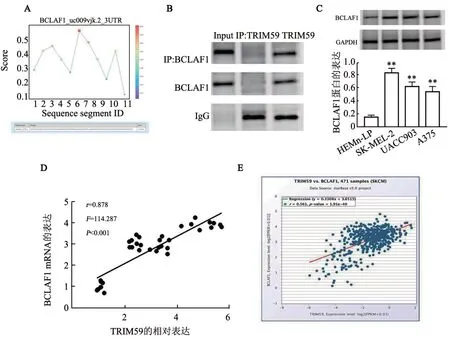
图8 TRIM59与BCLAF1存在互作关系
表3 人皮肤黑色素瘤细胞和黑色素细胞中BCLAF1 mRNA的表达(,n=9)
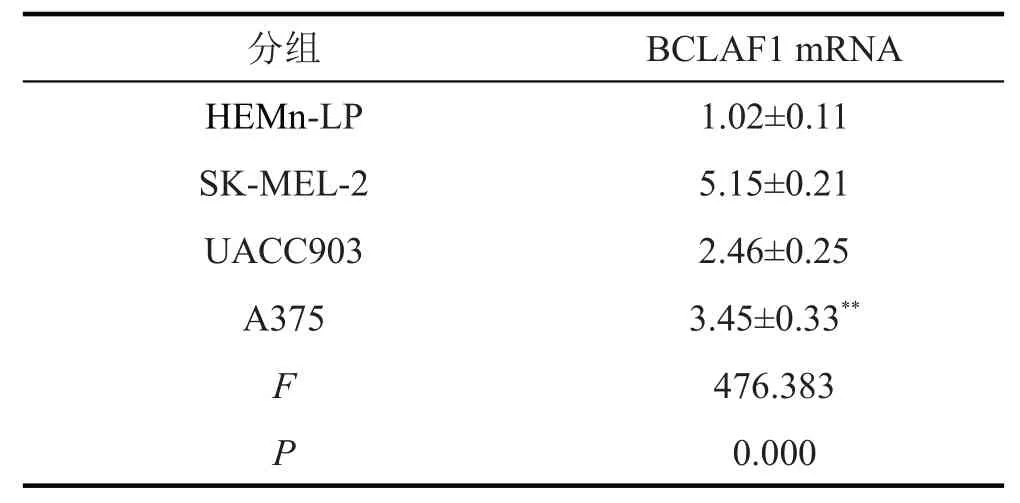
表3 人皮肤黑色素瘤细胞和黑色素细胞中BCLAF1 mRNA的表达(,n=9)
与HEMn-LP细胞比较,*P<0.05,**P<0.05
3 讨论
TRIM59 可能通过介导蛋白质之间的相互作用调节泛素调节蛋白的稳定性,越来越多的研究结果支持TRIM59 具有癌蛋白的功能[8]。TRIM59 参与部分肿瘤的发展,其表达水平在这些癌症中随着病情的恶化而上调[9]。JIN 等[10]对纳入的46 项研究(包括11 558 名患者)进行分析发现,与相邻组织相比,TRIM59 的表达水平在15 种类型的人类实体瘤中的显著上调,TRIM59高表达组患者的总生存率明显低于低表达组患者,并且TRIM59高表达预示着多发性实体瘤预后不良,表明TRIM59有可能被用作人类实体瘤的诊断和预后的标志物。KHATAMIANFAR等[11]发现,TRIM59在肺癌、肾癌等多种肿瘤组织中均表达上调,并与肿瘤发生、发展具有明显的相关性;此外,该研究还通过小鼠全胚胎监测上皮细胞中TRIM59 上调的起源,揭示TRIM59 可作为一种新的多肿瘤标志物用于早期肿瘤的免疫组织化学检测。也有研究[12]发现,TRIM59 在部分肿瘤中的表达异常降低,而进行过表达则有助于肿瘤的控制。因此,为了探究TRIM59在皮肤黑色素瘤中的表达及其功能,本研究检测发现皮肤黑色素瘤细胞中TRIM59 呈高表达,而沉默TRIM59后,SK-MEL-2细胞发生增殖活性降低、G2 期阻滞,同时CCND1、CDK2 表达受到抑制,迁移侵袭能力也降低,凋亡率及TP53表达明显升高。这说明TRIM59 能够促进SK-MEL-2 细胞的恶性细胞表型发展。这与TIAN等[13]的TRIM59增强巨噬细胞的吞噬作用以抑制黑色素瘤生长的实验结果相悖,与TRIM59在实体瘤中的致癌功能相一致。本研究中,免疫共沉淀实验发现,TRIM59 与BCLAF1之间存在互作关系,提示BCLAF1可能与TRIM59在皮肤黑色素瘤细胞中的功能有关。
近年来,越来越多的实验证据表明BCLAF1在肿瘤发展过程中发挥肿瘤促进因子或肿瘤抑制因子的作用,其功能取决于肿瘤微环境及癌症类型[14-15]。BCLAF1在肝癌、白血病、膀胱癌、结肠癌中促进癌细胞恶性表性变化,而在肺癌、骨肉瘤中抑制癌细胞的进一步恶化[16-17]。在肝癌的研究中发现,BCLAF1 的表达水平以HIF-1α 依赖性方式升高,有助于肝癌细胞的增殖,肿瘤的生长及血管的形成[18-20]。本研究发现,BCLAF1 在皮肤黑色素瘤细胞中的表达明显升高,提示BCLAF1可能在黑色素瘤中发挥促癌基因的作用。进一步通过qPCR检测发现,在皮肤黑色素瘤组织中BCLAF1 和TRIM59 表达水平之间呈明显的正相关,并且在Starbase 中分析发现,在皮肤黑色素瘤中BCLAF1 的表达水平随TRIM59的升高而升高,也呈明显的正相关。本研究未进行BCLAF1 在皮肤黑色素瘤细胞及动物模型中的功能探讨,课题组将继续开展相关研究,为BCLAF1用于皮肤黑色素瘤患者的康复提供更充分的实验支持。
综上所述,TRIM59在皮肤黑色素瘤细胞中呈高表达,沉默TRIM59 抑制肿瘤细胞的增殖、迁移和侵袭而促进凋亡,其发挥抗癌作用的潜在机制与TRIM59蛋白结合BCLAF1有关。