TIGIT与CD155在三阴性乳腺癌组织中的表达及其临床意义
张燕,郑梓莹,陈文,杨钰斌,黄种心(福建医科大学附属第二医院.中西医结合肿瘤科;.病理科,福建泉州 362000)
三阴性乳腺癌(triple negative breast cancer,TNBC)占所有乳腺癌的比例为10%~20%,具有侵袭性强、早期复发风险高等特点[1]。目前其治疗仍以化疗为主,尽管已有抗PD-1/PD-L1单抗药物被批准用于治疗转移性或不可切除局晚期TNBC[2-3],但实际获益人群非常有限,多数TNBC患者仍临床预后差,晚期TNBC患者中位OS约12个月,4年生存率低于20%[1]。故寻找新的预后生物标志物及治疗靶点成为临床亟待解决的问题。T 细胞免疫球蛋白和ITIM 结构域蛋白(T cell immunoreceptor with Ig and ITIM domain,TIGIT)是共抑制性免疫受体,其被激活后会抑制免疫细胞活化、增殖并诱导免疫抑制性因子的产生[4-5]。CD155是TIGIT的高亲和力同源配体,在细胞黏附和增殖中起重要作用,其在多种肿瘤中过表达,促进肿瘤增殖、侵袭,导致预后不良[6-9]。TIGIT 与其配体CD155结合后,通过胞内的ITIM结构域传递抑制信号,抑制T细胞和NK 细胞的抗肿瘤反应,导致肿瘤细胞发生免疫逃逸[10]。因此,TIGIT/CD155有望成为肿瘤免疫治疗的新靶点或预测预后的标志物。本研究检测TNBC组织中TIGIT和CD155蛋白的表达并分析其临床意义。
1 资料与方法
1.1 临床资料
收集2014 年1 月至2018 年12 月福建医科大学附属第二医院通过手术切除、术后病理确诊为TNBC的64例女性患者的肿瘤组织。通过医院病历系统收集入组患者的临床病理资料,通过住院、门诊及电话随访等方式随访其生存预后情况。本研究通过福建医科大学附属第二医院伦理委员会审批,伦理审批号:[2022]福医附二伦理审字(12)号。
纳入标准:(1)2014年1月至2018年12月,通过手术切除、术后病理确诊为TNBC的女性患者;(2)确诊前未经过放化疗、内分泌治疗等肿瘤专科治疗;(3)病理蜡块保存完好,病例资料完整可随访;(4)患者依从性好,能够配合研究;(5)患者及家属知情同意。
排除标准:(1)不符合诊断或入选标准;(2)患有不易控制的神经、精神疾病或认知障碍、精神障碍;(3)因自身原因无法完成随访及调查;(4)其他原因不适合入组。
1.2 免疫组化染色法检测TIGIT在TNBC组织中的表达
组织切片脱蜡、水化,PBS冲洗3次,高温抗原修复,PBS 洗3 次,3%过氧化氢封闭内源性过氧化物酶,PBS 洗3 次,加入一抗(抗TIGIT 单 抗,购 自Abcam 公司,货号ab243903,稀释度1∶100;CD155,购自Abcam 公司,货号ab267389,稀释度1∶100)室温下孵育1 h,PBS 洗3 次,滴入增强液,室温下反应20 min,PBS洗3次,加入二抗,室温下反应20 min,PBS洗3次,加入辣根过氧化物酶DAB显色。
1.3 免疫组化染色结果判读
每个组织切片随机选取5个高倍视野观察,综合切片的阳性细胞比例及染色强度计分,行半定量分析[11]。染色强度分为0~3 分:0 分为无染色,1 分为弱染色,2 分为中等染色,3 分为强染色;阳性细胞占细胞数百分比的评分分为0~3 分:阳性细胞率(以整数制计算)≤5%的为0 分,6%~25%为1 分,26%~50%为2 分,≥51%为3 分。以上两者积分相乘得总分,总分0分为阴性染色,1~2分为弱阳性(+),3~4分为阳性(⧺),6~9分为强阳性(⧻)。
1.4 统计学处理
采用SPSS 25.0软件处理数据。TIGIT、CD155与临床病理参数之间的关系采用χ2检验或Fisher's精确检验统计进行分析;生存分析单因素采用Kaplan-Meier生存曲线和Log-Rank检验进行分析,多因素生存分析采用Cox回归分析法检验。所有的检验采用双侧检验法,以P<0.05或P<0.01表示差异具有统计学意义。
2 结果
2.1 TNBC患者临床病理特征
本研究总计入组64例患者,所有病例的临床病理资料完整,入组患者年龄32~78岁,中位年龄49.5岁;绝经前34例、绝经后30例;肿瘤长径≤2 cm者23例,肿瘤长径>2 cm者41例;基于美国癌症联合委员会(AJCC)肿瘤分期手册第八版的TNM分期标准判定肿瘤组织的TNM分期,64例患者中,Ⅰ期15例、Ⅱ期27例、Ⅲ期22例;按照Elston和Ellis标准进行组织学分级:组织学分级Ⅱ级17例、组织学分级Ⅲ级47例;淋巴结转移31例。通过门诊、住院复查及电话随访方式获得患者的无病生存期(disease-free survival,DFS),随访截止时间:2021年12月31日。患者详细资料见表1。
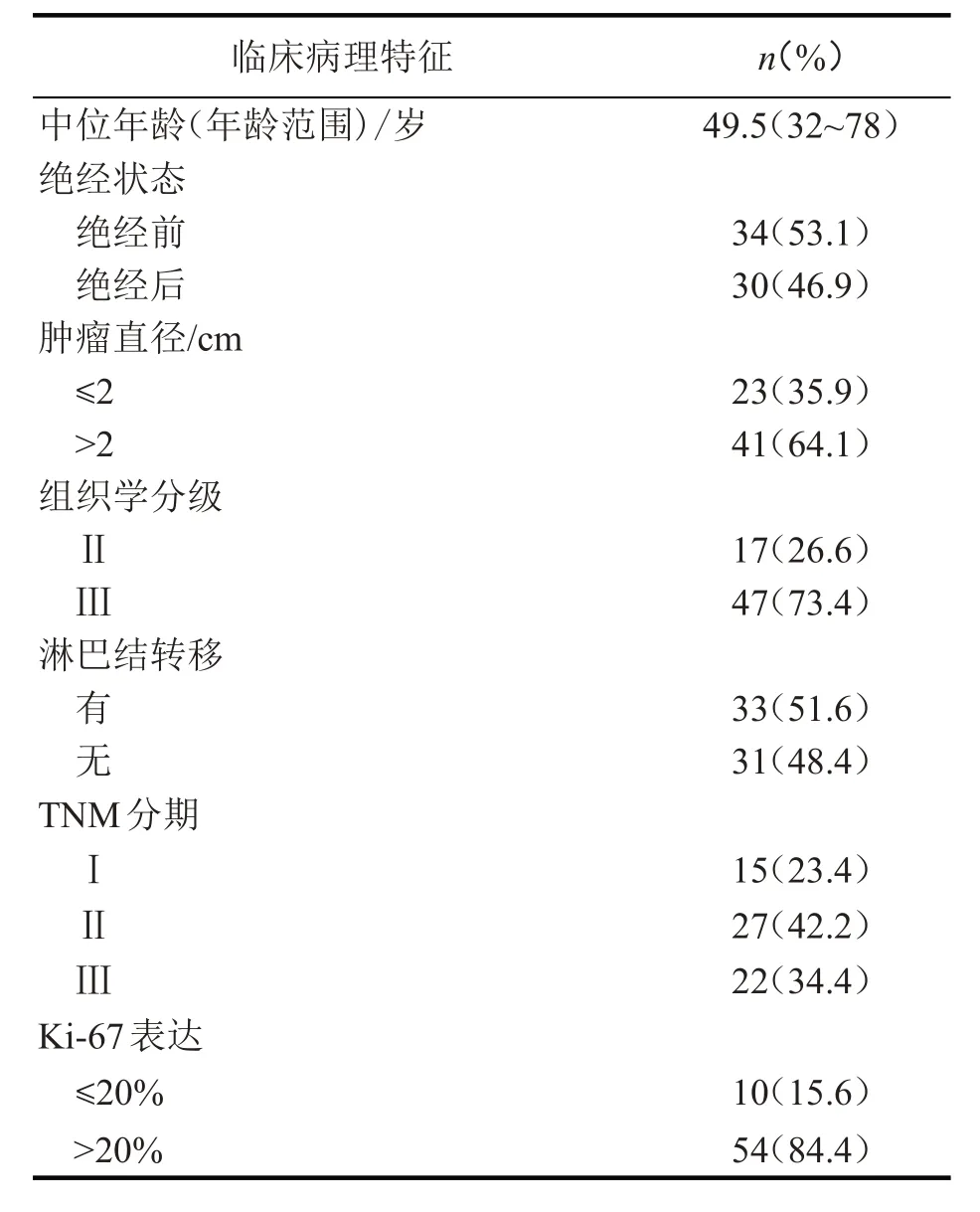
表1 64例患者的临床病理资料(n=64)
2.2 TNBC中TIGIT表达与临床病理参数的相关性
免疫组化染色结果(图1)显示,TIGIT 主要定位于TNBC 实质细胞的细胞膜,64 例TNBC 组织中,TIGIT阳性表达率为48.4%(31/64)。TIGIT表达与肿瘤大小(P<0.05)、淋巴结转移(P<0.01)、肿瘤分期(P<0.01)有关(表2),而与年龄、绝经状态、组织学分级、Ki-67均无关(均P>0.05,表2)。
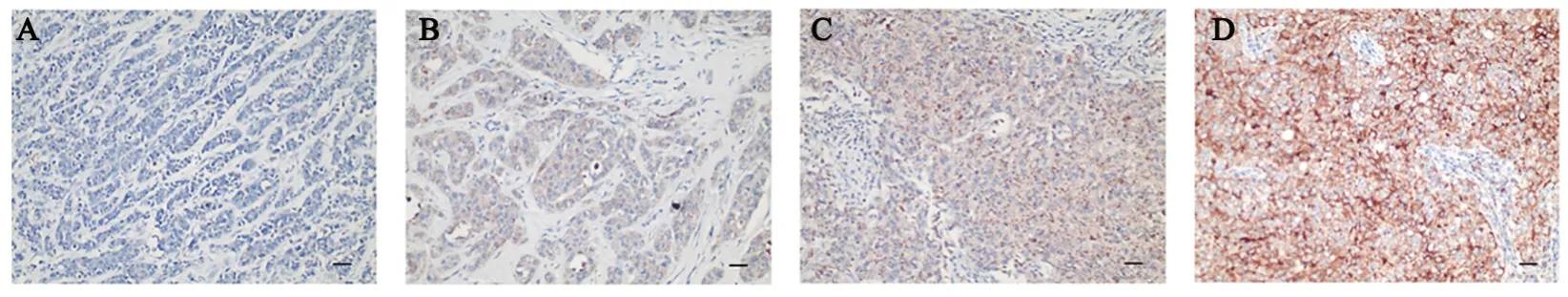
图1 TNBC组织中TIGIT表达(免疫组化染色,×200,标尺:100 μm)
2.3 TNBC中CD155表达与临床病理参数的相关性
免疫组化染色结果(图2)显示,CD155主要表达于TNBC实质细胞的细胞膜及细胞质,64例TNBC组织中,CD155 阳性表达率为79.9%(51/64)。CD155表达与肿瘤大小(P<0.05)、淋巴结转移(P<0.01)、肿瘤分期(P<0.01)相关,与年龄、绝经状态、组织学分级、Ki-67无关(均P>0.05,表2)。

图2 CD155在TNBC组织中的表达(免疫组化染色,×200,标尺:100 μm)
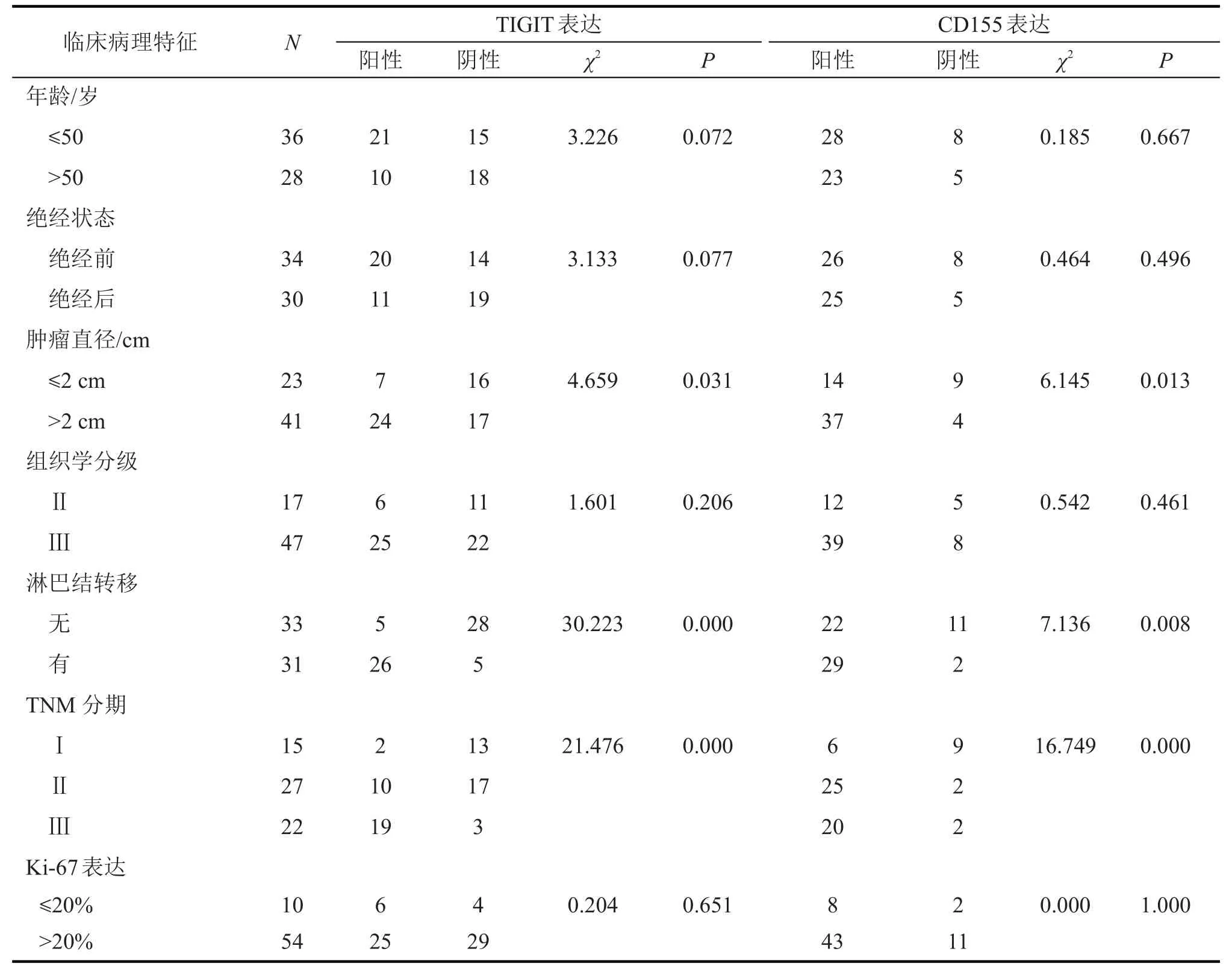
表2 TIGIT和CD155表达与临床病理参数的相关性
2.4 TIGIT、CD155表达与患者DFS的关系
采用Kaplan-Meier 生存曲线和Log-Rank 检验分析TIGIT(图3A)、CD155(图3B)表达与TNBC 患者DFS 的关系,结果显示,TIGIT 阴性患者平均DFS 为41.627 个月(95%CI:35.920~47.333),TIGIT 阳性患者的平 均DFS 为20.400 个 月(95%CI:15.289~25.511),TIGIT 阳性患者DFS 低于TIGIT 阴性患者(χ2=18.128,P<0.01)。
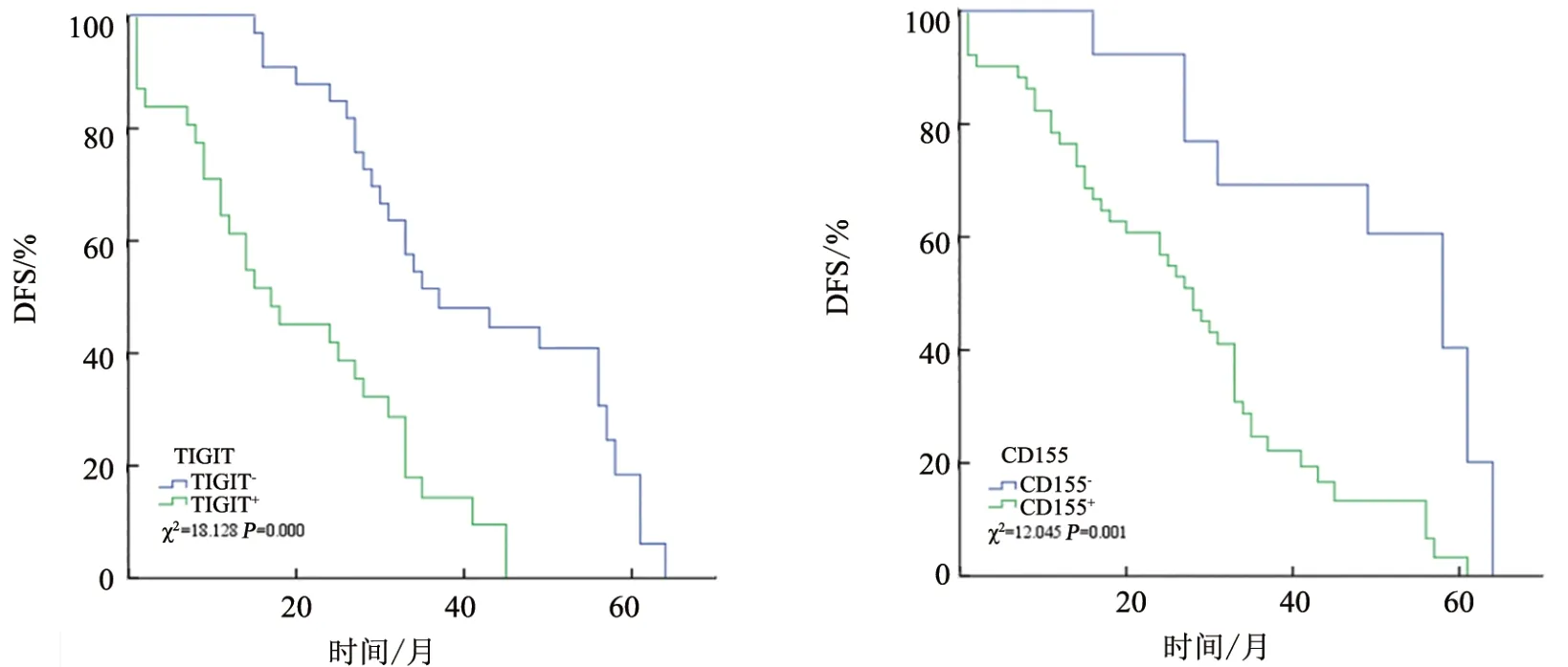
图3 TIGIT(A)、CD155(B)表达水平与TNBC患者DFS的关系(生存曲线图)
生存分析显示,CD155 阴性患者平均DFS 为48.962 月(95%CI:39.215~58.708),CD155 阳性患者的平均DFS 为27.241 月(95%CI:22.484~31.999),差异具有统计学意义(χ2=12.045,P<0.01),表明CD155阳性患者DFS低于CD155阴性患者。
2.5 影响TNBC患者DFS的单因素及多因素分析
采用Cox 回归对TNBC 患者DFS 进行单因素和多因素分析。单因素分析发现,入组患者的DFS 与肿瘤大小、淋巴结转移、TNM 分期及肿瘤TIGIT 和CD155 的表达相关(均P<0.01,表3)。将以上5 项具有统计学意义的指标纳入Cox 多因素分析,结果显示:仅肿瘤TNM 分期为TNBC 患者的独立预后危险因素(HR=4.751,95%CI:1.982~11.388,P<0.01)。

表3 影响TNBC患者预后的单因素和多因素分析
3 讨论
TIGIT是Ⅰ型穿膜蛋白,由一个胞外免疫球蛋白可变区、一个Ⅰ型穿膜区和一个短胞内区组成,其中含有一个ITIM和一个ITT样基序[12]。目前TIGIT对免疫细胞的调节包括胞内和胞外机制[13-14]。TIGIT对NK细胞有直接抑制作用,主要表现在TIGIT可以降低NK细胞分泌IFN-γ的能力并抑制CD226的激活和NK细胞毒性作用[12]。TIGIT与CD226竞争性结合CD155,一方面抑制CD226的激活,导致CD226发生去磷酸化来抑制T细胞的抗肿瘤免疫反应[15]。另一方面,ITT基序被磷酸化并与生长因子受体结合蛋白2(growth factor receptorbound protein 2,Grb2)结合,随后招募含SH2结构域的肌醇磷酸酶-1(SHIP-1)到TIGIT的细胞质尾部,抑制PI3K、MAPK和NF-κB信号通路,继而导致NK细胞毒性减弱和细胞因子分泌减少[16-17]。TIGIT对T细胞也有直接抑制作用,在效应性T细胞中,TIGIT可直接抑制T细胞的活化和增殖,从而限制效应性T细胞的功能,减少细胞因子的产生,发挥抑制作用。在胞外,TIGIT与DC表面的CD155相互作用会间接抑制T细胞免疫反应。TIGIT与CD155结合诱导产生耐受性DC,其抗原提呈功能受到抑制、共刺激分子表达减少、免疫抑制因子IL-10分泌增多、促炎细胞因子IL-12的产生减少,从而抑制T细胞的激活、增殖与活化[18]。TIGIT还通过增强和调节Treg细胞的抑制功能来间接抑制免疫反应。TIGIT+Treg细胞可上调多个Treg细胞标志物的表达,包括FOXP3、IKZF2、CTLA-4、PD-1和LAG-3。TIGIT+Treg细胞也能抑制促炎性Th1和Th17型免疫反应的能力,但不能抑制Th2型免疫反应,因此TIGIT+Treg有效抑制了效应性T细胞的激活和增殖[19-20]。
研究证实,TIGIT表达上调与多种肿瘤的不良临床结局有关,包括肝癌[7]、黑色素瘤[21]、急性髓细胞白血病[22]、子宫内膜癌[23]、结直肠癌[24]。王伟杰等[24]研究发现,结直肠癌组织中TIGIT的阳性表达率显著高于癌旁组织,其表达与肿瘤分化程度、病理分期及淋巴结转移具有相关性;DUAN[7]等在肝细胞癌中的研究发现,癌组织中TIGIT表达水平随着肿瘤分化程度由高到低逐渐上调,且与AFP 水平呈现正相关。基于TIGIT在抗肿瘤免疫中的重要作用,已有多项临床前及临床研究证实靶向TIGIT 免疫治疗的有效性[14]。Ⅱ期临床研究CITYSCAPE 的结果[25]证实,新型抗TIGIT抗体 tiragolumab联合PD-L1 抑制剂atezolizumab 对比安慰剂联合atezolizumab 显著提高PD-L1 阳性NSCLC 患者的ORR 和PFS,而不良反应并未加重。晚期实体肿瘤患者的Ⅰ期研究(NCT02964013)评估了剂量递增的抗TIGIT 抗体vibostolimab 单一疗法或联合PD-1 抑制剂pembrolizumab 的安全性和有效性,结果发现,接受vibostolimab 联合pembrolizumab 治疗的人群ORR 为26%、疾病控制率达到51%,显示出良好的耐受性和抗肿瘤活性[26]。此外,多个人源性抗TIGIT单抗正在进行单一疗法或联合抗PD-1/PD-L1/CTLA-4/LAG-3抗体免疫治疗的临床研究,涉及肺癌、多发性骨髓瘤、食管癌、黑色素瘤等多个瘤种,提示抗TIGIT在抗肿瘤治疗中的广阔前景[5]。
近年来关于CD155 与肿瘤的研究越来越多。CD155 可通过ITIM 结构域募集蛋白酪氨酸磷酸酶SHP-2 以启动信号转导、细胞黏附、运动、增殖和存活,对肿瘤的发生、发展起着至关重要的作用。CD155 也参与肿瘤免疫反应,其在肿瘤细胞上表达并与肿瘤浸润淋巴细胞上的CD96、CD226 和TIGIT相互作用,在肿瘤细胞免疫监视、免疫逃逸以及调节免疫细胞杀伤肿瘤细胞等诸多方面中扮演着重要角色[10]。CD155 与TIGIT 的结合能力最高,与CD96 的结合能力次之,与CD226 的结合能力最低。研究[6-9]表明,CD155 在多种人类恶性肿瘤中表达上调并与肿瘤的侵袭和迁移能力有关。目前关于乳腺癌中CD155 表达的报道较少。既有研究[27-29]显示,乳腺癌患者(所有亚型)的CD155 表达率从38.1%到52.3%不等,CD155 阳性表达患者可能显示出以下特征:Ki-67 显著升高、TIL 丰富、肿瘤分期晚、伴随淋巴结转移及存在浸润性NK 细胞和巨噬细胞。CD155 表达对乳腺癌预后的影响尚未明确,研究[27,29]发现,CD155 过表达患者具有较差的OS,另一项研究[28]则认为乳腺癌胞膜CD155 高表达和NK-TIL 预示着较好的预后。YOSHIKAWA 等[30]则认为CD155 表达与生存预后无相关性。
肿瘤免疫治疗是继手术、放疗、化疗之后的重要治疗方法。靶向CTLA-4、PD-1、PD-L1 的单克隆抗体在多种恶性肿瘤中显示出良好的治疗效果。尽管TNBC对免疫治疗的反应率高于其他亚型,但总体有效率仍较低,未经选择的TNBC患者单药免疫治疗有效率仅5%,PD-L1 阳性患者约为23%[3],仍有相当多患者无法从目前免疫治疗中受益,故探索新的免疫检查点及潜在治疗靶点对于临床十分必要。本研究发现,新型免疫检查点分子TIGIT和CD155在TNBC组织中高表达,且两者表达均与肿瘤大小、淋巴结转移、肿瘤分期显著相关。生存分析显示两者表达均与较差的DFS 相关,提示TIGIT/CD155 在TNBC 微环境中发挥免疫抑制作用,可能成为TNBC治疗的新靶点。TIGIT/CD155对TNBC的免疫抑制机制如何,TIGIT 表达与PD-L1 表达是否具有相关性,抗TIGIT抑制剂联合抗PD-L1 抑制剂能否在TNBC 中发挥协同抗肿瘤作用,均需要更多研究进一步明确。