过表达lncRNA MIR17HG 促进宫颈癌HeLa 细胞的恶性生物学行为与裸鼠移植瘤生长
邓幻苏,刘元斌(.天津医科大学中新生态城医院 妇产科,天津 3 000467;.山东大学齐鲁医院 检验科,山东济南 500)
宫颈癌是女性最常见的恶性肿瘤之一,其发病率和病死率居女性肿瘤第四位[1]。据统计,每年约有50万宫颈癌新发病例,主要发生在发展中国家[2]。在中国,每年新增病例数约占世界总数的三分之一[3]。虽然近年来人乳头瘤病毒(HPV)DNA检测的发展和放化疗技术的标准化应用在一定程度上降低了宫颈癌的发病率和病死率,但宫颈癌的复发率仍高达40%,病死率在发展中国家高达87%[4-5]。因此,探索宫颈癌发生和发展的分子机制并寻找潜在的预后和靶向治疗指标是当务之急。长链非编码RNA(lncRNA)通常是指长度超过200个核苷酸的RNA转录物,不具有蛋白质编码功能[6]。MIR17HG 基因是MIR17-92 簇的宿主基因,该基因簇至少包含6 种可能参与细胞存活、增殖、分化和血管生成的微小RNA(miRNA)[7-8]。MIR17HG 在多种肿瘤组织中呈高表达,包括结直肠癌[9]、胶质瘤[10]、肝癌[11]和食管癌[12],起着促进肿瘤发生发展的作用。但MIR17HG 基因在宫颈癌中的作用及分子机制尚不明确。因此,本研究主要探讨MIR17HG基因在宫颈癌中的表达水平、其对宫颈癌细胞的作用及其机制,分析其与临床资料的相关性,旨在为宫颈癌的诊断和治疗提供新的参考依据。
1 资料和方法
1.1 临床资料标本来源
选取2019 年8 月至2020 年12 月在山东大学齐鲁医院接受宫颈锥切术的30例宫颈癌患者的癌组织及其癌旁组织。所用样本均经组织病理学检查确诊。所有患者术前未接受放疗、化疗及生物治疗。本次研究获得患者及其家属的知情同意,并报医院伦理委员会批准[审批号:KYLL-2022(ZM)-127]。
1.2 细胞株及主要试剂
人正常宫颈上皮End1/E6E7细胞、人乳腺癌细胞HeLa、C33A、CasKi 和SiHa 均购自天津中原公司(ATCC 一级代理商),TRIM25、PTEN、p-AKT、AKT、p-S6K 和GAPDH 蛋白抗体均购自Abclonal 公司。MIR17HG 过表达质粒和敲降质粒shR-MIR17HG 及各自的对照质粒均购自锐博生物科技有限公司,TRIzol 试剂购自Thermo 公司,逆转录试剂盒、qPCR相关缓冲液及CCK-8试剂盒均购自碧云天生物技术公司,PCR 引物购自金唯智公司,RPMI 1640 培养基购自Life公司,胎牛血清购自BI公司,Transwell小室购自密理博公司。
1.3 qPCR法检测宫颈癌组织和细胞中MIR17HG的表达水平
采用TRIzol 法提取样本组织及细胞中总RNA,按照说明书使用逆转录试剂盒进行逆转录反应,然后进行qPCR 实验,PCR 反应条件:4 ℃预变性4 min,94 ℃30 s、58 ℃30 s、72 ℃30 s 进行32 次循环,72 ℃延伸5 min,最后4 ℃冷却。所用qPCR引物序列见表1。
1.4 CCK-8法检测MIR17HG对HeLa细胞增殖的影响
取接种有3×103个HeLa 细胞(100 μL)的96 孔细胞培养板,采用脂质体2000将过表达质粒MIR17HG或敲降质粒shR-MIR17HG及相应的对照质粒分别转染HeLa细胞,4 h后换为正常培养液,培养48、72 h后向每孔加入10µL CCK-8溶液,37 ℃反应1 h,用酶联免疫检测仪读取每孔450 nm处光密度(D)值,以D值代表细胞增殖水平并绘制细胞生长曲线。
1.5 克隆形成实验检测MIR17HG对HeLa细胞集落形成能力的影响
在接种有HeLa细胞的12孔板中,用脂质体2000转染MIR17HG 或者shR-MIR17HG 及对照质粒24 h后,用0.05%胰酶消化细胞,用移液器将细胞吹打成单个细胞悬液并计数,以适当的细胞密度接种于培养皿中,每孔300个细胞,使细胞均匀分布于板底,放入培养箱中连续培养,每3 d 更换1 次培养液。待两周左右至出现肉眼可见集落时,弃去原培养液,PBS洗涤1次后加10%甲醛固定30 min,用PBS洗3次后,用结晶紫染色10 min,PBS洗净后晾干、拍照并计数集落。
1.6 Transwell实验检测MIR17HG对HeLa细胞迁移和侵袭能力的影响
将MIR17HG 过表达或敲降质粒及对照载体转染HeLa细胞24 h后,用0.05%的胰酶消化细胞,于无血清培养基中重悬细胞后计数板计数,将含4×105/mL HeLa 细胞的180 µL 细胞悬液加入铺有人工基膜(metrigel)(迁移实验不加人工基膜)的上室中,下室中加入600µL含20%胎牛血清的培养基,每组设置3 个复孔,于37 ℃、5% CO2条件下培养48 h。取出Transwell 小室,用棉签擦掉人工基膜及上室未穿膜的HeLa细胞,4%多聚甲醛固定10 min,用0.1%结晶紫染色10 min。用显微镜随机选取5 个视野计数穿膜细胞,计算细胞迁移率、侵袭率。
1.7 WB 法检测MIR17HG 对HeLa 细胞中TRIM25及信号通路相关蛋白表达的影响
将转染了MIR17HG 过表达质粒及对照Control质粒的HeLa细胞正常培养48 h,用1 ml PBS清洗后,用RIPA(购自碧云天公司)裂解液裂解细胞。裂解后的细胞加入上样缓冲液煮沸,行WB 实验检测TRIM25、PTEN、p-AKT、AKT、p-S6K、GAPDH 蛋白表达水平。蛋白转膜、显影后进行拍照,GraphPad作图并分析蛋白的相对表达量数据。
1.8 生物信息学分析
宫颈癌组织和癌旁组织中MIR17HG及TRIM25的表达水平及其在临床资料中的相关关系采用UALCAN 在线工具(http://ualcan.path.uab.edu/)进行分析;MIR17HG 及TRIM25 的相关关系采用ENCORI 工具(http://starbase.sysu.edu.cn/)进行分析;患者的预后分析采用Kaplan-Meier Plotter 工具(http://kmplot.com/analysis/)进行分析。
1.9 EGFP报告载体构建
退火:两条寡核苷酸片段在退火缓冲液中95 ℃变性5 min,每min 下降1 ℃直到温度达到25 ℃,作为与pMIR-REPORT荧光素酶载体连接的插入片段。退火体系:互补寡核苷酸片段各0.5µL,11.5µL退火Buffer,寡核苷酸终浓度2 ng/µL。目的基因片段保存于4 ℃备用。pMIR-REPORT 萤光素酶连接载体制备:采用E.coliDH5a 扩增EGFP 质粒,抽提质粒后行限制性内切酶HindⅢ和SpeⅠ双酶切。双酶切体系:质粒30 µL、DDW 4 µL、HindⅢ酶1 µL、SpeⅠ酶1 µL,10×缓冲液4 µL,置于低温连接仪37 ℃金属浴中反应24 h;靶基因的连接体系:目的基因4µL,连接载体0.2µL,2×连接缓冲液5µL,双蒸水0.8µL,16 ℃金属浴中反应16 h。
1.10 构建HeLa细胞裸鼠移植瘤
6-8 周龄的BALB/c Nude 鼠(以下简称裸鼠),雌性,体质量8~12 g,购自北京维通利华实验动物技术有限公司,饲养在无特异性病原菌(specific pathogen free,SPF)、恒温(20~26 ℃)、恒湿(45%~50%)的洁净环境中。将裸鼠按照过表达MIR17HG 和对照组Control 2 个组。常规培养、传代的MIR17HG 过表达组和对照组(Control 组)HeLa 细胞悬液裸鼠腋窝皮下接种,每只注射1×107/ml细胞0.1 ml。肿瘤体积,肿瘤生长期内每3天测量体积1次,瘤体积近似计算方法:短径2×长径/2。
1.11 统计学处理
2 结果
2.1 TCGA分析MIR17HG的表达水平及其临床意义
TCGA 数据库分析结果(图1A)发现,MIR17HG在宫颈癌组织中呈高表达(P<0.05)。TCGA 数据库分析结果(图1B)发现,在宫颈癌组织中MIR17HG的表达水平随着分期的恶性程度增高而增高(P<0.05)。TCGA 数据库分析结果发现,MIR17HG 的表达水平与患者所在地域(图1C)、体重(图1D)、年龄(图1E)和临床分型(图1F)不存在相关关系。
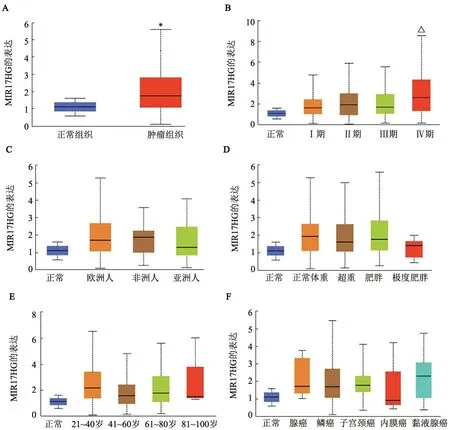
图1 TCGA数据库分析MIR17HG在宫颈癌组织中的表达水平及其与临床特征之间的相关性
2.2 MIR17HG在宫颈癌组织及细胞中呈高表达
qPCR 检测结果(图2A)显示,宫颈癌癌组织中MIR17HG 的表达水平明显高于其配对的癌旁组织(P<0.05)。qPCR 检测结果(图2B)显示,与End1/E6E7细胞相比,MIR17HG在宫颈癌细胞系(CasKi、C33A、SiHa、HeLa)中呈高表达(P<0.01 或P<0.001),且在HeLa 细胞中具有最高的表达丰度。因此选取HeLa细胞作为后续实验的工具细胞。
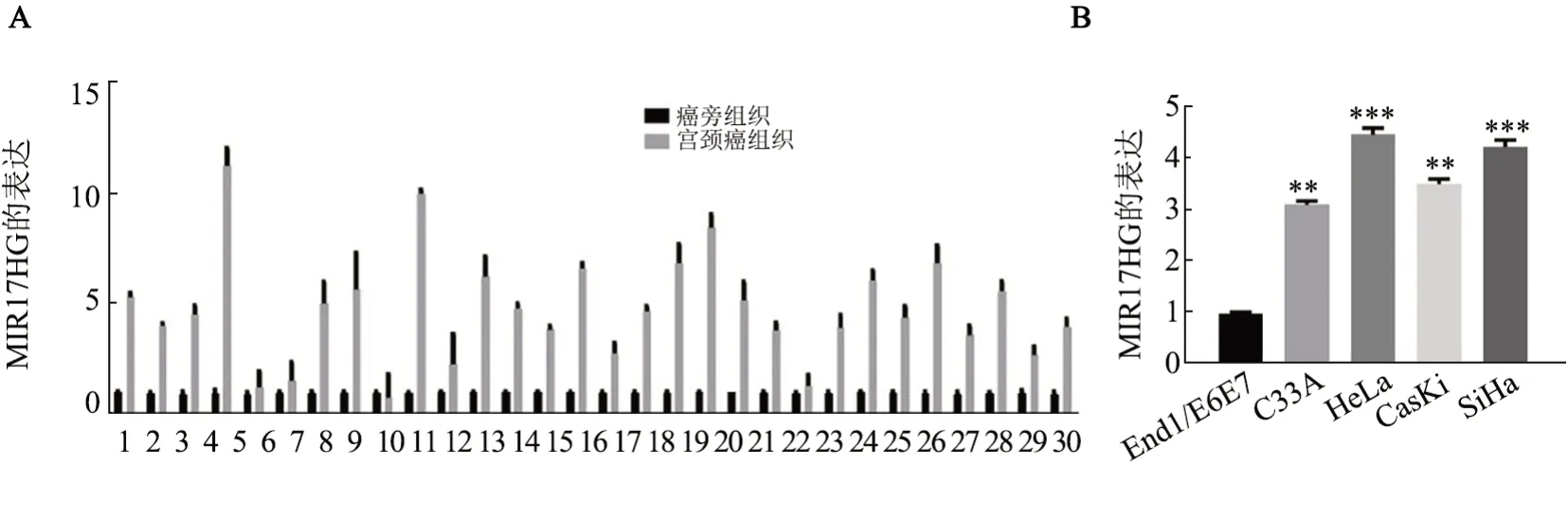
图2 MIR17HG在宫颈癌组织及细胞中的表达水平
2.3 过表达MIR17HG促进HeLa细胞的增殖和迁移侵袭能力
CCK-8 实验和克隆形成实验结果(图3A、B)显示,MIR17HG过表达组HeLa的细胞活性及克隆形成能力均显著高于对照组,而MIR17HG 敲降组细胞活性及克隆形成能力均显著低于对照组(P<0.05或P<0.01)。Transwell 迁移和侵袭实验结果(图3C、D)显示,与相应的对照组相比,MIR17HG 过表达组HeLa 细胞迁移和侵袭能力均显著升高,而MIR17HG敲降组细胞的迁移和侵袭能力则显著降低(P<0.05或P<0.001)。
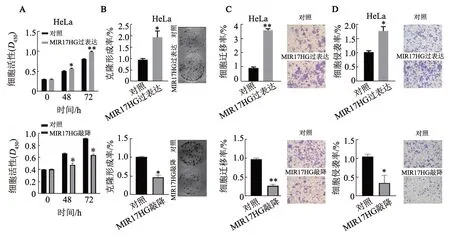
图3 MIR17HG促进HeLa细胞的增殖、迁移和侵袭
2.4 MIR17HG 通 过miR-377 调 控HeLa 细胞中TRIM25的表达
ENCORI 生物信息学预测软件预测结果显示,MIR17HG 与很多个基因存在潜在的相互作用(图4A),且MIR17HG 的表达与TRIM25 的表达呈正相关关系(图4B)。qPCR 检测结果(图4C)显示,MIR17HG 过表达组HeLa 细胞中TRIM25 mRNA 水平较对照组明显上调(P<0.01),而MIR17HG 敲降组细胞TRIM25 mRNA 水平较对照组明显下调(P<0.001)。WB 法检测结果(图4D)显示,过表达MIR17HG 后TRIM25 蛋白水平上调,而敲降MIR17HG 后TRIM25 蛋白水平下调。已有文献[10]报道MIR17HG能够在胶质瘤中结合并下调miR-377的表达,本课题组采用Targetscan 预测miR-377 的潜在靶基因是TRIM25(图4E)。EGFP 报告载体实验结果表明miR-377 能够显著下调EGFP 的荧光活性(图4F)。过表达MIR17HG 上调TRIM25 mRNA 水平,而共表达MIR17HG 和miR-377 可以挽救MIR17HG介导的TRIM25 mRNA水平的上调(图4G)。
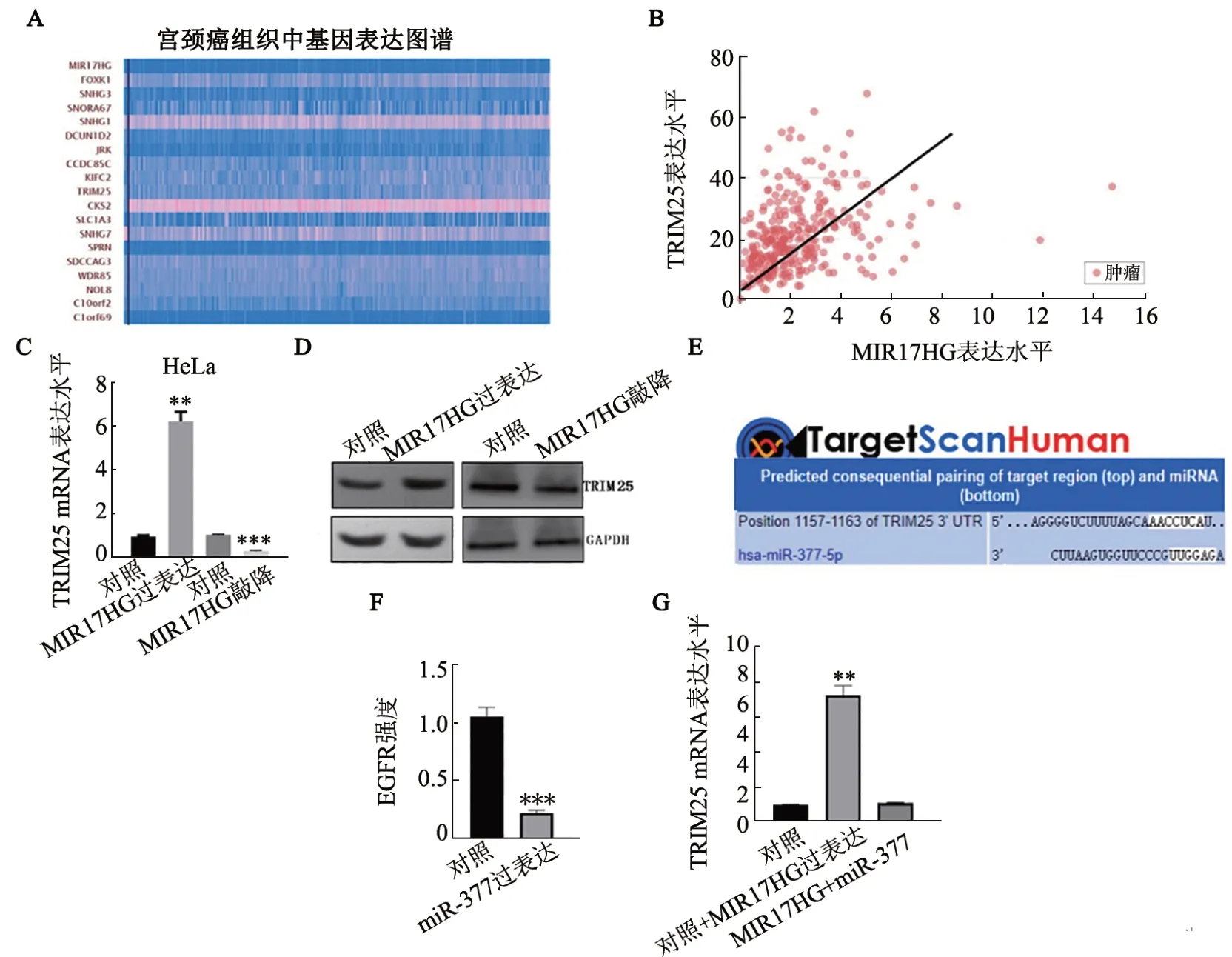
图4 MIR17HG通过miR-377上调TRIM25
2.5 TRIM25在宫颈癌组织中高表达,且其表达水平与患者分期呈正相关
TCGA 数据库分析结果显示,TRIM25 在宫颈癌组织中呈高表达(P<0.05,图5A),其表达水平在宫颈癌组织中有随着分期的恶性程度增高而增高的趋势(图5B),TRIM25的表达水平与患者的地域(图5C)、体重(图5D)、年龄(图5E)和临床分级(图5F)不存在相关关系。
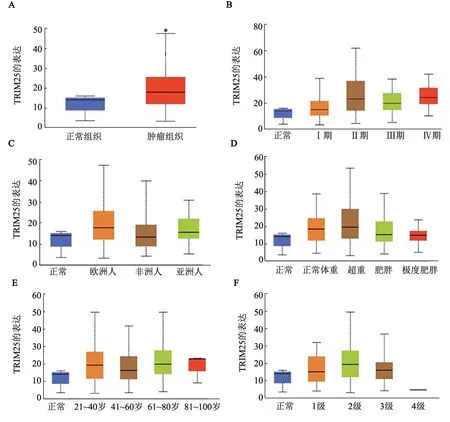
图5 TCGA数据库分析TRIM25的宫颈癌患者中的表达水平
2.6 高表达MIR17HG 及TRIM25 的宫颈癌患者预后不良
Kaplan-Meier Plotter 分析发现,MIR17HG 高表达组的宫颈癌患者的生存期明显低于MIR17HG 低表达组肿瘤患者(P<0.05,图6A),TRIM25 高表达组的宫颈癌患者的生存期明显低于TRIM25 低表达组肿瘤患者(P<0.05,图6B)。

图6 Kaplan-Meier Plotter分析MIR17HG和TRIM25表达水平与宫颈癌患者预后的关系
2.7 MIR17HG 调控PTEN-AKT 信号通路及裸鼠移植瘤生长
WB检测结果(图7A)显示,过表达MIR17HG组HeLa 细胞中PTEN 蛋白表达水平较对照组有所降低,而AKT和S6K蛋白的磷酸化水平有所上调;敲降MIR17HG 组PTEN 蛋白表达水平则高于对照组,而AKT和S6K蛋白的磷酸化水平下调。移植瘤实验结果显示,MIR17HG过表达组裸鼠移植瘤的大小(7B)和生长能力(7C)均高于对照组(P<0.05)。

图7 MIR17HG可能通过调控PTEN-AKT信号通路促进HeLa细胞裸鼠移植瘤生长
3 讨论
目前,很多研究[13-15]报道,lncRNA参与了宫颈癌的发生发展。MIR17HG的表达水平在肝转移患者中显著升高,高MIR17HG 表达预示着生存率低[9]。MIR17HG 作为ceRNA 通过miR-138-5p 调节HK1 表达,导致CRC 细胞中的糖酵解并促进其侵袭和肝转移。有趣的是,通过糖酵解积累的乳酸激活了p38/Elk-1 信号通路,促进了CRC 细胞中MIR17HG 的转录表达,形成了一个正反馈回路,最终导致了持续的糖酵解和CRC 细胞的侵袭和肝转移[9]。另外,MIR17HG在胶质瘤中上调,参与促进胶质瘤的增殖、迁移和侵袭。MIR17HG 分别与miR-153 和miR-377结合,并负调控它们介导FOXR2 表达的能力[10]。MENG等[16]报道称MIR17HG在体外促进了骨肉瘤细胞的增殖、侵袭和顺铂耐药性,而MIR17HG 敲低抑制了体内骨肉瘤移植的生长。MIR17HG 通过SP1/MIR17HG/miR-130a-3p/SP1 反馈回路在骨肉瘤进展中发挥促进作用。
但是,MIR17HG 的异常表达是否与宫颈癌的发生发展有关还未可知。本研究发现,MIR17HG 的表达水平在宫颈癌组织和细胞中都是上调的,其表达水平与宫颈癌的恶性程度呈正相关;并且TCGA数据库分析MIR17HG的表达水平发现,其在宫颈癌中的表达水平也是上调的,这与本研究的检测结果相一致。另外,本研究发现,过表达MIR17HG 能够促进HeLa 细胞的增殖、迁移和侵袭能力。根据上述已经发表的文献内容并结合本实验结果,推测HOPX基因能够作为促癌因子在很多肿瘤的发生发展中起重要的调控作用。
TRIM25 是TRIM 家族的成员之一,是由一个N末端三方基序(或基序RBCC)和C端SPRY结构域构成,在多个依赖于RNA 的通路中起到非常重要的作用[17]。TRIM25在包含结直肠癌[18],肺癌[19]和乳腺癌[20]等在内的多种癌症中是高表达的。本研究发现,TRIM25在宫颈癌组织中呈高表达,且其表达水平与患者肿瘤分期呈正相关。MIR17HG 能够上调TRIM25表达,高表达MIR17HG及TRIM25的宫颈癌患者预后不良。HE等[21]报道,TRIM25通过K63连接的多泛素化抑制非小细胞肺癌中的PTEN 来激活AKT/mTOR信号通路。因此,推测MIR17HG可能会调控AKT信号通路。实验结果显示,MIR17HG能够显著抑制PTEN 蛋白表达水平,并显著上调AKT 和S6K蛋白的磷酸化水平。
总之,MIR17HG通过miR-377调控TRIM25表达发挥促癌基因的作用。MIR17HG通过调控PTEN-AKT信号通路在宫颈癌的发生发展中发挥重要的作用。
——一道江苏高考题的奥秘解读和拓展