miR-124通过调节Jagged1/Notch信号通路影响肾细胞癌OS-RC-2细胞的恶性生物学行为
张炜,胡志,付桥,孙伟,徐律,褚浩,王潇,张志超(武汉市第三医院 泌尿外科,湖北 武汉 430074)
肾细胞癌(renal cell carcinoma,RCC)是肾原发肿瘤的主要类型[1],在泌尿系统肿瘤中其发病率较高[2]。由于放化疗效果不理想,手术切除是RCC的主要治疗方法,但其术后复发率高达20%~40%[3]。因此,全面了解肿瘤进展的潜在分子机制有助于寻找RCC诊断和治疗的新模式。微小RNA(microRNA,miRNA)及其靶基因在细胞发育、增殖、凋亡、迁移和侵袭等许多生物学过程中发挥着重要作用。其中miR-124在肝癌[4]和RCC[5]等多种癌症细胞中均表达下调。在RCC 中,miR-124的低表达与RCC 的组织学分级、临床分期及淋巴结转移有关[6]。此外,miR-124也被证实能够通过靶向HDAC4 抑制RCC 细胞的自噬而增强顺铂敏感性[7]。Jagged1(JAG1)作为Notch配体,广泛表达于哺乳动物的多个组织和发育阶段,可间接激活Notch信号通路。JAG1/Notch通路可激活多种致癌因子,调节多种细胞功能[8]。本课题组利用生物信息学软件预测miR-124与JAG1之间可能存在靶向关系,由此推测miR-124对RCC的抑制作用可能与JAG1有关。为此,本研究通过上调miR-124 表达,观察其对RCC 恶性生物学行为的影响,并进一步探讨其与JAG1/Notch通路的调控关系。
1 材料与方法
1.1 临床资料
收集2018 年6 月至2021 年10 月在武汉市第三医院行根治性手术治疗的38 例RCC 患者的RCC 组织和癌旁组织(距离肿瘤边缘4 cm处取材)标本。手术切除后,样本立即被冷冻在液氮中,并在-80℃保存以供分析。所有组织标本均用福尔马林固定,石蜡包埋。纳入标准:(1)所有患者在手术前均未接受过任何形式的辅助治疗;(2)经2017第8版国际抗癌联盟标准诊断为RCC;(3)签署知情同意书。排除标准:术前曾接受放疗、化疗、免疫治疗的患者。
38例患者根据2005国际泌尿病理协会的诊断标准划分:1级11例、2级13例、3级8例、4级6例。本研究获武汉市第三医院伦理委员会批准(批号:2018-0419)。
1.2 细胞与试剂及仪器
RCC 细胞(Caki-2、A498、ACHN、786-O、OS-RC-2)和人正常肾细胞(293T)均购自北纳生物公司。RPMI 1640培养基、胎牛血清购自武汉尚恩生物技术有限公司,青霉素-链霉素购自上海源叶生物科技有限公司,miR-124 mimic、NC mimic、miR-124 inhibitor、NC inhibitor、pcDNA 和pc-JAG1 均购自上海GenePharma 有限公司,Lipofectamine 2000 试剂盒购自北京诺为生物技术有限公司,TRIzol、SYBR Green ⅠPCR Master Mix 购自北京优尼康生物科技有限公司,miRNeasy Mini Kit 购自杭州沃森生物技术有限公司,双荧光素酶报告基因检测试剂盒、MTT试剂盒均购自北京百奥莱博科技有限公司,兔源一抗JAG1、cleaved caspase-3、BAX、Bcl2、NICD、HES1、HES5、GAPDH 单抗及辣根过氧化物酶标记羊抗兔IgG二抗均购自美国Abcam公司。Nanodrop 2000微量紫外分光光度计购自深圳市瑞盛科技有限公司,ABI PRISM 7500 real-time PCR System 购自上海智岩科学仪器有限公司,Bio-rad Gel Dol EZ 成像仪购自上海艾研生物科技有限公司仪器部;多功能酶标仪购自珀金埃尔默企业管理(上海)有限公司,Transwell 小室购自上海未熹生物科技有限公司,Annexin Ⅴ凋亡检测试剂盒购自上海生工生物公司,流式细胞仪购自碧迪医疗器械(上海)有限公司。
1.3 免疫组化法检测JAG1在RCC组织中的表达
免疫组化采用标准技术进行。4 μm石蜡包埋组织切片在二甲苯中脱蜡,在分级醇中再水化。室温下加入3%过氧化氢反应5 min,内源性过氧化物酶被阻断。蒸馏水冲洗后,将组织切片放入10 mmol/L柠檬酸缓冲液(pH=6.0)中煮沸10 min,完成抗原回收。用5%~10%正常山羊血清反应30 min,进行非特异性蛋白结合。这些治疗与PBS冲洗交替进行。用JAG1多克隆抗体(1∶500)在室温下处理1 h后用PBS漂洗5 min,重复3 次,加入辣根过氧化物酶偶联二抗(1∶1 000)反应10 min,再用PBS 漂洗5 min,重复3次,用3,3-二氨基联苯胺染色,用苏木精复染,然后进行透明和封片处理。最后在显微镜下观察JAG1的表达情况。阴性对照是用非免疫血清替代一抗进行的。对照切片与样品平行处理。
所有染色切片均由3 位独立调查者以盲法进行评估。评分标准[9]:染色程度:无染色(0 分)、浅黄色(1分)、棕黄色(2分)、棕褐黄色(3分);阳性细胞百分数:≤5%(0分)、>5%~25%(1 分),>25%~50%(2分),>50%~75%(3分),>75%(4分)。两者得分乘积为最终评分标准,≤3分为阴性,>3分为阳性。
1.4 细胞培养和分组转染
将RCC 细胞(Caki-2、A498、ACHN、786-O、OSRC-2)和人正常肾细胞(293T)置于含有10%胎牛血清和青霉素-链霉素的RPMI 1640 培养基中,并在37 ℃、5%CO2的加湿培养箱中培养。OS-RC-2 细胞汇合度达90%左右时,根据Lipofectamine 2000 试剂盒说明书进行转染:首先取0.8 µg 质粒DNA(NC mimic、miR-124 mimic、pcDNA、pc-JAG1)和2 µL Lipofectamine 2000 分别用50µL Opti-MEM 稀释,混合后静置20 min,将转染复合物置于24孔细胞板中,100µL/孔,与细胞混合均匀后培养48 h。实验分成5组:Control组(常规培养,不转染)、NC mimic组(转染NC mimic与Lipofectamine 2000复合物)、miR-124 mimic 组(转染miR-124 mimic 与Lipofectamine 2000复合物)、miR-124 mimic+pcDNA 组(共转染miR-124 mimic 和pcDNA 与Lipofectamine 2000 复合物)和miR-124 mimic+pc-JAG1 组(共转染miR-124 mimic和pc-JAG1 与Lipofectamine 2000 复合物)。qPCR 法检测转染后的干扰/过表达效果。
1.5 qPCR 法检测miR-124 和JAG1 mRNA 在RCC组织和细胞中的表达
采用TRIzol 根据miRNeasy Mini Kit 说明书从RCC 组织和细胞中提取总RNA。RNA 纯度和浓度用Nanodrop 2000 测定,随后RNA 在-80℃保存。将RNA 反转录成cDNA。以cDNA 为模板制备PCR 反应体系:cDNA 5 µL,SYBR Green ⅠPCR Master Mix 10 µL,正反向引物各0.4 µL,H2O 4.2 µL。PCR反应采用ABI PRISM 7500 real-time PCR System,具体的反应过程为95 ℃5 min、95 ℃20 s、59 ℃15 s,共39 个循环。采用U6/GAPDH 作为内参。miR-124和JAG1 mRNA 的相对表达量计算公式为2-ΔΔCt。所用引物序列见表1。

表1 qPCR引物序列
1.6 双荧光素酶报告基因实验验证miR-124 和JAG1基因间的靶向关系
采用在线生物信息学预测软件TargetScan检测miR-124和JAG1的结合位点。以psiCHECK2载体为基础,psiCHECK载体图谱如图1所示。构建野生型(WTJAG1 3'UTR)和突变型(MUT-JAG1 3'UTR)载体质粒。根据Lipofectamine 2000 试剂盒的说明制备转染混合物(0.8µg质粒DNA(NC mimic、miR-124 mimic、WTJAG1 3'UTR、MUT-JAG1 3'UTR)和2µL Lipofectamine 2000分别用50µL Opti-MEM稀释后均匀混合即可得到转染混合物),并采用双荧光素酶报告基因检测试剂盒检测37 ℃培养24 h后的荧光素酶活性。共转染组为NC mimic+WT-JAG1 3'UTR 组、miR-124 mimic+WTJAG1 3'UTR组、NC mimic+MUT-JAG1 3'UTR组、miR-124 mimic+MUT-JAG1 3'UTR组。
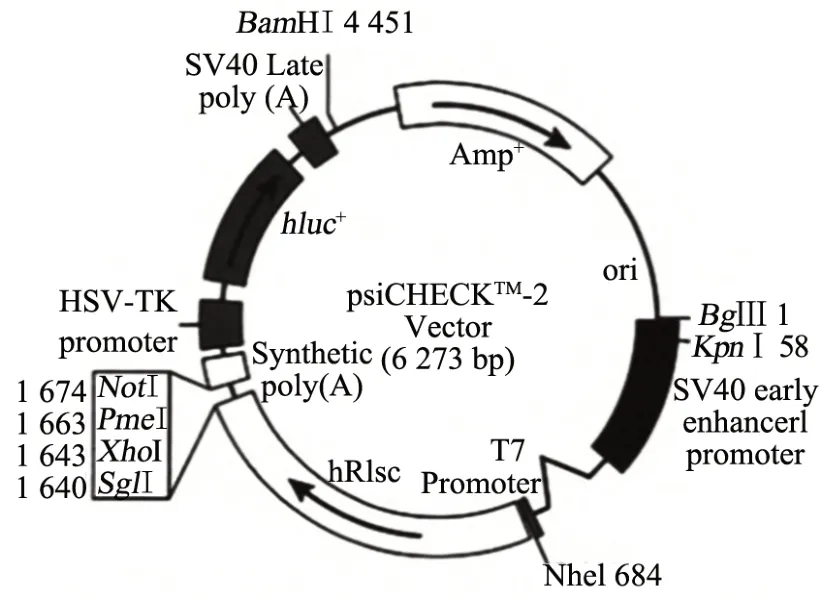
图1 psiCHECK2载体结构图
1.7 WB法检测RCC组织和细胞中相关蛋白质的表达
提取组织和细胞的总蛋白,并根据BCA试剂盒的说明测定蛋白浓度。将提取的蛋白加入样品缓冲液(30 g/孔)中,95 ℃加热10 min。10%聚丙烯酰胺凝胶电泳进行蛋白分离。用5%牛血清白蛋白在室温下封闭聚偏氟乙烯膜1 h。以4倍的比例加入一抗(1∶1 000)过夜(4 ℃):JAG1、cleaved caspase-3、BAX、Bcl2、NICD、HES1、HES5和GAPDH。然后将辣根过氧化物酶标记羊抗兔IgG二抗(1∶2 000)加入样品,室温反应1 h,用化学发光试剂处理样品,以GAPDH 作为内参对照。经Bio-rad Gel Dol EZ成像仪扫描记录。利用ImageJ软件对目标条带进行灰度值分析。
1.8 MTT 实验检 测miR-124 和JAG1 过表达对OS-RC-2细胞增殖的影响
转染后的OS-RC-2 细胞接种在96 孔板上,稀释到设计浓度(5×103个细胞/孔)。细胞在37 ℃、5%CO2培养箱中培养24、48和72 h。每孔加入20 μL的MTT(浓度5 mg/mL),继续培养4 h。然后小心取出孔内的培养液,各加入150µL二甲基亚砜,在摇床上缓慢震荡10 min,待结晶全部溶解后,使用多功能酶标仪在450 nm 波长下测量相应的光密度(D)值。根据公式计算RCC细胞活力:细胞活力=实验组D值/对照组D值×100%。
1.9 Transwell 实验检测miR-124 和JAG1 过表达对OS-RC-2细胞迁移的影响
迁移实验:将转染后的OS-RC-2 细胞放置在Transwell 的上腔室,下腔室则添加含10%胎牛血清的RPMI 1640 培养基,37 ℃培养48 h 后,取出上室,去除未迁移细胞,用70%甲醛固定穿膜细胞30 min,用0.1%结晶紫染色穿膜细胞。倒置显微镜下捕捉迁移细胞的图像,随机选取5个区域计数迁移细胞。侵袭实验:操作步骤与迁移实验基本一致,只是上腔室需要预先铺满50 mg/L人工基膜1∶8稀释液。
1.10 流式细胞术检测miR-124 和JAG1 过表达对OS-RC-2细胞凋亡的影响
用胰蛋白酶消化细胞并离心(400×g)5 min,转染24 h后收集细胞,制成单细胞悬液(1×106/mL)。室温下,将100 μL细胞悬液注入试管中,同时将碘化丙啶与RNaseA混合,后与细胞在4 ℃下反应30 min。立即采用流式细胞仪进行检测和分析,使用Cell Quest 软件进行数据分析。
1.11 统计学处理
2 结果
2.1 RCC组织中miR-124呈低表达、JAG1呈高水平
qPCR、WB法检测结果显示,RCC组织中miR-124水平明显低于癌旁组织,JAG1 mRNA和蛋白水平则明显高于癌旁组织(均P<0.01,图2);RCC细胞系(Caki-2、A498、ACHN、786-O、OS-RC-2)中miR-124水平明显比人正常肾细胞293T低,JAG1 mRNA和蛋白水平明显比人正常肾细胞293T高(均P<0.05),且OS-RC-2细胞中miR-124水平最低,JAG1 mRNA 和蛋白水平最高(均P<0.05,图3),因此选择OS-RC-2细胞进行转染实验。免疫组化检测结果(图4)显示,JAG1染色主要存在于细胞膜和/或细胞质中。JAG1 在RCC 组织中的阳性表达率为92.11%(35/38),阴性表达率为7.89%(3/38);在癌旁组织中的阳性表达率为28.95%(11/38),阴性表达率为71.05%(27/38),差异有统计学意义(χ2=31.722,P<0.05)。免疫组化评分结果显示,癌旁组织JAG1蛋白阳性表达评分明显低于RCC 组织[(2.56±0.24)vs(5.89±0.36)分,t=23.089,P<0.05]。
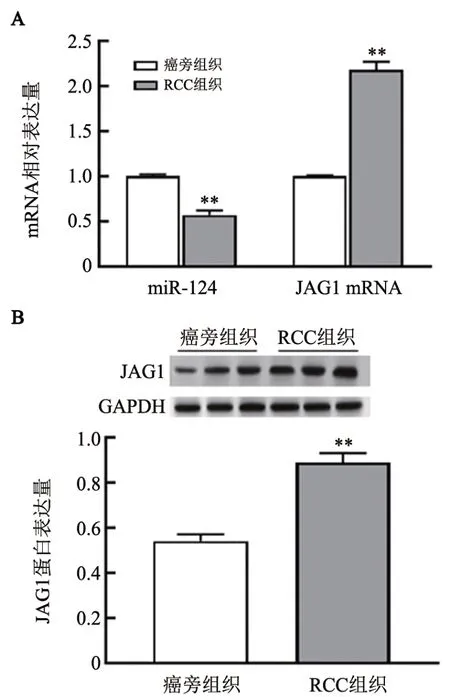
图2 miR-124和JAG1蛋白在RCC组织中分别呈低表达和高表达

图3 miR-124和JAG1蛋白在RCC细胞中分别呈低表达和高表达
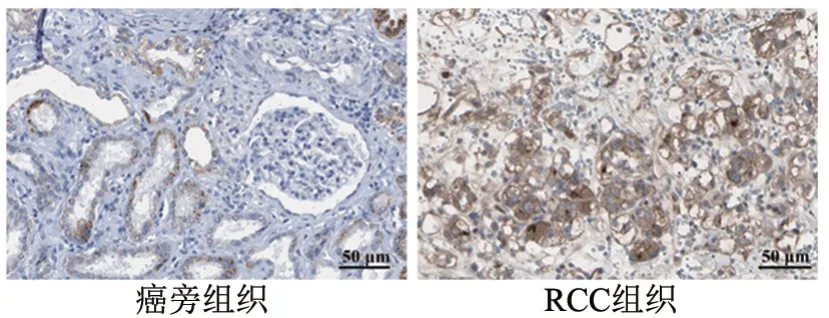
图4 JAG1在RCC组织和癌旁组织中的表达(×400)
2.2 miR-124直接负调控JAG1
TargetScan 预测软件结果(图5A)显示,miR-124与JAG1 3'UTR 存在作用位点。双荧光素酶报告基因实验检测结果(图5B)显示,与NC mimic+WTJAG1 3'UTR组相比,miR-124 mimic+WT-JAG1 3'UTR组荧光素酶活性被显著抑制(P<0.05),而miR-124 mimic+MUT-JAG1 3'UTR 组荧光素酶活性抑制不明显(P>0.05)。qPCR、WB 法检测结果(图6)显示,miR-124 mimic 组JAG1 mRNA 和蛋白表达显著低于NC mimic 组,miR-124 inhibitor 组JAG1 mRNA和蛋白表达显著高于NC inhibitor组(均P<0.05)。

图5 双荧光素酶报告基因实验验证miR-124负调控JAG1
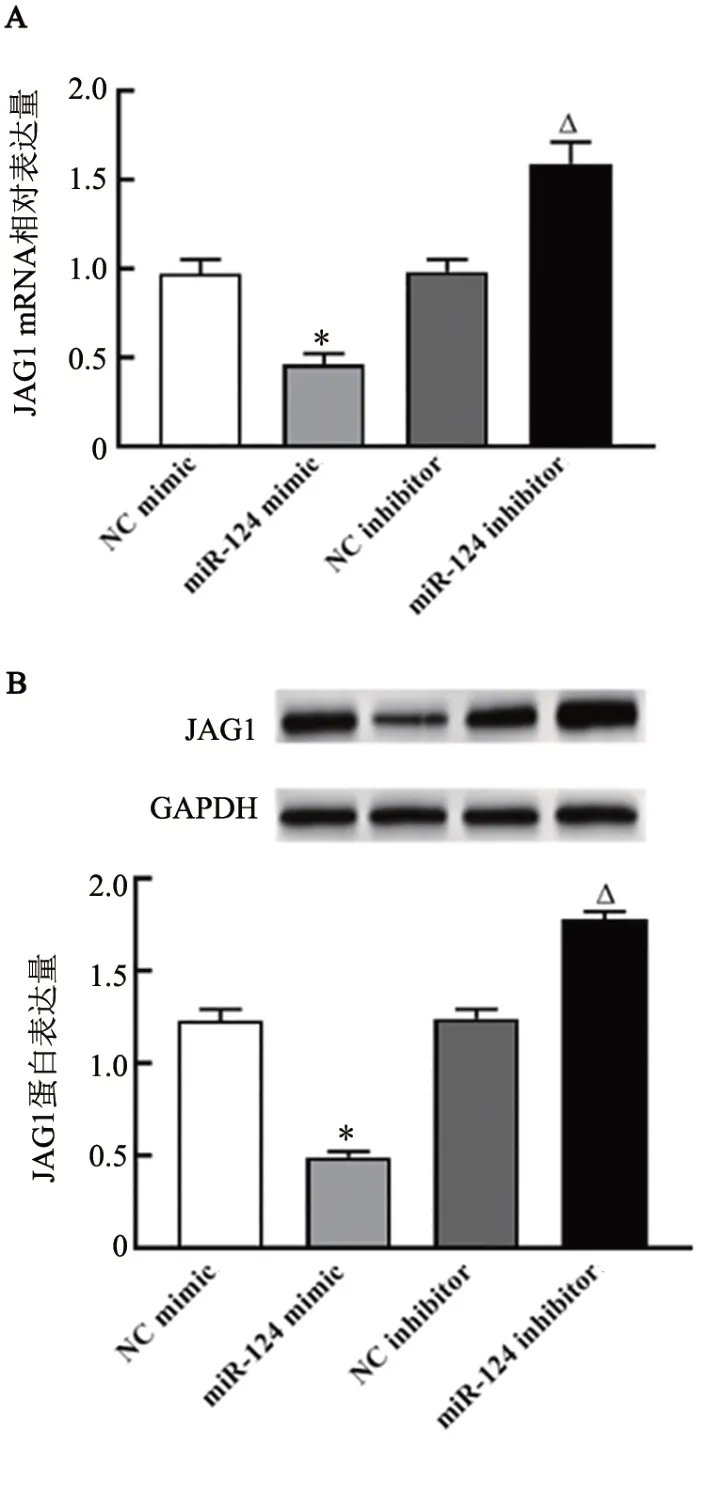
图6 miR-124抑制OS-RC-2细胞中JAG1 mRNA(A)和蛋白(B)的表达
2.3 miR-124抑制OS-RC-2细胞增殖
qPCR、WB 法检测结果(图7)显示,与Control 组和NC mimic组比较,miR-124 mimic组OS-RC-2细胞中miR-124 表达升高,JAG1 mRNA 和蛋白表达降低(均P<0.05);与miR-124 mimic+pcDNA组和miR-124 mimic 组相比,miR-124 mimic+pc-JAG1 组OS-RC-2细胞中miR-124 表达降低,JAG1 mRNA 和蛋白表达升高(均P<0.05)。
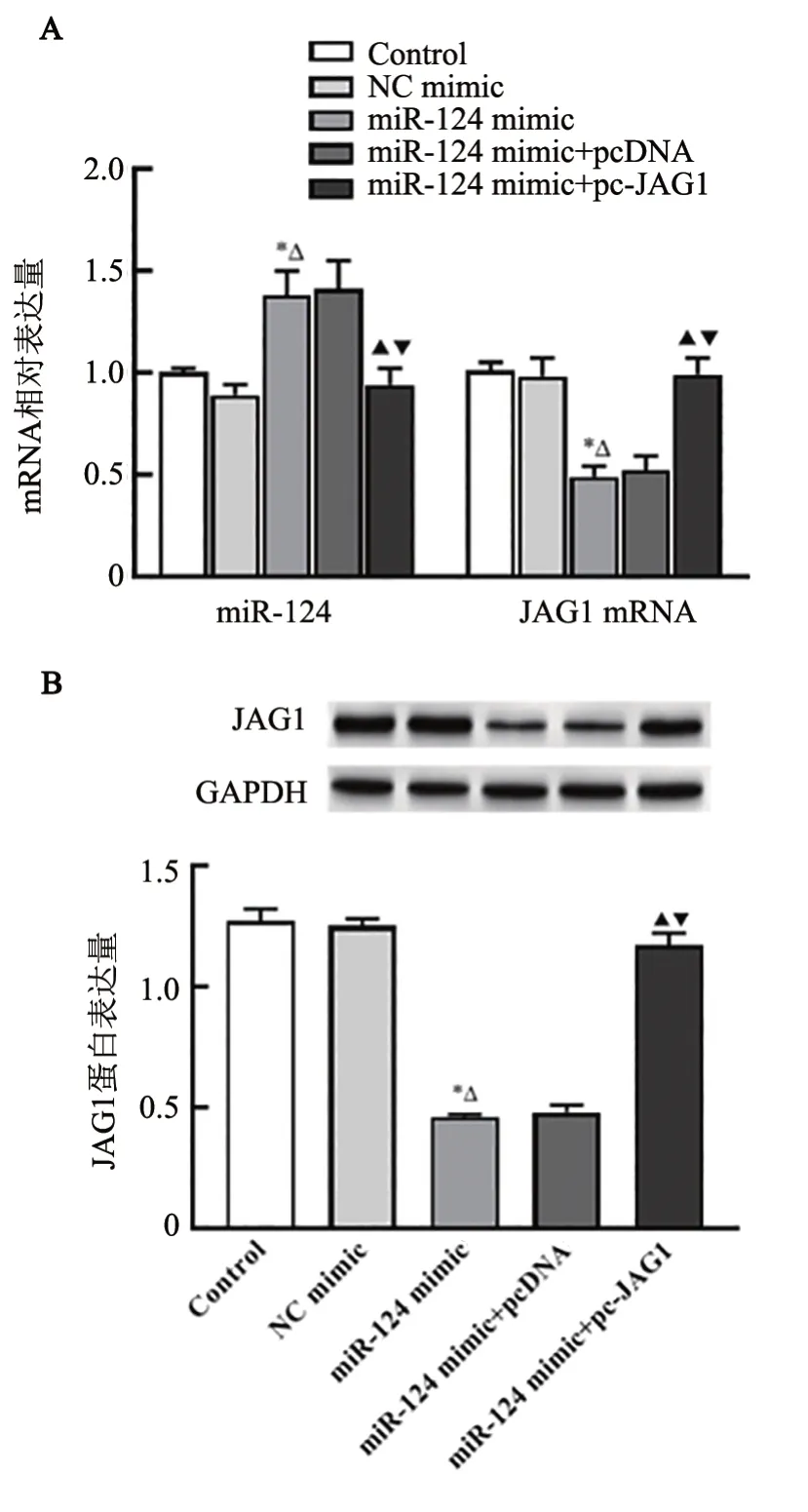
图7 共转染miR-124 mimic和pc-JAG1抑制OS-RC-2细胞中miR-124的表达(A)促进JAG1表达(B)
MTT 法检测结果(图8)显示,miR-124 mimic 组OS-RC-2 细胞活力(24、48、72 h)显著低于Control 组和NC mimic组,miR-124 mimic+pc-JAG1 组OS-RC-2细胞活力(24、48、72 h)显著高于miR-124 mimic+pcDNA组和miR-124 mimic组(均P<0.05)。

图8 共转染miR-124 mimic和pc-JAG1提高OS-RC-2细胞的活力
2.4 miR-124 抑制OS-RC-2 细胞迁移和侵袭而促进凋亡
Transwell 实验检测结果(图9)显示,较Control组和NC mimic 组而言,miR-124 mimic 组迁移、侵袭细胞数目显著减少,凋亡率显著升高,cleaved caspase-3 和BAX 蛋白表达明显增加,Bcl2 蛋白表达明显减少(均P<0.05);相比miR-124 mimic+pcDNA组和miR-124 mimic 组,miR-124 mimic+pc-JAG1 组迁移、侵袭细胞数目明显增多,凋亡率明显降低,cleaved caspase-3和BAX蛋白表达显著降低,Bcl2蛋白表达显著增加(均P<0.05)。

图9 共转染miR-124 mimic和pc-JAG1促进OS-RC-2细胞迁移和侵袭并抑制其凋亡
2.5 miR-124 抑制OS-RC-2 细胞中Notch 信号通路相关蛋白表达
WB 检测结果(图10)显示,miR-124 mimic 组OS-RC-2细胞中NICD、HES1、HES5蛋白表达显著低于Control 组(均P<0.05),miR-124 mimic+pc-JAG1组OS-RC-2 细胞中NICD、HES1、HES5 蛋白表达显著高于miR-124 mimic组(P<0.05),而NC mimic组和Control 组、miR-124 mimic+pcDNA 组 和miR-124 mimic 组OS-RC-2 细胞中NICD、HES1、HES5 蛋白表达无明显差异(P>0.05)。
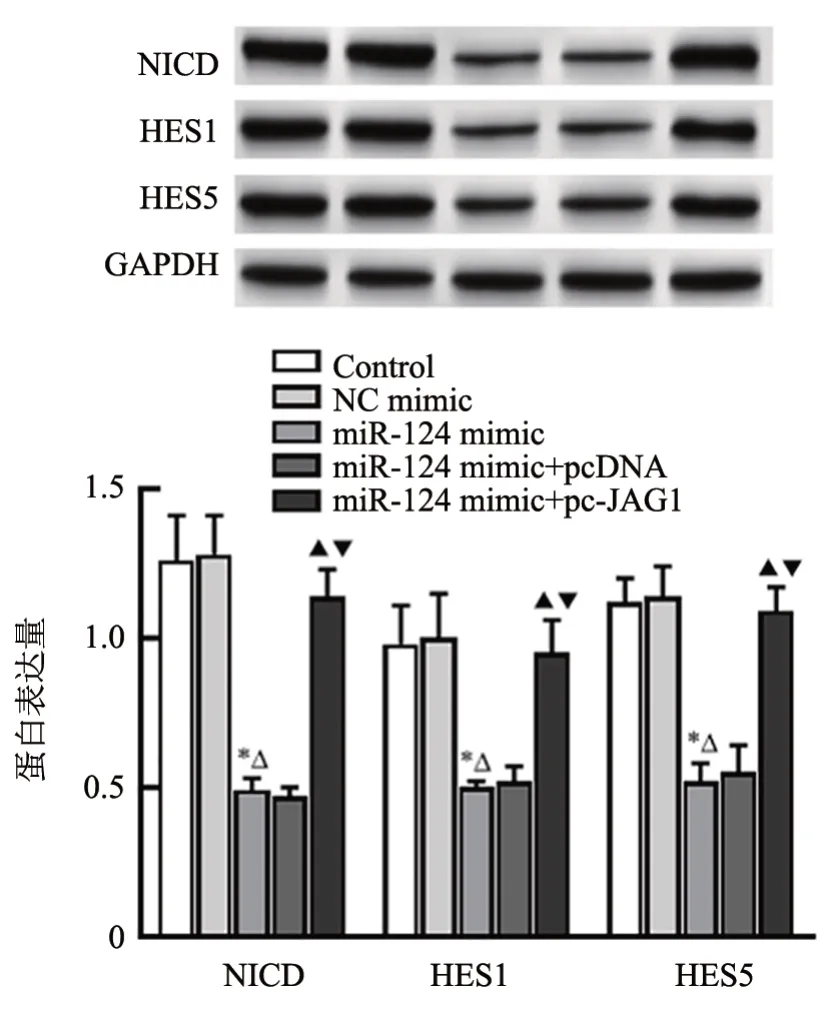
图10 共转染miR-124 mimic 和pc-JAG1 促进OS-RC-2 细胞中Notch信号通路相关蛋白的表达
3 讨论
男性、年龄增长、吸烟和遗传易感性均是目前公认的RCC危险因素。由于缺乏诊断生物标志物和早期特殊症状,约20%~30%的RCC患者在初始诊断时就有转移[10]。而且,经手术治疗后,RCC 患者发生转移或复发的概率仍然较高,约为50%,这与预后不良有关[11]。因此,了解RCC 复发和转移的分子机制对改善RCC治疗意义重大。
近年来研究发现miRNA 在RCC 的生物学过程中发挥重要作用。miR-124 是一种肿瘤抑制因子,SHEN 等[12]指出miR-124 在黑色素瘤组织中表达降低,过表达miR-124 可通过降解RACK1 抑制黑色素瘤细胞的增殖、迁移和侵袭,促进黑色素瘤细胞凋亡;FAN 等[13]的研究结果表明,miR-124 可通过抑制IQGAP1 的表达抑制结直肠癌的进展;在食管癌中,miR-124可抑制细胞侵袭和迁移,其抑制作用与靶向调控BECN1有关[14];而在RCC中,miR-124过表达可抑制MMP-9表达,降低RCC 细胞的侵袭能力[15]。本研究结果显示,miR-124 在RCC 组织和细胞中呈低表达,与ÇAYKARA等[16]的研究结果一致,说明miR-124在RCC 中发挥抑癌作用。由于miR-124 在OS-RC-2细胞的表达与人正常肾细胞293T 差异最大,所以本研究选择OS-RC-2细胞中进行后续实验。
本研究通过在OS-RC-2 细胞中转染miR-124 mimic发现,miR-124表达显著升高,说明细胞转染成功;此外,过表达miR-124 可有效抑制RCC 细胞增殖、迁移和侵袭,促进RCC 细胞凋亡。Cleaved caspase-3 是caspase-3 的激活形式,细胞中cleaved caspase-3表达水平与凋亡率呈正比。BAX和Bcl2属于同一个家族,且均与细胞凋亡有关,但两者作用相反,BAX促进细胞凋亡,而Bcl2抑制细胞凋亡[17]。本研究结果显示,转染miR-124 mimic 可显著升高cleaved caspase-3和BAX蛋白表达、降低Bcl2蛋白表达,这与凋亡检测结果相对应,揭示miR-124 对RCC细胞凋亡的促进作用与cleaved caspase-3、BAX、Bcl2蛋白的表达水平有关。
JAG1 是Notch 典型的配体之一,已有研究证实JAG1 在肝癌[18]、乳腺癌[19]等不同类型的肿瘤中发挥促癌作用。本研究发现,JAG1在RCC组织和细胞中的表达显著升高,这与吴科荣等[20]的研究结果一致,提示JAG1 在RCC 中也作为促癌因子起作用。PAN等[21]指出,miR-124 通过靶向JAG1 抑制胃癌进展。而本研究通过TargetScan 预测软件得到miR-124 与JAG1 3'UTR 互补的核苷酸位点。进一步研究发现,miR-124 靶向负调控JAG1 的表达。此外,回复实验结果显示,过表达JAG1 可逆转miR-124 过表达对RCC细胞增殖、迁移、侵袭和凋亡的作用。
JAG1 可通过细胞间的相互作用触发Notch 信号。在宫颈癌、舌癌中,JAG1 表达的升高可激活Notch信号通路,并进一步诱发下游基因的转录和翻译,而上游的miRNA对JAG1的表达和Notch信号通路具有调控作用[22-23]。NICD 是Notch 受体的一种激活形式,通过激活的Notch信号通路可以释放NICD,从而增加HES1、HES5 等HES 家族表达[24]。HES1 和HES5 对Notch 信号通路至关重要,可以抑制细胞凋亡,促进细胞侵袭、迁移和增殖[25]。本研究结果显示,miR-124 过表达时,NICD、HES1、HES5 蛋白表达下降,而过表达JAG1 会干扰miR-124 对NICD、HES1、HES5 蛋白表达的抑制作用,揭示miR-124 通过下调JAG1,抑制Notch信号通路的激活。
综上所述,本研究发现,miR-124 通过抑制JAG1/Notch信号通路,抑制RCC细胞迁移、侵袭和增殖,加速RCC 细胞凋亡,为RCC 的机制研究提供了参考依据。