运动减轻孤独症神经炎症的可视化分析
蓝婉婷,钟救根,2,沈莹莹,龚嘉恒,邹智,侯晓晖,2
1.广州体育学院残疾人运动与健康促进国际协同创新中心,广东广州市 510500;2.上海体育学院运动科学学院,上海市 200438
0 引言
孤独症谱系障碍(autism spectrum disorder,ASD)属于广泛性神经发育障碍,患者在社会互动和社会交往过程中存在持续性障碍,并在行为、兴趣和活动方面表现出限制性、重复性和刻板性[1]。ASD 的发生率呈不断上升趋势。2019年《中国孤独症教育康复行业发展状况报告Ⅲ》指出,目前我国的ASD 患者超过1 000 万,儿童约200 多万,患病率约为1%,并且以每年近20万的速度增长[2]。
ASD 的病因可能与环境、遗传和免疫功能障碍等因素相关[3]。神经炎症可能是ASD 的一个发病因素,ASD 患者在外周和中枢神经系统(central nervous system,CNS)中均存在异常的炎症反应[4-5]。大脑和脑脊液中小胶质细胞激活异常,炎性细胞因子水平升高[6-7]。在病因不明且临床治疗无效的背景下,现有的研究主要探索能够减轻障碍、提高患者生活质量的干预方法。运动疗法是改善ASD 症状的有效方法之一[8-9]。规律运动可以改善ASD 患者的认知、社交、行为及运动表现[10-11]。但运动减轻ASD 症状的生物学机制尚未明确。在其他疾病中,运动可以通过减轻神经炎症达到改善疾病症状的效果。对抑郁症动物模型运动干预的研究显示[12],运动可以减轻海马炎症和改变小胶质细胞的数量与激活,改善其症状。因此,我们推测,运动可能通过减轻神经炎症,特别是调控小胶质细胞和细胞因子,改善ASD患者症状[13]。
CiteSpace是结合信息可视化方法、文献计量学和数据挖掘算法的交互式可视化工具。本文借助CiteSpace 工具对ASD-小胶质细胞研究领域的相关文献进行可视化分析,探索小胶质细胞在ASD中的作用机制、研究热点及未来发展趋势;进一步对ASD的神经炎症中小胶质细胞和细胞因子的改变,以及运动改善ASD症状的免疫调控机制和可能通路进行综述。
1 方法
1.1 数据来源
检索Web of Science 核心合集数据库,以主题字段检索,检索式:(autistic disorder OR autism spectrum disorder OR autism OR autistic OR ASD OR asperger syndrome) AND (microglia OR microglial OR glia OR neuroglial OR Iba1)。检索时段2012 年1 月至2021年12月。检索时间2022-01-06。
1.2 数据分析软件与方法
采用CiteSpace 5.8.R3软件对检索文献进行去重筛选和分析,同时使用该软件对检索文献的关键词行共现分析、聚类分析,探索高频关键词。其中关键词聚类标签采用对数似然比(log-likelihood ratio,LLR)算法提取。
2 结果
2.1 文献类型与年发文量
共检索到文献825 篇,排除会议、报道、广告、图书、报纸、征文通知、人物专访、主编致词等不相关文献和重复发表的文献,共纳入783 篇。其中综述325 篇,动物实验373 篇,人群实验80 篇(多为尸检结果),细胞分子研究等5 篇。近10 年来,有关于ASD-小胶质细胞的研究呈逐年增加趋势,2021年的发文量达到2012年的4.5倍。见图1。

图1 2012年至2021年ASD-小胶质细胞相关文献发表量
2.2 关键词
2.2.1 共现分析
将ASD-小胶质细胞相关关键词按频次排序,频次出现300 以上的关键词为autism spectrum disorder和microglia。前20 位(表1)关键词中与神经炎症相关的关键词涉及maternal immune activation、neuroinflammation、astrocyte、cytokine。研究对象主要为动物模型和人群,动物模型包括mouse、mice、rat 等,人群涉及children、adolescent、adult、aged。前20 位关键词包含1 个与学习记忆等认知功能相关的重要脑区[14]prefrontal cortex,之后还有hippocampus、cerebral cortex、corpus callosum、dentate gyrus、dorsolateral prefrontal cortex、corpus callosum、visual cortex等。

表1 频次前20的关键词
2.2.2 聚类分析
对关键词进行聚类分析,共得到24个聚类,聚类大小按文献量分布,前10 位聚类从大到小依次编号0~9(图2、图3):#0 cerebral cortex、#1 mouse model、#2 young children、#3 neurite、#4 neurons、#5 brain injury、#6 enteric nervous system、#7 risk、#8 cortical development、#9 prenatal exposure。LLR 值越大,对该聚类代表性越强。根据LLR值确定该聚类的代表标签词。
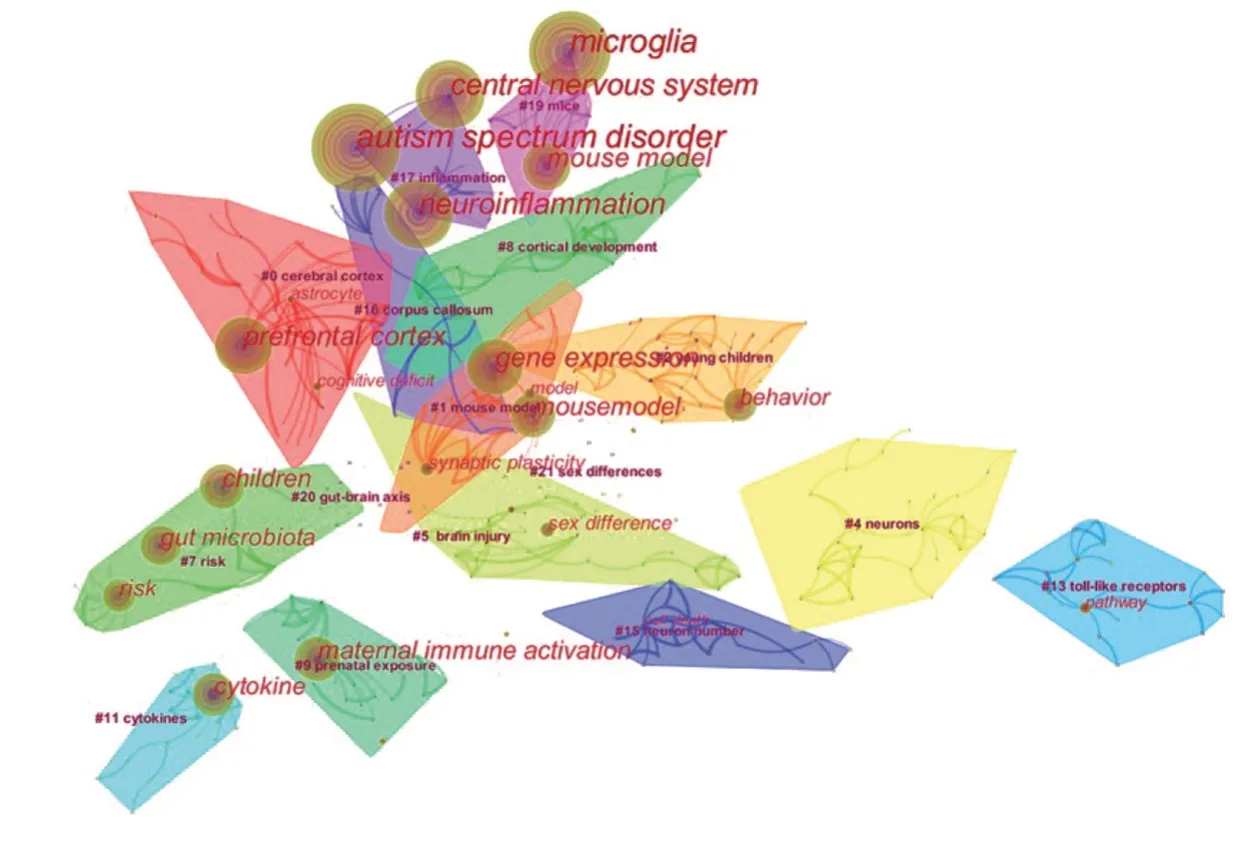
图2 关键词聚类图谱

图3 关键词时间演化图谱
3 讨论
3.1 ASD与神经炎症
越来越多的证据支持神经炎症是ASD病因关键的一环,并涉及到多个系统的相互作用和改变(如神经解剖和细胞分子)。ASD 患者在外周和CNS 中都存在异常的炎症反应[4-5]。如在ASD 患者的脑脊液、血液和尸检脑组织的样本中发现存在免疫细胞失衡及促炎细胞因子水平升高[14]。本研究中,neuroinflammation关键词排序为第4位,表明神经炎症是ASD-小胶质细胞研究领域的热点。
神经炎症是CNS在损伤、感染、毒素等各种影响内稳态因素的刺激下产生的复杂免疫反应,涉及多种免疫细胞和驻留细胞[15],表现为胶质细胞持续激活和增殖,以及免疫细胞因子过表达[16]。星形胶质细胞在支持神经元功能、通过血脑屏障运输物质、储存能量、调节神经递质等方面发挥重要作用[17]。小胶质细胞是定植于CNS的特异性免疫细胞,其从原始髓系祖细胞发育而来并迁移到大脑中,小胶质细胞在大脑的发育、功能和维持稳态、介导神经炎症方面起着重要作用[18]。在受到外界刺激时,小胶质细胞会改变其形态,以快速地适应大脑变化,并通过一系列刺激信号(如细胞因子和ATP)相互影响,从而启动免疫反应[19]。与此同时,小胶质细胞的活性也受到促炎和抗炎细胞因子的调控[20]。
3.1.1 小胶质细胞改变
有研究表明[21-22],与ASD 情绪控制、社会交往和运动协调相关的脑区受损,在灰质(如杏仁核、海马和楔前叶)和白质结构(如弓状和钩状束)中都存在神经解剖学和细胞分子变化。
本研究显示,#0 cerebral cortex 聚类的文献研究年份从2012 年延续至2021 年,表明相关脑区的改变在ASD-小胶质细胞研究领域中受到持续关注。在关键词排序中,研究部位排名第一的是prefrontal cortex,说明前额叶皮质是ASD-小胶质细胞领域研究最多、最受关注的脑区。
ASD 患者的尸检结果表明,前额叶皮质神经元过度生长的标记物增加,神经元树突棘增加;海马的树突分支减少[23]。另一项研究发现[24],ASD 大脑中的小胶质细胞激活异常,数量、形态和神经元的相互作用都有改变,尤其是在控制执行功能的前额叶背外侧皮质等区域。一项PET/CT 扫描分析[25]揭示了ASD 患者大脑中小胶质细胞激活的分布模式,在活体中证明ASD 患者大脑中存在小胶质细胞的异常激活。激活的小胶质细胞在ASD 患者和对照组大脑的分布模式相似,但在部分脑区的激活数量相增加,包括小脑、脑干、前扣带皮质、额叶皮质(前和中)、颞叶皮质(颞和梭状回)、顶叶皮质、胼胝体等,而这些区域与ASD患者的学习记忆、刻板行为相关[25]。
因此,ASD 不同脑区中小胶质细胞的改变可能是导致ASD患者表型异质性和严重程度的原因,且小胶质细胞反应的增加与ASD患者大脑中存在的神经炎症相关[13]。这些证据表明,神经炎症,特别是小胶质细胞的改变,可能是影响ASD发生发展的重要因素。
3.1.2 细胞因子改变
细胞因子是由免疫细胞或其他体细胞分泌的具有信息活性的小蛋白,对于大脑的正常发育、突触可塑性和对损伤的反应必不可少[26]。对ASD 患者的尸检结果发现,患者脑组织中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、干扰素(interferon,IFN)-γ、IL-8 较正常对照组显著增加[27]。多项动物研究证实,ASD 模型鼠脑组织中存在着促炎细胞因子及其结合蛋白的过表达,如IL-6、IL-18 和IL-18 结合蛋白、IL-1 及其受体拮抗剂IL-1ra[28](表2)。正常且稳定的IL-1β 及其IL-1ra 对大脑的正常发育和功能是必要的,过高的IL-1β 可能导致ASD 刻板动作和认知障碍的加剧[29]。而给予ASD 模型小鼠抗炎药物后,脑组织中IL-17a、IFN-γ 等促炎细胞因子分泌减少,同时IL-10 等抗炎细胞因子分泌增加,小鼠的ASD 样行为有明显改善[30]。这些研究表明,ASD 存在异常的炎症反应,包括促炎性细胞因子水平升高和/或抗炎性细胞因子水平降低。由细胞因子改变产生的神经炎症可能是ASD病理生理学机制之一[31]。

表2 ASD患者或动物模型中枢细胞因子的改变
除了中枢细胞因子改变,ASD 患者外周也存在细胞因子异常变化。ASD 核心症状与其外周异常神经炎症有关。在母体免疫激活(maternal immune activation,MIA,一种ASD 模型)小鼠外周血中观察到IL-6、IL-17、粒细胞和单核细胞数量以及巨噬细胞中IL-12p40及趋化因子增加;而在母体暴露之前进行流感疫苗预处理后,皮质酮和IL-17a 水平降低,MIA 小鼠社交障碍得到改善[32]。ASD 患者外周血中抗炎细胞因子如IL-4、IL-10、转化生长因子-β1 等分泌减少,可能是ASD 患者重复刻板行为和适应能力降低的原因[33]。有研究发现[34],血浆细胞因子水平与ASD 症状的严重程度相关,炎性细胞因子水平的升高可能导致沟通障碍加重和异常行为增加。
综上所述,现有证据支持ASD的病因可能是神经炎症失调,小胶质细胞的异常激活、炎性细胞因子水平的改变是ASD发生发展的重要因素。减轻神经炎症可能是ASD治疗未来的研究方向。
3.2 运动可能通过减轻神经炎症改善ASD
运动是一种为改善或保持身体健康而进行的有计划的身体活动[39],对健康人以及患有代谢和神经精神疾病(如抑郁、焦虑、精神分裂症、痴呆和其他神经退行性疾病)患者都有良好的效果[40],也被证实可以减少ASD 患者的刻板行为、社会交往缺陷[8]。在进行运动干预后,ASD 儿童的刻板行为发生率减少一半以上[41]。在2015年美国国家孤独症中心发布的国家标准项目中,运动被列为ASD 的重点干预措施之一[42-43]。在现有的研究中,对ASD患者采取运动干预的时间为30~60 min,运动强度多以患者主观感觉不适作为监测标准,运动方式以有氧运动为主,如慢跑、体操、体育游戏、水上运动、骑马、太极拳和瑜伽等[44-45]。有研究推荐ASD 患者的运动频率为每周1~4 次[46]。目前ASD患者的运动干预在时间、强度、运动量和频率等具体细节上仍不明确,除了鼓励ASD患者参与和坚持运动,目前还没有针对该群体的具体运动处方推荐。
虽然关于运动改善ASD 的生物学机制仍不清楚,但大量研究已经证实,规律的运动可以提高机体抗感染能力,这种免疫调控与不同的细胞因子反应相关,具体表现为外周抗炎细胞因子IL-6、IL-1ra和IL-10水平升高,促炎细胞因子TNF-α 和IL-1β 水平降低[47]。本团队前期研究发现[48],适应水中运动干预4 周后,ASD 儿童血浆中IL-1β、IL-2R、IL-4、IL-6 等细胞因子水平下降,学习障碍、焦虑,刻板动作和认知等得到改善。另外,运动可以通过调节细胞因子水平,抑制小胶质细胞激活,进而减轻神经炎症[49-50]。尽管目前无直接证据表明运动可以通过调控ASD患者中枢神经炎症而改善症状,但有研究表明[51],运动可以缓解其他精神或神经类疾病的神经炎症,改善其症状。
抑郁大鼠模型进行自主跑轮运动干预6 周,抑郁症状显著改善;三维定量和免疫组化观察显示,海马组织及其各亚区小胶质细胞数减少,海马DG 亚区小胶质细胞异常激活减少,血清IL-1β水平降低[12]。
中高强度有氧运动16周可以提高阿尔茨海默病患者脑脊液中血清可溶性髓样细胞触发受体(soluble triggering receptor expressed on myeloid cells,sTREM)2 水平,并改善其认知[51]。sTREM2 可以激活小胶质细胞中Akt-GSK3β-β-catenin和NF-κB信号通路,调节炎性细胞因子的产生,吞噬凋亡神经元及诱导炎症反应[52]。
因此,运动对于神经炎症的调控非常重要。运动对ASD 症状的有益影响也可能是通过减轻神经炎症,或调控小胶质细胞介导的炎症通路实现的,具体的机制值得进一步深入研究。
3.3 运动改善ASD神经炎症的可能通路
3.3.1 核转录因子kappaB (nuclear factor-kappa B,NFκB)信号通路
在ASD-小胶质细胞相关研究的前20 位关键词中出现pathway 一词。小胶质细胞参与ASD 的发病受多种信号通路调控。其中,NF-κB 信号通路是近年来备受关注通路。ASD 患儿外周血中NF-κB 的DNA 结合活性显著升高[53]。NF-κB 可能参与ASD 的发病机制,是未来药物治疗ASD 的潜在靶点[54]。NF-κB 是存在于包括小胶质细胞在内的几乎所有细胞中的一种重要的核转录因子,可以被脂多糖、活性氧、细胞因子等物质激活,是炎症反应、免疫应答的核心介质[55]。运动可能通过抑制NF-κB 激活减轻炎症反应。有氧运动可显著增加抑郁症小鼠海马miR-223 的表达,激活miR-223/TLR4/Myd88-NF-κB 通路,从而减轻海马炎症,改善其症状[56]。运动可能经NF-κB 信号通路调控ASD患者小胶质细胞功能,减轻中枢神经炎症。
3.3.2 微生物-小胶质细胞轴
除了NF-κB 信号通路外,目前ASD-小胶质细胞领域有许多研究关注到肠道与大脑之间的双向沟通。在ASD-小胶质细胞相关文献的关键词排序中,gut microbiota位居前20位,表明肠道微生物与ASD-小胶质细胞联系紧密,是目前研究的热点。
23%~70%的ASD 患者伴有肠易激综合征、慢性腹泻和/或便秘等胃肠道疾病[57]。同时,ASD患者的肠道菌群在多样性和组成上与正常对照组有差异,如梭状芽胞杆菌和乳酸杆菌的丰度在ASD患者中升高,而普雷沃氏菌减少[58]。随着“微生物-肠-脑轴”的提出,肠道微生物如何影响大脑的谜团正在慢慢被解开,包括神经、激素和免疫途径[59]。近年来“微生物-小胶质细胞轴”作为可能的免疫途径在ASD的发生发展中受到关注。MIA 模型小鼠不仅表现出肠道生态失调、肠道通透性增加和肠道炎症等胃肠道功能障碍,同时也表现出小胶质细胞的异常改变和炎性因子基因表达增加[18,58]。肠道微生物的衍生物短链脂肪酸(short-chain fatty acids,SCFAs)可以调节小胶质细胞的成熟和稳态功能,可能通过循环到达大脑,影响小胶质细胞增殖、形态、激活等[60]。在ASD 中关注肠黏膜屏障和血脑屏障的完整性和肠道微生物群的变化至关重要。
运动可以促进有益菌种的产生,增加肠道微生物的多样性,影响微生物-肠-脑轴[61],可能与减轻ASD神经炎症,改善症状有关。
4 小结
ASD 的高发病率和高致残率会对个人生活质量造成严重影响,也给家庭和社会带来沉重负担。探究ASD 的病因,了解其分子机制,寻找有效的治疗策略十分必要。本研究显示,神经炎症,特别是小胶质细胞的改变是ASD 病因学研究的热点。ASD 患者体内存在的神经炎症与小胶质细胞表型、激活、形态的改变,以及大脑中关键细胞因子水平的改变有关,这些变化可能是ASD患者表型异质性和严重程度的原因。
规律的运动是促进健康的一种经济有效的策略。运动对ASD 患者的积极效应在功能层面已经被证实,目前亟需机制层面的相关研究来揭示运动的机理。对其他神经或精神类疾病的研究发现,运动可以调节小胶质细胞的激活和细胞因子水平,减轻神经炎症。运动也可能通过减轻ASD患者的神经炎症改善症状,其中,NF-κB或肠道微生物-小胶质细胞轴可能是重要的通路,值得进一步研究证实。
利益冲突声明:所有作者声明不存在利益冲突。

