新喀里多尼亚弧菌CGJ02-2中四氢嘧啶合成基因簇ectABC的克隆及其功能鉴定
谭琳,NWE Ni Win Htet,2,陈偿,PAN Zhiqiang
1.中国热带农业科学院海口实验站,海口571101;
2.缅甸生物技术研究所微生物实验室,缅甸 皎施 05151;
3.中国科学院南海海洋研究所,热带海洋生物资源和生态重点实验室,广州 510301;
4.美国农业部农业研究局天然产物利用研究中心,美国 牛津 38677-1848
相容性溶质是微生物在长期进化过程中形成的一种对抗外界不断变化渗透压的一类化合物[1]。四氢嘧啶类物质是一类广泛分布在嗜盐菌和非嗜盐菌中的相容性溶质,具有极好的渗透压保护功能[2-3]。近年来,研究发现四氢嘧啶不仅是调节微生物细胞渗透压的物质,还是细胞及大分子物质的生物保护剂。四氢嘧啶可缓解高渗、高温、冻融、干燥、辐射和化学试剂对蛋白、核酸、生物膜及整个细胞的毒害作用[4-6],且能在人体皮肤保护[7-9]、抗炎症治疗[10-12]、缓解神经变性疾病中发挥作用[13],因此在医疗、酶工业、化妆品等领域有广阔的应用前景。由于天然微生物中四氢嘧啶含量很低,提取困难,同时四氢嘧啶仅含有1个手性碳原子,也难以通过化学方法合成[14]。目前四氢嘧啶的生产大多通过发酵具有四氢嘧啶合成能力的中度嗜盐微生物获得大量的四氢嘧啶。但此方法的缺点是,高盐浓度下发酵对设备损耗较大导致生产成本较高,并且中度嗜盐微生物不是常用的工业微生物菌种,生长慢、发酵周期长、最终产率低[15]。为了简化这种复杂的生产工艺,目前将来源于嗜盐菌中的四氢嘧啶合成基因簇ectABC转入非嗜盐菌,在非嗜盐菌中重构四氢嘧啶的合成通路。重组菌株在中度盐离子浓度或者低盐离子浓度胁迫下合成四氢嘧啶[16]。在本团队前期研究中,对一株来自南海珊瑚礁的新喀里多尼亚弧菌CGJ02-2进行了全基因组序列测定,通过antiSMASH软件预测次级代谢产物基因簇,发现此细菌基因组中含有四氢嘧啶合成基因簇[17]。本研究旨在分离新的四氢嘧啶合成基因簇ectABC,并在大肠杆菌BW25113中重构四氢嘧啶的合成通路,通过优化全细胞催化条件,为构建四氢嘧啶高产菌株奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂、菌株限制性内切酶NheⅠ和EcoRⅠ购自Biolabs公司(New England);氨苄青霉素和1kb DNA Ladder购于生工生物(上海)有限公司。PrimeSTAR®Max DNA polymerase购自TaKaRa公司;四氢嘧啶标准品购于Sigma公司;菌株新喀里多尼亚弧菌CGJ02-2由中国科学院南海海洋研究所陈偿研究员提供;pBAD载体为本实验室保存;E.coliBW25113感受态购自上海维地生物公司。试验于2020年3月—2021年5月在中国热带农业科学院海口实验站进行。
1.1.2 主要仪器高速冷冻离心机(Thermo-Fisher,Sorvall legend Micro 21R)、恒温摇床(智诚,ZWY-2102)、电泳仪(Wix-EP600)、PCR仪(Ta-KaRa TP600)、凝胶成像系统(AlphaImager 2401)、纳升液相色谱-四极杆飞行时间串联质谱联用仪(Ekspertnano LC 425/Ultimate 3000/Q-trap 6500+AB sciex 6500+)。
1.2 方法
1.2.1 基因组DNA提取将菌株CJG02-2用
2216E(海博生物公司)培养基在30℃培养过夜,常温8 000 r·min-1离心5 min,收集菌体,按照Ta-KaRa微生物基因组DNA提取试剂盒(TaKaRaMini-BEST细菌基因组DNA提取试剂盒Ver.3.0)操作步骤,提取基因组DNA。
1.2.2 四氢嘧啶合成基因簇ectABC的克隆及重组表达载体的构建根据CGJ02-2全基因组测序结果,设计克隆ectABC基因簇的1对引物:EctF:5'-CTAGCTAGCATGATCACATCAGCACCTTGGGT C-3'和EctR:5'-CCGGAATTCTTAGTCAACGAGA GGATAAACACC-3'(下划线部分别为NheⅠ和EcoRⅠ酶切位点)。以菌株CGJ02-2全基因组DNA为模板,进行PCR扩增。扩增条件为:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸70 s,共35个循环;最后72℃延伸10 min。PCR胶回收产物和表达载体pBAD均用NheⅠ和EcoRⅠ进行双酶切,酶切产物回收后通过T4 DNA连接酶连接,连接产物转化大肠杆菌TOP10感受态,获得的重组子用双酶切鉴定,阳性克隆送生工生物工程(上海)股份有限公司进行测序分析。提取测序正确克隆中的质粒,转化表达宿主BW25113感受态细胞。
1.2.3 ectABC在大肠杆中的重组表达及鉴定将带有重组质粒pBAD ectABC的阳性克隆接种到含有氨苄青霉素的LB培养基中,37℃过夜。取适量过夜培养物加入LB培养基中(1∶100),37℃培养3 h,使其OD600为0.6。然后将L-阿拉伯糖添加到细菌培养物中使其终浓度为0.1%,30℃220 r·min-1诱导6 h。收集1 mL细菌培养液,4℃6 000 r·min-1离心5 min。将细胞用50μL 1×SDS上样缓冲液(BOSTER,AR1142)重新悬浮,并在沸水中煮10 min。然后将裂解液在12 000 r·min-1下离心10 min,取10μL上清液,用SDS-PAGE分析重组表达情况。阴性对照为未添加L-阿拉伯糖的重组菌株BW25113pBAD-ectABC培养产物和添加L-阿拉伯糖的菌株BW25113pBAD(空载体)培养产物。根据SDS-PAGE结果,从凝胶上切取重组表达蛋白条带,送上海交通大学分析测试中心,通过纳升液相色谱-四极杆飞行时间串联质谱联用仪鉴定其是否为ectA、ectB、ectC。
1.2.4 重组菌株全细胞催化生产四氢嘧啶参照1.2.3中的方法将重组菌株进行活化、扩大培养及L-阿拉伯糖诱导表达,8 h后,以7 000 r·min-1、4℃离心10 min,收集细胞,用0.85%NaCl溶液洗涤两次,然后再悬浮在含有100 mmol·L-1磷酸钠缓冲液(pH 7.0)、50 mmol·L-1天冬氨酸钠、50 mmol·L-1KCl和100 mmol·L-1甘油的反应混合物中,形成细胞悬浮液。使细胞悬液在30℃、120 r·min-1、24 h下进行催化反应。全细胞催化24 h完成后,9 000 r·min-1离心收获上清,用0.45 mm滤膜过滤后用型号为BRUKER compact的电喷雾四级杆飞行时间质谱分析四氢嘧啶的产生。质谱条件:扫描范围为m/z 50-1300,雾化器压力1.8 Bar,毛细管出口电压500 V,毛细管电压4 500 V,正离子化模式的电喷雾电离,碰撞能量7 eV,干燥气温度250℃。
1.2.5 全细胞催化的优化为了获得最佳的全细胞催化条件,在全细胞催化实验中,首先对底物天冬氨酸浓度(50~300 mmol·L-1)进行优化,在此基础上,分析了不同浓度KCl(0~300 mmol·L-1)转化液中四氢嘧啶的产率。然后在pH 7.0的情况下,比较了不同温度(25~40℃)对四氢嘧啶生产的影响。在获得最适温度的基础上,添加最适浓度底物和KCl,使生物转化在pH 6.0~8.0条件下进行,获取最适pH反应条件。所有的催化反应在细胞密度OD600=5的条件下进行,通过高效液相色谱法(high performance liquid chromatography,HPLC)检测四氢嘧啶的合成及其产量。HPLC分析检测条件为:色谱柱waters XBridge Amide,3.5μm,流动相B(乙腈)∶C(水)=75∶25,柱温30℃,波长210 nm。
1.2.6 数据处理采用Excel 2019进行数据整理,SPSS Statistics 22软件进行数据差异显著性分析。
2 结果与分析
2.1 四氢嘧啶合成基因簇etcABC的克隆及重组表达载体构建
以菌株CGJ02-2全基因组DNA为模板,EctF和EctR为引物进行PCR扩增,经1%琼脂糖凝胶电泳检测,发现PCR产物大小约为2 235 bp(图1),与预期的ectABC基因簇大小一致。目的片段与载体连接、转化后获得阳性克隆,双酶切鉴定显示重组质粒中有2 235 bp左右的片段插入(图2),测序后显示四氢嘧啶合成基因簇ectABC的长度和序列与理论一致。
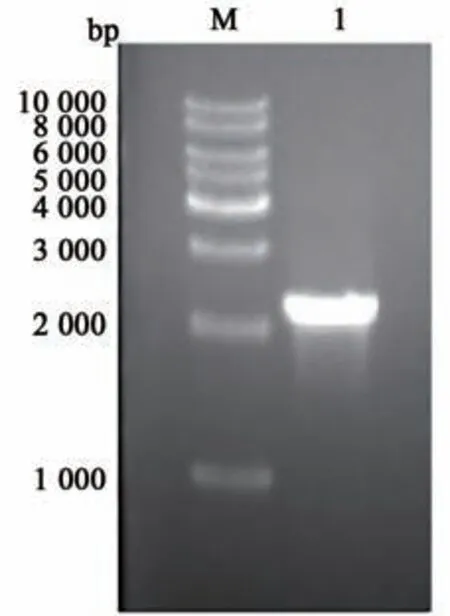
图1 四氢嘧啶合成基因簇etcABC PCR扩增Fig.1 PCR of etcABC gene cluster for ectoine
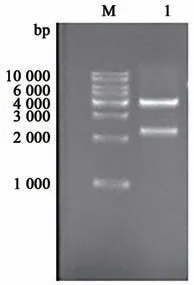
图2 重组质粒pBADetcABC的双酶切鉴定Fig.2 Identification of recombinant plasmid pBADetcABC by synthesis double restriction enzyme digestion
2.2 etcABC在大肠杆菌中的重组表达及鉴定
重组菌株BW25113pBAD-ectABC,经0.1%L-阿拉伯糖诱导表达后,采用SDS-PAGE电泳鉴定细胞裂解液上清,发现与含有pBAD空载体的菌株诱导以及含有重组表达载体pBAD-ectABC菌株未诱导细胞裂解液上清相比,产生了3个重组蛋白(图3)。其大小分别为15、40、13 kD左右,与ectA(20 kD)、ectB(45.9 kD)、ectC(14.8 kD)的理论值存在差异,可能的原因是某些亲水性的氨基酸与SDS结合率低造成了重组蛋白在电场中的泳动发生了偏移[18]。进一步应用飞行时间串联质谱联用仪测定了3个重组蛋白的分子量和氨基酸序列。结果显示其肽段覆盖率分别达94%、91%、74%。其相应的分子量分别为20.1、45.9和14.8 kD,与ectA、ectB、ectC的分子量理论值一致。
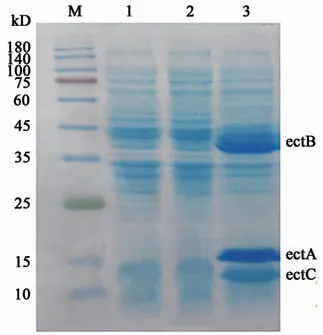
图3 SDS-PAGE分析ectA、ectB、ectC的重组表达Fig.3 SDS-PAGE analysis for the recombinant expression of ectA,ectB,ectC
2.3 重组菌株全细胞生产四氢嘧啶
利用高分辨质谱鉴定重组菌株BW25113 pBAD-ectABC诱导后全细胞上清中的四氢嘧啶,以重组菌株未诱导全细胞上清为阴性对照,四氢嘧啶标准品作为阳性对照。结果(图4)发现在诱导的重组菌株全细胞催化上清中,有一个化合物的分子量为143.079,分子式为C6H11N2O2。而标准品的分子量为143.080 5,分子式为C6H11N2O2,这表明重组菌株能够合成四氢嘧啶,并将其分泌到上清中。

图4 四氢嘧啶的高分辨质谱鉴定Fig.4 Identification of ectoine by high resolution mass spectrometry
2.4 天冬氨酸钠浓度对四氢嘧啶产量的影响
作为四氢嘧啶合成的底物,天冬氨酸的浓度是影响四氢嘧啶产量的重要因素。因此,首先研究了不同浓度天冬氨酸钠对四氢嘧啶产量的影响。如图5所示,随着天冬氨酸钠浓度的升高,四氢嘧啶产量呈先升高后下降的趋势。当天冬氨酸钠浓度达100 mmol·L-1时,四氢嘧啶产量最高,为0.86 mg·mL-1,与其他各浓度下生成的四氢嘧啶产量差异显著(P<0.05)。当天冬氨酸钠浓度达到200 mmol·L-1时,四氢嘧啶产量逐步下降,当天冬氨酸钠浓度为300 mmol·L-1时,四氢嘧啶的产率仅为0.52 mg·mL-1。因此,天冬氨酸钠的最佳浓度为100 mmol·L-1。
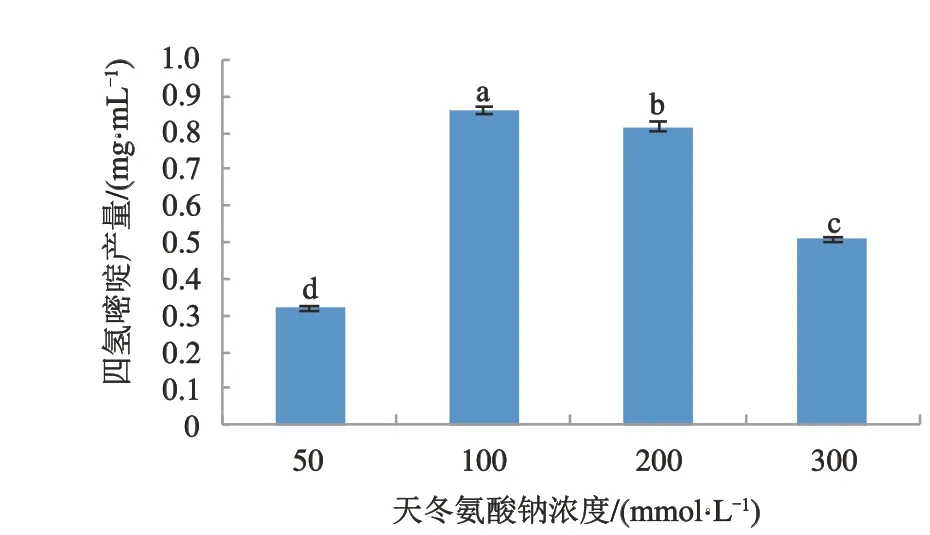
图5 天冬氨酸钠浓度对四氢嘧啶产量的影响Fig.5 The effect of sodiumasparpate concentration on the yield of ectione
2.5 KCl浓度对四氢嘧啶产量的影响
由于KCl浓度对EctB活性的稳定性有影响,试验分析了不同浓度KCl对四氢嘧啶产量的影响。如图6所示,随着KCl浓度的提高,四氢嘧啶产量随之升高,当KCl浓度为100 mmol·L-1时,四氢嘧啶产量达到最大值0.95 mg·mL-1。当浓度大于100 mmol·L-1时,四氢嘧啶产量随之降低。不同浓度KCl对四氢嘧啶产量的影响差异显著(P<0.005),KCl的最佳浓度为100 mmol·L-1。
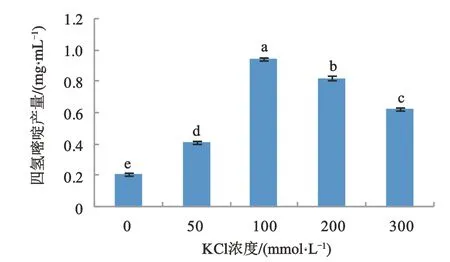
图6 KCl浓度对四氢嘧啶产量的影响Fig.6 The effect of KCl concentration on the yield of ectione
2.6 温度对四氢嘧啶产量的影响
为了了解温度对四氢嘧啶合成的影响,试验在最适天冬氨酸浓度和KCl浓度的基础上,采用不同温度对全细胞进行催化。结果如图7所示,25℃时,四氢嘧啶的产率较低,随着温度的提高,四氢嘧啶产量明显升高,但随之也呈现出下降趋势。当温度为30℃,四氢嘧啶的产量最高,为0.94 mg·mL-1。虽然温度为35℃时,四氢嘧啶产量与30℃时四氢嘧啶产量无统计学差异(P>0.05),考虑到能耗原因,选择全细胞催化生产四氢嘧啶的最佳温度为30℃。
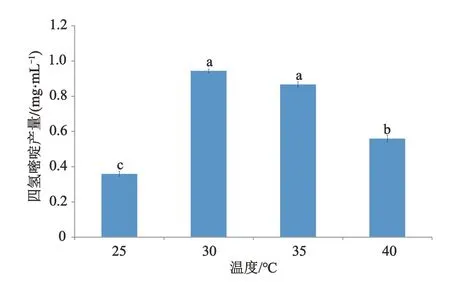
图7 温度对四氢嘧啶产量的影响Fig.7 The effect of temperature on the yield of ectione
2.7 pH对四氢嘧啶产量的影响
由于不同pH会影响酶活性,因此在确定最适底物浓度、KCl浓度、最适温度的基础上,探究了pH对四氢嘧啶产量的影响。如图8所示,随着pH的提高,四氢嘧啶产量同样表现出先升高后降低的趋势,且大部分pH对四氢嘧啶产量的影响差异显著。当pH为7.0时,四氢嘧啶产量最高,达1.11 mg·mL-1。然而pH高于7.5后产量下降,当pH为8.0时,四氢嘧啶产量为0.8 mg·mL-1。因此,pH 7.0是全细胞催化生产四氢嘧啶的最适pH。
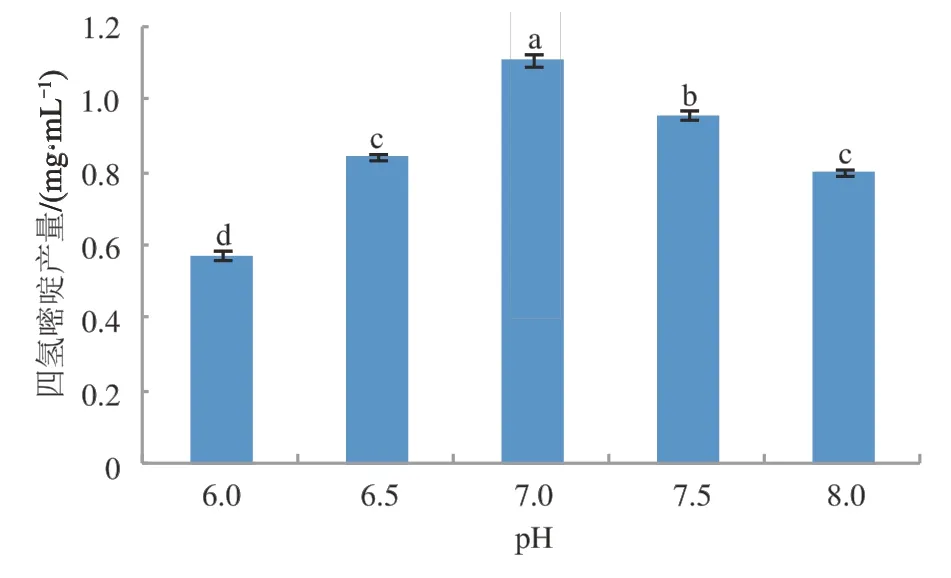
图8 pH对四氢嘧啶产量的影响Fig.8 The effect of pH on the yield of ectione
2.8 最适条件下四氢嘧啶产量
在 天 冬 氨 酸 浓 度100 mmol·L-1,KCl浓 度100 mmol·L-1,温度30℃,pH7.0的最优条件下,测得四氢嘧啶的产量为1.11 mg·mL-1。
3 讨论
自发现四氢嘧啶以来,广泛应用于医学领域、酶工业、化妆品领域,国内外的科学家们在其生物合成途径及制备方法方面开展了大量的研究。目前,人们已经从链霉菌、盐单胞菌等多种嗜盐菌中克隆了四氢嘧啶合成基因簇ectABC[18-21],并且通过重组表达载体,将它们导入大肠杆菌中表达,实现了四氢嘧啶在低盐环境下的重新合成。但研究发现不同来源的ectABC通过重组表达后,合成四氢嘧啶的能力有显著差异,如高波[22]从Streptomyces pactumAct12分离出ectABC,通过pET28a在大肠杆菌BL21中表达,重组菌株的四氢嘧啶产量较低,仅为0.437 mg·mL-1。张欣[23]从HalomonasspQHL1中分离的ectABC也通过pET28a在大肠杆菌BL21中表达,四氢嘧啶产量达1.109 mg·mL-1。Schuben等[24]从Chromohalobacter salexigens中获得ectABC,通过pASK-IBA7在大肠杆菌DH5α中表达,重组菌株四氢嘧啶合成量高达5.9 mg·mL-1。因此克隆新的四氢嘧啶合成基因簇,以探索其在异源宿主低盐环境下四氢嘧啶的产量,仍是研究的热点。
Naughton等[25]通过生物信息学分析发现,包括新喀里多尼亚弧菌的10类弧菌中含有ectABC基因簇,但是从弧菌中克隆ectABC,并在大肠杆菌中实现异源表达及合成四氢嘧啶,尚未有报道。本研究从弧菌中获得的四氢嘧啶合成基因簇ectABC,通过pBAD表达载体在BW25113中实现异源表达,且在最佳全细胞催化条件下,当细胞密度OD600为5时,获得的重组菌株四氢嘧啶合成量为1.11 mg·mL-1。与一些高产四氢嘧啶菌株相比,本研究获得的重组菌株四氢嘧啶产量略低,但要远高于高波[22]、魏伟伟[26]等构建的ectABC重组菌株产量。产生这一结果的原因可能是不同来源的嗜盐菌中ectABC基因簇编码ectA、ectB、ectC蛋白序列存在差异。序列分析显示本研究中ectA、ectB、ectC与其他细菌来源ectA、ectB、ectC的同源性在60%以下,这可能导致重组表达的ectA、ectB、ectC蛋白酶活性存在差异,从而影响四氢嘧啶的合成。陈永涛等[27]的研究结果也显示,不同来源的ectABC簇构建的工程菌株生产四氢嘧啶,产量之间有显著的差异。此外,全细胞催化时细胞密度对四氢嘧啶的合成也有影响。如He[28]等研究发现,将来自Halomonas elongata的ectABC通过全细胞催化,当发酵罐中细胞密度OD600为5时,产量达到2.67 mg·mL-1,当细胞密度OD600为20时,产量达到了25.1 mg·mL-1。因此,下一步将通过发酵罐来生产四氢嘧啶,并探讨细胞密度对四氢嘧啶产量的影响,同时也将开展分离纯化实验,为工业化生产四氢嘧啶奠定基础。

