柴油和镉污染对土壤酶活性和微生物数量的影响
何紫晨,胡雪峰,陆思文,赵景龙,兰国俊,李梅,张伟杰
(上海大学环境与化学工程学院,上海 200444)
随着城市化进程加快,道路交通越来越发达,机动车数量逐年增多,对石油的开采和使用量也越来越大.在采油、炼油、运输和使用过程中,石油难免会滴漏在附近土壤上造成污染[1].柴油是一种常见的石油产品,是由烷烃、环烷烃、烯烃和一环至多环芳烃(polycyclic aromatic hydrocarbons,PAHs)组成的一种复杂化合物[2].此外,受工矿业三废排放、大气沉降以及农业面源污染等影响,土壤还会受到重金属污染,如重金属镉[3].2014年4月,全国土壤污染状况调查公报显示,全国土壤各种污染物总超标率为16.1%,其中石油烃和PAHs污染土壤的超标率达23.6%,土壤镉超标率达7%,土壤质量不容乐观[4].
柴油等石油类污染物进入土壤后,会堵塞土壤孔隙,大大降低土壤的透气性和透水性,使土壤微生物群落发生变化,破坏土壤微生态环境[5].土壤镉污染的危害主要表现在两个方面:镉在农作物中富集,并随食物链进入人体;镉通过地表径流进入天然水体,在鱼类体内富集,并经食物链进入人体.进入人体内的镉在积累到一定量后会对人体造成一系列的危害[6].
土壤酶是土壤的重要组分,主要由土壤微生物分泌产生[7].土壤酶分为胞内酶和胞外酶,是一类具有催化能力的生物活性物质[8],能够提高土壤的物质传递和能量转换效率,与土壤养分的有效利用息息相关[9].土壤酶活性对土地利用方式的改变、土壤有机质,以及其他土壤性质的变化十分敏感[10].土壤酶活性能够反映土壤中所进行的各种生物化学过程的方向和强度[11],因此可作为反映土壤质量的敏感指标[12].已有研究表明,土壤酶活性会受到柴油和重金属污染的影响[1,13],但实验结果常有差异.上海地区工业发达,部分土壤受到油类和重金属污染,因此进一步研究土壤酶活性对油类和重金属污染的响应十分重要.本工作通过盆栽实验,研究了不同浓度的柴油污染、镉污染以及柴油+镉复合污染对土壤酶活性及微生物数量的影响,为进一步分析不同土壤污染下的微生物生态效应提供了依据.
1 材料和方法
1.1 实验材料
实验土壤采自上海市青浦区金泽镇沙岗村“教授农场”(31°7′22.47′′N,120°52′56′′E).该处土壤无明显工业污染源,且经过了7年有机农业标准化管理.采集耕作层(0~20 cm)土壤,自然风干后,磨细,过10目土壤筛.实验用0号柴油购自上海大学宝山校区附近加油站.实验用氯化镉(分析纯)购自国药集团上海化学试剂有限公司.实验用番茄苗为自主培育1个月的幼苗,品种为黄金番茄.实验土壤的基本理化性状和土壤颗粒组成的测定参照《土壤调查实验室分析方法》[14],结果如表1和2所示.

表1 盆栽实验所用土壤的基本理化性状Table 1 Physical-chemical properties of the soil used for the pot experiment

表2 土壤颗粒组成和质地名称Table 2 Soil particle composition and texture name
1.2 实验设置
梁小翠等[15]利用市售0号柴油,分别设置低质量比2 g/kg、中质量比10 g/kg、高质量比50 g/kg,模拟了PAHs污染对土壤酶活性的影响.沈秋悦等[16]分别设置镉质量比为1.0、5.0、10.0、30.0 mg/kg对土壤进行处理,研究了镉污染对土壤微生物活性的影响.本实验借鉴大量前人工作,共设置7个处理组,分别为对照(CK)、低量柴油(CYL)、高量柴油(CYH)、低量镉(CdL)、高量镉(CdH)、高量柴油+高量镉(CYH+CdH)和高量柴油+高量镉+种植番茄苗(CYH+CdH+P)(见表3),每个处理组设置3个重复.2019年8月22日,将事先均匀磨细并过2 mm筛子的土壤装入高11.5 cm、内径13.5 cm的花盆中,并按不同处理剂量(见表3)均匀拌入柴油或氯化镉溶液.模拟实验污染物加入土壤后,通常需要一定时间的稳定老化.梁小翠等[15]在研究柴油对土壤酶活性的影响时,将柴油和土壤充分拌匀后稳定了48 h.杨惠芳等[17]在研究单甲脒农药对土壤微生物和酶活性的影响时,于喷洒农药后的第2天才开始实验.本实验借鉴前人经验,待污染物与土壤稳定一夜后,于次日早上,采集第一批土壤鲜样.之后每隔一周采集一次,测试土壤酶活性和微生物数量.

表3 盆栽实验的不同处理设置Table 3 Different treatments of the pot experiment
1.3 土壤脲酶和脱氢酶活性的测试
土壤酶活性的测试方法参考了《土壤酶及其研究法》[18].采用苯酚钠比色法检测土壤脲酶活性,以24 h后100 g干土中NH3-N的mg数表示.采用三苯基氯代四氮唑(triphenytetrazoliumchloride,TTC)还原法检测土壤脱氢酶活性,以24 h后1 g干土中产生三苯基甲(triphenyl formazan,TPF,TTC的还原性产物)的μg数表示.每一批土样采用重量法检测其含水率.
1.4 土壤微生物的培养和计数
土壤微生物的检测采用稀释涂布平板法[19].用无菌水将土壤鲜样稀释成10-1、10-2、10-3、10-4,10-55个梯度.用营养琼脂培养基、改良高氏一号培养基和孟加拉红培养基分别培养细菌、放线菌和真菌.对培养基上的菌落计数,计算出每克干土中这3种微生物的数量.
1.5 实验仪器
本实验使用仪器有721G型可见分光光度计、PHS-3C型pH计、生化培养箱.
1.6 数据处理
本实验数据使用Microsoft Excel 2016处理,差异性和相关性分析通过IBM SPSS Statistics 24实现,柱状图用Origin Pro 2017C 64Bit绘制.
2 实验结果
2.1 不同处理下的土壤脲酶活性
盆栽实验所得土壤脲酶活性的变化结果如图1所示,其中柱状数据标注相同字母的两个数据不存在显著差异(p>0.05);标注不同字母的两个数据存在显著差异(p<0.05),下同.可以看出:在实验的第8天,CYH和CYH+CdH+P处理组的土壤脲酶活性显著高于CK和其他处理组(p<0.05);在第15天,CYH处理组显著高于CK组(p<0.05),但与CYH+CdH和CYH+CdH+P处理组无显著差异(p>0.05);在第22天,CYH+CdH+P处理组显著高于CK组(p<0.05),但与CYH和CYH+CdH处理组无显著差异(p>0.05).总的来看,CYH、CYH+CdH和CYH+CdH+P处理组的土壤脲酶活性明显高于CK和其他处理组;在实验期,CYH处理组平均分别是CK组的1.14倍、5.25倍、3.77倍和2.18倍,CYH+CdH处理组分别是CK组的1.50倍、1.62倍、2.63倍和2.53倍,CYH+CdH+P处理组分别是CK组的1.42倍、5.24倍、2.36倍和3.46倍.

图1 不同处理下的土壤脲酶活性Fig.1 Urease activity of the soil for the different treatments
在实验开始的第1天,CdL和CdH处理组的土壤脲酶活性低于CK组;但在随后的实验期,CdL、CdH和CYL处理组的土壤脲酶活性始终与CK组接近,无显著差异(p>0.05).
2.2 不同处理下的土壤脱氢酶活性
盆栽实验所得到的土壤脱氢酶的活性变化,与土壤脲酶活性有很大差异,结果如图2所示.可见:在整个实验期,CYL、CYH、CYH+CdH和CYH+CdH+P处理组的土壤脱氢酶活性多显著低于CK组(p<0.05);在第15天,CYL和CYH+CdH+P处理组的土壤脱氢酶活性低于CK组,但未达显著差异水平(p>0.05);CYL处理组的土壤脱氢酶活性多高于CYH、CYH+CdH、CYH+CdH+P处理组,且在实验的第1天和第22天,显著高于CYH和CYH+CdH组(p<0.05);在整个实验期,CYH+CdH+P处理组的土壤脱氢酶活性均高于CYH和CYH+CdH处理组,但未达到显著差异(p>0.05).

图2 不同处理下的土壤脱氢酶活性Fig.2 Dehydrogenase activity of the soil for the different treatments
在实验的第1~15天,CdL处理组的土壤脱氢酶活性基本与CK组相近;但在第8天,CdL处理组的土壤脱氢酶活性显著高于CK和CdH处理组(p<0.05);在第15天,CdL处理组的土壤脱氢酶活性显著低于CdH处理组(p<0.05),且在实验第22天显著低于CK组;在第15天和第22天,CdL处理组的脱氢酶活性分别为CK组的95%和49%,CdH处理组的活性分别只有CK组的42%和65%;除第15天外,CdL和CdH处理组的土壤脱氢酶活性均显著高于CYH和CYH+CdH处理组(p<0.05).
2.3 不同处理下的土壤微生物种群和数量
盆栽实验结束时,对土壤微生物种群和数量进行检测,结果如图3所示.可以看出:不同处理组的土壤微生物种群数量特征有较相似的变化趋势;土壤细菌数量最多,占微生物总数的79.28%~99.19%;放线菌数量次之,占微生物总数的0.76%~19.54%;真菌数量最少,占微生物总数的0.06~1.38%.
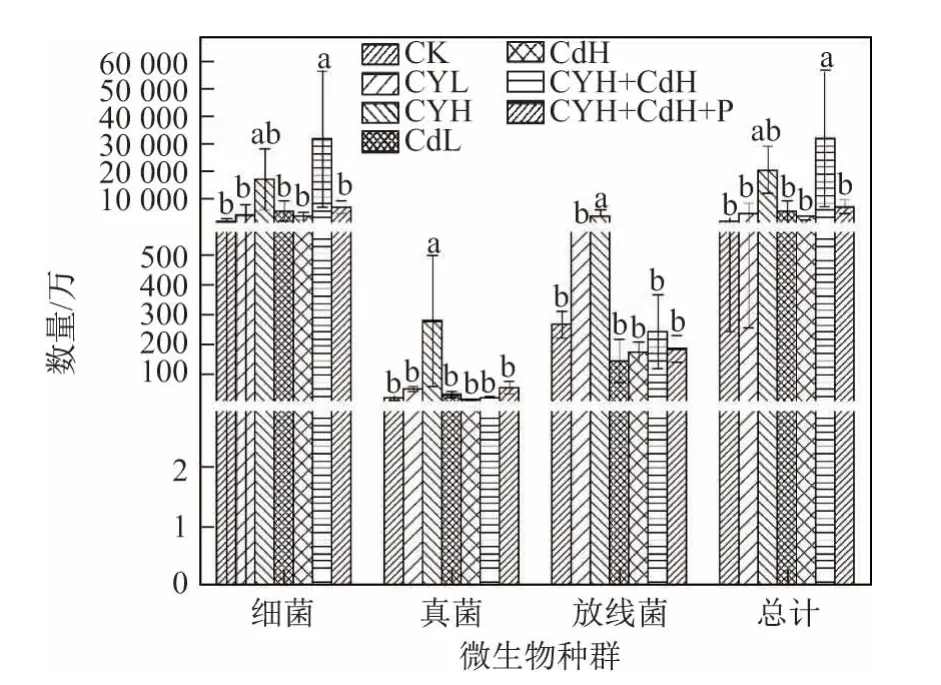
图3 不同处理下的土壤微生物种群和数量Fig.3 Types and numbers of microbes in the soil for the different treatments
CYH和CYH+CdH处理组的土壤细菌数量高于CK和其他处理组,且CYH+CdH处理组与CK组差异性显著(p<0.05).CdL、CdH和CYH+CdH+P处理组的细菌数量与CK组接近.CYH处理组的土壤放线菌数量显著高于CK和其他处理组.CYL和CYH处理组的土壤真菌数量高于CK和其他处理组,其中CYH处理组的土壤真菌数量显著高于CK和其他处理组(p<0.05).这表明柴油的添加,尤其是高量柴油的添加,对各类微生物均有一定的激活效应.这与柴油处理(见CYL和CYH处理组)后土壤脲酶活性的增加相对应,但对真核微生物的效应不明显.镉的添加(见CdL和CdH处理组)对放线菌有一定的抑制效应.但总体来看,柴油与镉对各类微生物的影响均未达到显著效应.
3 讨论
脲酶是一种微生物细胞外的酰胺酶[20],参与土壤中的氮素循环.它将有机氮化合物转化成无机氮,如将尿素降解成氨[21],供植物利用.姜必亮等[22]在研究含较高浓度有机物、重金属离子的垃圾渗滤液时发现,土壤脲酶对其反应敏感.他们将镉质量浓度为0.011 mg/L的垃圾渗滤液稀释50%后用于灌溉,发现土壤和黏土的脲酶活性均显著增强.Dindar等[23]在研究石油烃污染土壤中酶活性的变化时发现,废机油和原油污染土壤中的酶活性整体高于对照组.沈国清等[24]的研究也表明:在实验第49天,重金属和多环芳烃复合污染的土壤脲酶活性被激活;当Cd质量比为12.8 mg/kg,菲、荧蒽、苯并[a]芘的质量比均为0.8 mg/kg时,脲酶活性提高了115.6%;当镉质量比为0.8 mg/kg,菲、荧蒽、苯并[a]芘的质量比均为0.2 mg/kg时,脲酶活性提高了150.4%.柴油中常见的多环芳烃为菲、荧蒽、苯并[a]芘等[25],这与本实验中柴油或柴油+镉复合污染刺激土壤脲酶活性增加的结果十分相似.在本实验中,CYH、CYH+Cd和CYH+Cd+P处理组的土壤脲酶活性多显著高于CK组(p<0.05,见图1).这说明土壤柴油和柴油+镉复合污染不仅不能抑制脲酶活性,反而刺激了脲酶活性的增加.此外,CYL处理组的土壤脲酶活性始终低于CYH、CYH+CdH和CYH+CdH+P处理组.这说明柴油污染量大,反而有利于脲酶活性的增加.
在实验第1天,CdH和CdL处理组的土壤脲酶活性显著低于CK和其他处理组.这显然是由于土壤受镉毒害影响,抑制了脲酶活性.但在随后的不同阶段,不同质量浓度的镉对土壤脲酶活性不再产生显著影响.这说明土壤脲酶对镉的毒害有一定的抗性.沈国清等[24]的研究发现,镉+菲复合污染对土壤脲酶活性表现为协同作用,且除了锌和苯并[a]芘之间表现为拮抗作用外,多环芳烃无论是单污染还是与重金属复合污染,均对土壤酶活性有激活作用.在本实验中后期,CYH+CdH处理组的土壤脲酶活性不断升高,最后甚至高于CYH处理组.这表明柴油和镉复合污染对土壤脲酶活性反而有更好的促进效应.在实验中期(第8天),CYH+CdH+P处理组的土壤脲酶活性接近CYH处理组,显著高于其他处理组(p<0.05);随后有所下降,并在实验后期,高于其他处理组.这说明在污染土壤栽种作物能有效缓解毒害,增加脲酶活性.
脱氢酶是土壤微生物呼吸作用的主要酶[26],能活化被氧化有机物的氢原子并传递给特定的受氢体[27].在本实验中,柴油和镉对土壤脱氢酶活性的影响与脲酶完全不同.在整个实验期,柴油(CYL、CYH)和柴油+镉(CYH+CdH、CYH+CdH+P)处理组的土壤脱氢酶活性均显著低于CK组(p<0.05).这表明柴油和柴油+镉复合污染会抑制土壤脱氢酶活性.CYL处理组的脱氢酶活性多显著高于CYH和CYH+CdH处理组(p<0.05).这表明柴油量的增加以及柴油+镉复合污染对脱氢酶活性的抑制作用更强.CYH+CdH+P处理组的脱氢酶活性稍高于CYH和CYH+CdH处理组(见图2).这说明该作物在一定程度上能缓解柴油和镉对脱氢酶的毒害,原因可能是由于番茄苗对柴油的吸附作用使氢受体的数量减少,从而使TTC的还原产物TPF的产量增加,即脱氢酶的活性增加[28-29].
镉单独污染对脱氢酶活性的影响有些复杂.在CdL处理组,实验初期(第8天)的脱氢酶活性反而增加,显著高于CK及其他处理组(p<0.05,见图2);之后又下降,直至实验后期与其他处理组一样,显著低于CK组(p<0.05,见图2).与之不同,CdH处理组的脱氢酶活性接近CK组,至实验后期显著低于CK组.这说明镉对土壤脱氢酶的毒害弱于柴油,且低浓度的镉可能对脱氢酶还有激活效应.镉对土壤脲酶和脱氢酶均有毒害[30-31].张平等[32]对衡阳市铅锌矿区土壤酶活性的研究发现,镉对土壤脱氢酶的活性有抑制作用.湖南矿区水稻土受镉污染影响,脱氢酶活性也有显著降低[33].但也有研究认为,随着土壤镉浓度的增加,对水稻根系脱氢酶活性的抑制并非持续增强,有时反而会刺激酶的活性.比如,在紫色土污染实验中,当镉质量比为0.5 mg/kg时,脱氢酶活性高于对照;而当镉质量比增加至1 mg/kg时,脱氢酶活性又低于对照;当镉质量比继续增加时,脱氢酶活性先略有降低,之后反而持续增加;当镉质量比增加至100 mg/kg时,脱氢酶活性最大;当镉质量比再继续增加时,脱氢酶活性又开始降低[34].因此,镉对土壤脱氢酶活性的影响比较复杂,需作进一步深入研究.
土壤微生物在土壤生态系统中发挥着重要作用,是土壤物质循环中最重要的组成部分,直接参与土壤中有机质的分解和养分循环转化过程,影响作物对营养元素的吸收[35].因此,微生物数量可以作为土壤健康和土壤质量变化的重要指标[36].本实验表明,高量柴油和高量柴油+镉复合污染均会增加土壤细菌的数量,且后者达到显著水平(p<0.05);低量柴油处理能显著增加真菌的活性(p<0.05);柴油污染还能显著增加放线菌的数量(p<0.05,见图3).但本实验同时发现,镉单独污染土壤时对土壤微生物种群和数量的影响不明显(见图3).总体上看,柴油污染会增加土壤中各类微生物的数量,与土壤脲酶活性增加的趋势相关联,且实验各阶段土壤微生物数量和脲酶活性有显著相关性(r=0.585,p<0.01).土壤油类污染反而会导致微生物数量增加的报道有很多.Tao等[37]的研究发现,原油污染的土壤在室温(20°C)培养30 d后,微生物生物多样性指数有所增加,且土壤中碳氢化合物的去除率达34.7%.李慧等[38]在对沈阳、抚顺污灌区的石油污染状况调查时发现,含油污水能够刺激土壤微生物群落的生长.张晶等[39]的研究发现,含油污水灌溉后,东北旱田土壤的微生物数量随着石油烃含量的增加而增加.江伟等[40]的研究发现,当镉质量比为10 mg/kg时,土壤微生物活性明显增加.Baran等[41]指出,原油等多环芳烃类化合物进入土壤后会刺激土壤微生物活性,微生物逐渐适应并利用原油等多环芳烃类化合物作为碳源和能源.
4 结束语
盆栽实验表明,土壤脲酶和脱氢酶活性对土壤柴油、镉和柴油+镉复合污染有不同的反应.当受到高量柴油污染或高量柴油+镉复合污染时,土壤脲酶活性反而显著增加,微生物数量也有相应增加.高量、低量柴油污染或高量柴油+镉复合污染对土壤脱氢酶活性有抑制作用;但镉单独污染对土壤脱氢酶活性的影响较小,低质量比镉甚至对脱氢酶有一定激活效应.

