新型好氧W1-2菌株降解四溴双酚A的性能
(上海大学环境与化学工程学院,上海 200444)
杨书娴,胡星
四溴双酚A(tetrabromobisphenol A,TBBPA)是一种人工合成的多溴化合物,因具有高化学惰性、高热稳定性和易于合成等特性,常作为阻燃剂被广泛应用于纺织产品、电子产品和塑料制品之中,其生产量一度占到了全部溴代阻燃剂的59%[1].然而,TBBPA一旦被释放到环境中,又会因其具有高亲脂性和难分解性而富集在水生生物体、沉积物和土壤之中,成为一种污染环境的持久性有机污染物(persistent organic pollutants,POPs)[2-3].与此同时,TBBPA已被证实对人体具有免疫毒性、细胞毒性和神经毒性[4-5].因此,有效去除环境中的TBBPA,是降低其污染环境和危害人体健康风险的首要选择.微生物技术因其经济、环境友好和效果显著等特点,已成为当下TBBPA去除领域的研究热点.
已有研究发现,能够降解双酚A(bisphenol A,BPA)或多氯联苯(polychlorinated biphenyls,PCBs)这类POPs的功能菌株也能转化TBBPA,但这种转化耗时长且易导致大量甲基醚-TBBPA的富集,难以达到有效去除环境中TBBPA的目的[6-7].迄今已发现了几种降解TBBPA的功能菌株,如假单胞菌(Pseudomonassp.)[8]、从毛单胞菌(Comamonassp.)[9]、红球菌(Rhodococcussp.)[10]、甲基杆菌(Methylobacteriumsp.)[11]和链球菌(Streptococcussp.)[12]等.但因受到菌株是好氧降解菌还是厌氧降解菌这一基本特性的影响,这些菌株在降解效率、降解途径、降解产物等方面存在很大差异.厌氧菌株对TBBPA的降解途径主要为脱溴反应,耗时长且易累积BPA之类毒性更高的中间产物[13-14].好氧菌株对TBBPA的降解更为迅速,且通过脱溴和β-断裂两种方式使降解更为彻底[15].由此可见,利用具有降解TBBPA功能的好氧菌株,是高效去除环境中TBBPA的最佳技术途径.例如,好氧菌株苍白杆菌T(Ochrobactrumsp.T)在35°C、pH=7的条件下,3 d后对3 mg/L TBBPA有86.7%的降解率[15].另一株假单胞菌fz(Pseudomonassp.fz)可以在外加碳氮源牛肉膏和蛋白胨的条件下,对10 mg/L TBBPA有80%的降解率[16].
本研究以好氧活性污泥为菌源,以期通过长期驯化筛选分离出一株可以在无其他碳源辅助条件下,仍具有高效降解TBBPA能力的好氧菌株.通过探究该菌株的基因类别、pH值、初始浓度、温度以及转速对降解特性的影响等,进一步揭示了该菌株的生理、生化以及降解特性,并初步推断了其实际应用潜力.
1 材料和方法
1.1 试剂和培养基
TBBPA(CAS No.79-94-7)购自上海泰坦科技股份有限公司.其余化学试剂购自国药集团上海化学试剂有限公司,其中用于高效液相色谱(high performance liquid chromatography,HPLC)仪器分析的甲醇为色谱级.
TBBPA母液:将TBBPA用甲醇溶解,制备成质量浓度为2 000 mg/L的母液,并置于4°C冰箱中黑暗密封储存.
无机盐液体培养基(MSL):K2HPO43.0 g,KH2PO41.5 g,(NH4)2SO41.0 g,NaCl 1.0 g,MgSO43.2 mg,CaCl20.8 mg,MnSO40.8 mg,FeSO40.8 mg,H2O 1 L,调节pH=7.无机盐固体培养基(MSS)需在MSL的基础上添加15~20 g琼脂粉.添加了TBBPA的MSL和MSS分别记为MSLT和MSST.
牛肉膏蛋白胨培养基:蛋白胨10 g,牛肉浸膏5 g,NaCl 5 g,H2O 1 L,调节pH=7.
1.2 菌株的获得
作为菌源的好氧活性污泥取自上海石洞口污水处理厂.取100 mL含10 mg/L TBBPA的MSLT及10 mL活性污泥置于250 mL锥形瓶中,于30°C、150 r/min的振荡箱里避光培育.7 d后,移取10 mL培养液至新鲜的含20 mg/L TBBPA的MSLT中,并在相同条件下培养驯化.之后,以每7 d增加10 mg/L TBBPA的速率逐步将MSLT中TBBPA的质量浓度增至50 mg/L.
菌株在含50 mg/L TBBPA的MSLT中继续驯化3周后,取100μL稀释了105倍的培养液均匀涂布在含50 mg/L TBBPA的MSST上,并在28°C下避光培养4 d.挑选生长形态明显的单菌落,在上述MSST上反复纯化5次,选出生长态势良好的菌落避光保存在4°C的斜面上.最后,将OD600=1.0的菌液接种入含或不含20 mg/L TBBPA的MSLT中,考察菌株的生物量,以确定最终的实验菌株.
1.3 菌株的鉴定
提取菌株的基因组DNA,并进行聚合酶链式反应(polymerase chain reaction,PCR),其中16S rDNA的引物为27f(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492R(5’-TACGGYTACCTTGTTACGACTT-3’).反应条件如下:95°C预变性5 min;95°C变性30 s,55°C退火30 s,72°C延伸1 min,共进行35个循环;72°C延伸10 min.所得的菌株基因序列利用NCBI GenBank数据库进行BLAST比对以确定种属,再通过MEGA 6.0软件与已知的和相关的菌株采用邻位相连(neighbor-joining)方法构建系统发育树.
1.4 菌株的降解
将菌株接种于牛肉膏蛋白胨培养基中,在30°C、150 r/min的条件下培养24 h.培养液经6 000 r/min离心6 min,收集菌体并用无菌水清洗3次,最后配制成菌悬液(OD600=1.0)[17].
菌悬液以10%的量接种于20 mL含20 mg/L TBBPA的MSLT(编号R1)中,同时制备不含菌株(无菌水替代,编号R2)和添加热处理菌株(121°C、100 kPa条件下灭活20 min,编号R3)的实验组作为对照,并在30°C、150 r/min条件下培养,以期确定菌株对TBBPA的降解模式.
分别改变单一条件,如TBBPA初始质量浓度(0、15、20、30 mg/L)、pH值(5、6、7、8、9)、温度(25、30、35°C)和转速(0、100、150、200 r/min),进行菌株降解TBBPA的实验(默认条件均为20 mg/L TBBPA、pH=7、30°C、150 r/min),研究菌株对TBBPA的降解特性.
以上每组实验平行进行3次.
1.5 HPLC分析
在HPLC检测前将样品的pH值统一调至9,以确保完全溶解残余TBBPA,从而提高检测准确度[15].溶液离心后所得上清液用0.22μm的滤膜过滤,之后进行HPLC(LC-20A,日本岛津公司)检测.检测条件如下:290 nm;C18色谱柱(4.6 mm×250 mm,5μm);流动相组分比为甲醇∶水=80%∶20%;流速为1 mL/min;柱温为35°C;进样量为10μL.
1.6 降解率的计算
菌株对TBBPA降解率的计算公式为

式中:C0(mg/L)为初始(t=0)质量浓度;Ct(mg/L)为t时刻的质量浓度.
2 结果与讨论
2.1 菌株的理化特征
2.1.1 TBBPA降解菌株的获得
经TBBPA为唯一碳源和能源的驯化后,分离纯化得到了多株能在含50 mg/L TBBPA的MSST中生长的菌株,并将其中长势最好的一株菌株命名为W1-2.由图1可见,该菌株在含20 mg/L TBBPA的MSLT中好氧培养5 d后,其溶液浊度(见图1(d))明显高于无TBBPA(见图1(c))和无菌株(见图1(b))的对照组.这表明W1-2菌株可以利用TBBPA为唯一碳源生长.同时,在MSST平板上菌株为乳白色(见图1(a)),而在MSLT中则为粉红色(见图1(d)).这表明该菌株的外观会随培养条件的不同而发生色彩上的明显变化.

图1 有或无TBBPA环境下W1-2菌株的生长Fig.1 Images of strain W1-2 cultured in the medium with or without TBBPA
2.1.2 W1-2菌株的鉴定
通过比对W1-2菌株的16S rDNA序列,选取了比对结果近似的菌株序列,以及已知TBBPA降解菌株的序列,构建了系统树(见图2).
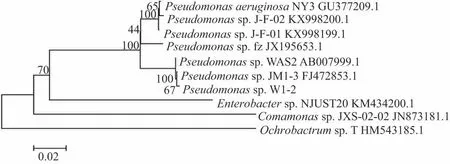
图2 W1-2菌株与近似菌株及其他TBBPA降解菌株的系统发育树Fig.2 Phylogenetic analysis of strain W1-2 with its related strains and other TBBPAdegrading strains
如图2所示,W1-2菌株与Pseudomonassp.JM1-3和Pseudomonassp.WAS2有99.3%的相似度,因此,W1-2菌株属于假单胞菌属(Pseudomonassp.).同时,革兰氏染色结果表明,W1-2是一株革兰氏阴性菌株.Xie等[18]认为在TBBPA污染环境下,TBBPA只会抑制土壤中革兰氏阳性菌的生长.这一结论有力地支持了本研究获得的革兰氏阴性TBBPA降解菌的可靠性.同时,假单胞菌属的其他菌株也在环境修复过程中,对POPs(PCBs[19]、菲[20-21]、2-对溴硝基苯[22])的生物降解起到重要作用.
虽然已知的具有降解TBBPA功能的好氧菌株fz和NY3,以及厌氧菌株J-F-01和J-F-02也都属于假单胞菌属,但它们与W1-2菌株序列的相似度分别为95.8%、95.6%、96.3%和96.0%[12,23-24].通常,当16s rDNA序列的相似度低于97.0%时,该菌株可以确定属于一个新的种类.基于以上分析,Pseudomonassp.W1-2应是一株具有TBBPA降解功能的新型菌株.
2.1.3 W1-2菌株降解TBBPA的模式
本研究以R1和R2两组实验作为对照,探讨了W1-2菌株降解TBBPA的模式,结果如图3所示,其中折线数据标注相同字母的两个数据不存在显著差异(p>0.05);标注不同字母的两个数据存在显著差异(p<0.05),下同.可见,5 d内TBBPA质量浓度的变化顺序为R1>R3>R2.由于R2中TBBPA的质量浓度基本没有变化,表明实验过程中各种已知和未知的因素并不会影响TBBPA的质量浓度.
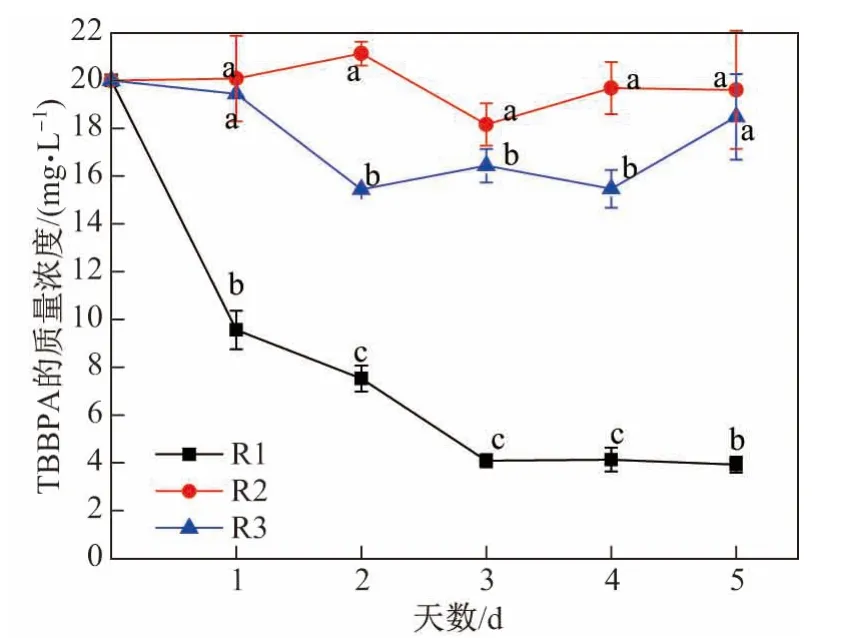
图3 20 mg/L TBBPA在R1、R2和R3实验中的质量浓度变化Fig.3 Concentration variations of 20 mg/L TBBPA in the R1,R2 and R3 experiments
R1和R3的对比结果表明,在121°C、100 kPa条件下加热20 min,会严重破坏W1-2菌株降解酶蛋白质的三维结构,导致酶活性丧失,因此R3中TBBPA质量浓度的变化显著小于R1(p<0.05).在黄孢原毛平革菌降解TBBPA的过程中,蛋白质分析结果显示其氧化还原酶、细胞色素单加氧酶P450等酶也出现了显著上调的情况[25].
R2和R3的对比结果表明,R3中TBBPA质量浓度的变化要大于R2.这是因为TBBPA具有很高的亲脂性,会被热处理过的菌株细胞少量吸附,使得R3中TBBPA的质量浓度有所降低.
综上可见,W1-2菌株主要以酶降解的模式去除TBBPA.
2.2 W1-2菌株的降解特性
为了解W1-2菌株在不同条件下的降解特性,以期寻求更适合未来实际应用的降解环境条件,提高降解效率和缩短降解周期,本研究通过改变单一条件进行了一系列的实验.
2.2.1 转速的影响
由图4可知,0 r/min条件下W1-2菌株对TBBPA的降解率显著低于其他转速条件(p<0.05).这表明W1-2菌株是一株好氧降解菌,高氧环境有利于降解的进行.不过,本实验中的降解率并未完全随转速的增加而增大.这表明当转速过大、剪切力过高时反而不利于菌株与TBBPA的结合,会使降解率下降,因此150 r/min是最佳降解条件.而在第5天,菌株生物量的多少与降解率的变化基本一致.
由图4还可知,0 r/min条件下W1-2菌株对TBBPA的降解率仍有63.9%.这表明W1-2菌株在低氧环境下仍具有较高的降解能力.
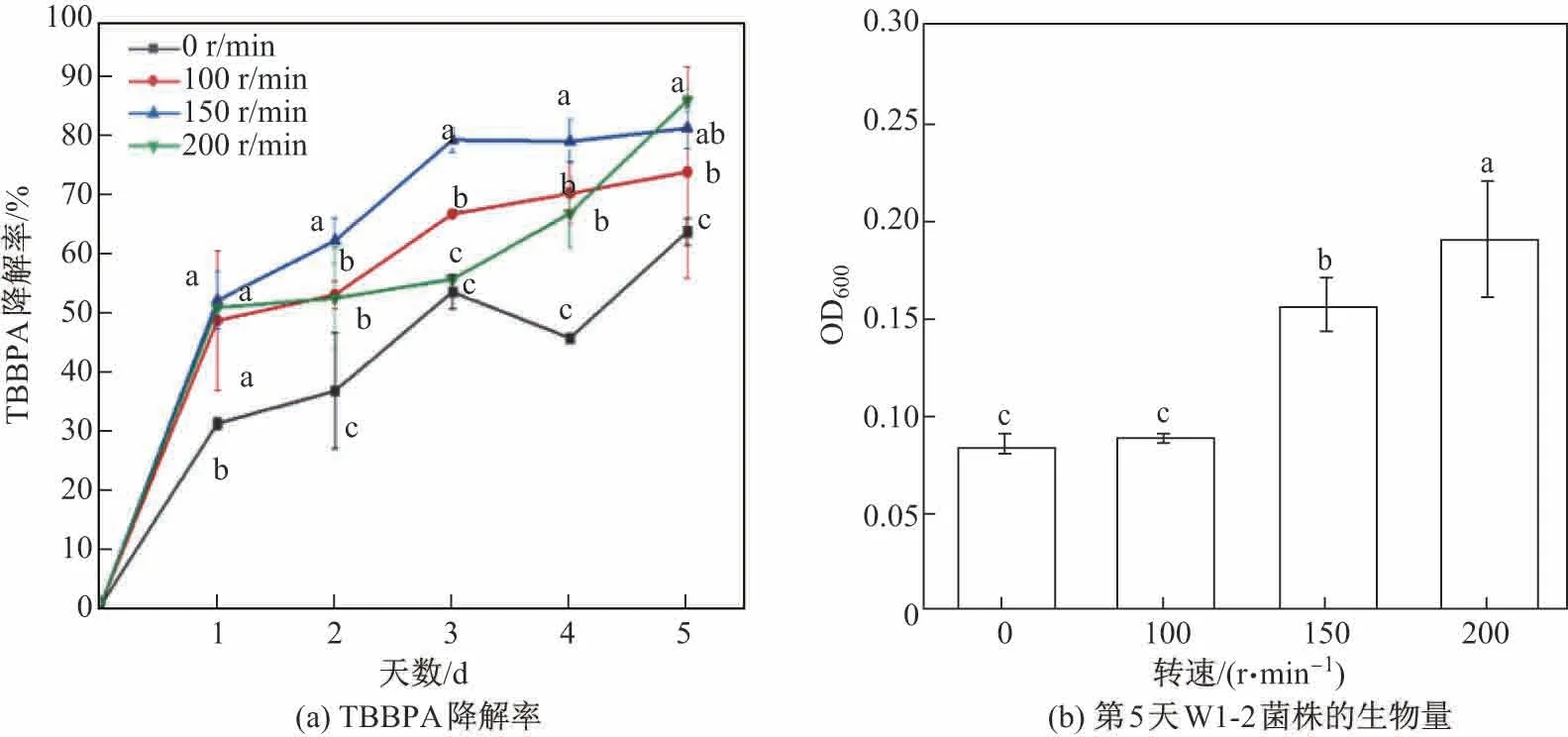
图4 转速对TBBPA降解率和第5天W1-2菌株生物量的影响Fig.4 Effects of rotation speed on TBBPA degradation rate and the biomass on the fifth day of strain W1-2
2.2.2 温度的影响
由图5可知,在30和35°C条件下,W1-2菌株的TBBPA降解率及生物量均明显高于25°C时(p<0.05).这表明,30~35°C是W1-2菌株生长以及降解TBBPA相关酶活性的最适宜条件.与W1-2菌株相似,Ochrobactrumsp.T菌株降解TBBPA的最佳温度为35°C[15];其在30和35°C条件下第5天的生物量也显著高于25°C.这说明在适宜的温度下,菌株的相关酶活性越强,对TBBPA的降解率和生物量就越高.在温度的影响下,生物量与降解率之间存在一定的相关性.

图5 温度对TBBPA降解率和第5天W1-2菌株生物量的影响Fig.5 Effects of incubation temperature on TBBPA degradation rate and the biomass on the fifth day of strain W1-2
2.2.3 初始质量浓度的影响
由图6可知,在无其他碳源辅助的条件下,W1-2菌株对初始质量浓度为10 mg/L的TBBPA的降解率最高,第5天时达到了91.4%.因此,TBBPA的初始质量浓度为10 mg/L是W1-2菌株的最佳降解条件.这与大多数TBBPA降解菌株需要添加除TBBPA以外的其他碳源(如酵母提取物、鼠李糖脂、葡萄糖和甲酸盐等)来增强菌株活性,以获得高降解率有着很大的不同[7,12,26-27].特别是假单胞好氧降解菌Pseudomonassp.fz,其只有在加入辅助碳源的条件下才能生长和起到降解作用[16].在初始质量浓度变化的条件下,生物量与降解率无相关性.
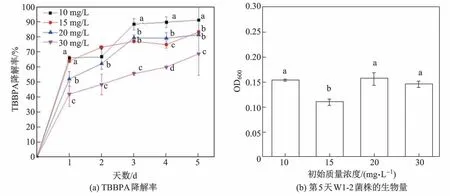
图6 初始质量浓度对TBBPA降解率和第5天W1-2菌株生物量的影响Fig.6 Effects of initial TBBPA concentration on TBBPA degradation rate and the biomass on the fifth day of strain W1-2
由图6还可知,虽然W1-2菌株对初始质量浓度为30 mg/L的TBBPA的降解率最低,但仍达到了68.9%.这一结果远远高于已报道的好氧菌株[11,15].因此,W1-2菌株在耐受高质量浓度TBBPA的毒性时,仍具较高的降解能力.
2.2.4 pH值的影响
由图7可知,pH=5条件下TBBPA的降解率仅为57.2%,显著低于pH=6条件下的69.6%和pH=7条件下的81.6%,更是远远低于pH=8和pH=9条件下近乎100%的降解率(p<0.05).这表明W1-2菌株在碱性或酸性环境中,降解率存在巨大差异.该差异是所有影响因素中最大的.由于过碱环境不利于生物生长,因此pH=8被认为是W1-2菌株的最佳降解条件.

图7 pH值对TBBPA降解率和第5天W1-2菌株生物量的影响Fig.7 Effects of pH value on TBBPA degradation rate and the biomass on the fifth day of strain W1-2
究其原因,一种可能的解释是由TBBPA溶解度的变化导致.当pH=7.5时,TBBPA的溶解度接近0%;而当pH=8和8.5时,溶解度由24%急剧上升为90%以上(100 mg/mL TBBPA).由此可知,环境中TBBPA的溶解度越高,会导致生物利用度升高、降解率增大,同时也解释了pH=8和pH=9条件下OD600数值偏低的原因.因为此时溶液的浊度受到了TBBPA溶解度的影响,比中性和酸性环境更清澈,从而使得OD600的数值偏低.
另一种可能的解释是由酶活性的变化导致.W1-2菌株中用于脱溴或氧化断裂TBBPA的酶更适合在碱性条件下发挥作用.特别是脱卤酶,其最适pH值在7.6~8.0之间[28].
综上所述,pH值、转速、温度和TBBPA初始质量浓度对W1-2菌株的降解结果都有影响,其中pH值是影响最大的因素.菌株降解TBBPA的适宜环境条件为10 mg/L初始质量浓度、pH=8、150 r/min、30~35°C.在较宽泛的环境范围内,微氧和高质量浓度TBBPA条件下,W1-2菌株也都有着较高的降解能力.
3 结论
以TBBPA为唯一碳源,从活性污泥中筛选出一株具有TBBPA降解能力的好氧菌株W1-2,并经过研究得到以下结论.
(1)W1-2菌株属于假单胞菌属,主要以酶降解的模式去除TBBPA.
(2)W1-2菌株能以TBBPA为唯一碳源和能源生长,并进行好氧降解.在30°C、pH=7和150 r/min下,5 d内对10 mg/L TBBPA的降解率为91.4%.
(3)W1-2菌株的适宜环境降解条件为10 mg/L TBBPA初始质量浓度、pH=8、150 r/min、30~35°C,其中pH值是影响降解率的最大因素.
(4)W1-2菌株是为数不多的可以在较宽泛的环境范围内,包括微氧和高质量浓度TBBPA条件下仍能保持较高降解率的好氧菌株,可应用于更广泛的TBBPA污染环境修复工作,减少TBBPA对环境和人体健康的危害.

