电沉积合成Ni–Fe(Co)/CF电催化剂及其催化性能
周熠铖,张翼婵,刘剑文,吴王平*
(电化学与腐蚀实验室,常州大学机械与轨道交通学院,江苏 常州 213164)
能源资源主要来自化石燃料,其中石油供应可能在50 ~ 150年内耗尽,同时化石燃料导致了许多环境问题,例如温室气体排放量增加[1]。考虑到包括经济、环境和人类健康在内的重要因素,开发可再生和可持续的清洁能源是人类面临的一个迫切问题。在各种替代能源战略中,氢气(H2)由于其燃烧能量密度高,原料丰富易得,燃烧产物为清洁水,被认为是未来最有希望替代化石燃料的能源之一。然而,高效制氢仍然面临着巨大的挑战。如今,氢主要通过蒸汽甲烷重整方式从天然气中获得,因此氢气的生产过程中会产生温室气体二氧化碳,对环境不友好[2]。海洋拥有地球上超过95%的水资源,用海水来制氢无疑能解决这一难题。电解水是生产纯氢的成熟方法[3],为可持续的氢气生产提供了有前景的解决方案,但是由于高能耗,该技术不能大规模使用。为了满足节能需求,可以通过设计具有高催化活性的阴极材料来降低析氢反应(HER)的过电位[4]。
大多数电催化剂由贵金属(例如铂、钌、铱和铑)制成,这是由于这些材料具有非常小的过电位[5]。然而Pt族金属稀缺且昂贵,并不适合于大规模生产氢。非贵金属析氢催化剂主要有基于Mo、W、Fe、Co、Ni等过渡金属的磷化物、硫化物、合金等[6-7]。由于Mo和W在地壳中的含量(约0.000 11%)远低于Fe、Co、Ni的含量(分别为6.8%、0.003%和0.008 9%),因此发展价格低廉的Fe、Co、Ni基电催化析氢催化剂更有利于电催化析氢技术的大规模产业化[8]。在工业碱性电解槽中,Ni基电极通常用作阴极生产氢,因为它成本低和 在高pH下耐腐蚀[9]。但是镍的电催化活性通常不高,更重要的是在进行持续性碱性析氢电解时催化剂易失活。研究者们致力于制成基于镍的合金来改善其活性和稳定性,研究最为广泛的是Ni–Mo[10]、Ni–Fe[11-12]、Ni–Co[13]、Ni–Fe–Co[14]、Ni–Sn[15]等合金电催化剂。镍基合金电催化剂的主要制备技术有气相合成、水热、化学镀、电沉积等[15-22]。其中,电沉积是一种功能强大且经济实惠的薄膜制备技术,无需真空,具有重复性好、制备工艺简单、耗时短、对实验条件要求低等优点[23-25]。国内外研究表明,电沉积制备的镍基三元合金电催化剂性能佳。然而,采用电沉积技术制备二元Ni–Fe和Ni–Co电催化剂的报道较少。Raj和Vasu[26]利用电沉积法在钢带上制备了Ni–Mo、Ni–Zn、Ni–W、Ni–Fe和Ni–Cr合金并测试了它们在碱性溶液中的析氢性能,结果表明析氢催化活性顺序为Ni–Mo > Ni–Zn > Ni–Co > Ni–W > Ni–Fe > Ni–Cr > Ni,其中Ni–Mo合金是活性最高、最稳定的析氢电催化剂。Darband等[27]采用电沉积技术制备的三元合金Ni–Fe–Co纳米电催化剂具有优异的电催化水电解的性能,析氢、析氧反应的塔菲尔斜率分别达到86 mV/dec和43 mV/dec,在电流密度100 mA/cm2下能长时间持续电催化活性。Zhang等[28]采用一步电沉积技术在泡沫镍表面制备出的菜花状Ni–Fe–Sn纳米电催化剂具有高比表面积和协同作用,因而催化性能较高,塔菲尔斜率达到70 mV/dec。Liu等[29]采用了电沉积技术在泡沫铜(CF)电极表面制备出NiP纳米颗粒薄膜,该催化剂表现出较高的析氢析氧电解水催化活性。这些研究都表明电沉积技术是一种简单有效的合成技术,可制备出低廉的非贵金属电解水催化剂[30]。此外,铜基材料也很适合作为功能性电催化剂,原因如下:(1)铜是地壳中含量最丰富的第一排过渡金属之一;(2)铜比贵金属和一些过渡金属便宜;(3)Cu具有广泛的氧化还原性质,价态灵活(如Cu0、Cu1+、Cu2+和Cu3+)。具有三维(3D)开孔结构的泡沫金属性质独特,有高的比表面积,适合用作自支撑基底,活性材料可以在其上原位生长或涂覆[31]。
目前,铂基材料通常被认为是析氢反应的基准电催化剂。Kumar等[32]通过DFT(密度泛函理论)计算预测,引入金属铜可调整异质界面结构,从而获得更优的H*吸附吉布斯自由能变(ΔGH*)和更低的水电解阻力。随后他们通过化学氧化、煅烧、电化学还原、电沉积、磷化等步骤,在CF上原位构建了由NiP2–FeP2与金属Cu纳米线(NW)组成的NiP2–FeP2/CuNW/CF电极,该电极在碱性介质中表现出前所未有的HER活性,在阴极电流密度10 mA/cm2下的过电位只有23.6 mV,比基准电催化剂Pt/C还要好。NiP2–FeP2/CFNW/CF电极在阴极电流密度恒定为1 000 mA/cm2时也表现出了50 h的优异稳定性。可见,泡沫铜的孔结构和集成3D电极可以极大地提高电催化性能。
在前期研究工作中采用电沉积技术在泡沫铜电极表面分别制备出Ni、Ir和Ni–Ir电催化剂,发现Ni–Ir表现出非常优异的电催化性能和持久的稳定性[23-24]。在本研究中,通过电沉积技术在泡沫铜基材上制备不含贵金属元素的Ni–Co/CF和Ni–Fe/CF二元合金薄膜电催化剂,研究其微观结构、晶体结构、化学组成及在1.0 mol/L KOH溶液中的析氢电催化性能。
1 实验
1.1 样品的制备
在制备样品前,先把纯氮气通入镀液中10 min并在电沉积期间使氮气持续覆盖镀液上方。所有化学试剂均为分析纯,电沉积催化剂的镀液成分和工艺参数见表1,其中NaCl起增强镀液导电性的作用,H3BO3起调节镀液pH的作用,Na3C6H5O7为配位剂。在所有电化学测试中都使用磁力搅拌棒搅拌溶液。泡沫铜样品(10 mm × 10 mm × 3 mm,孔隙率>98%,由苏州泰立泡沫金属公司提供)先浸入丙酮中30 min,并超声清洗10 min。然后在室温下将样品浸入30%(体积分数)的硝酸溶液中5 ~ 10 s。最后,用去离子水冲洗泡沫铜基体并以氮气吹干。
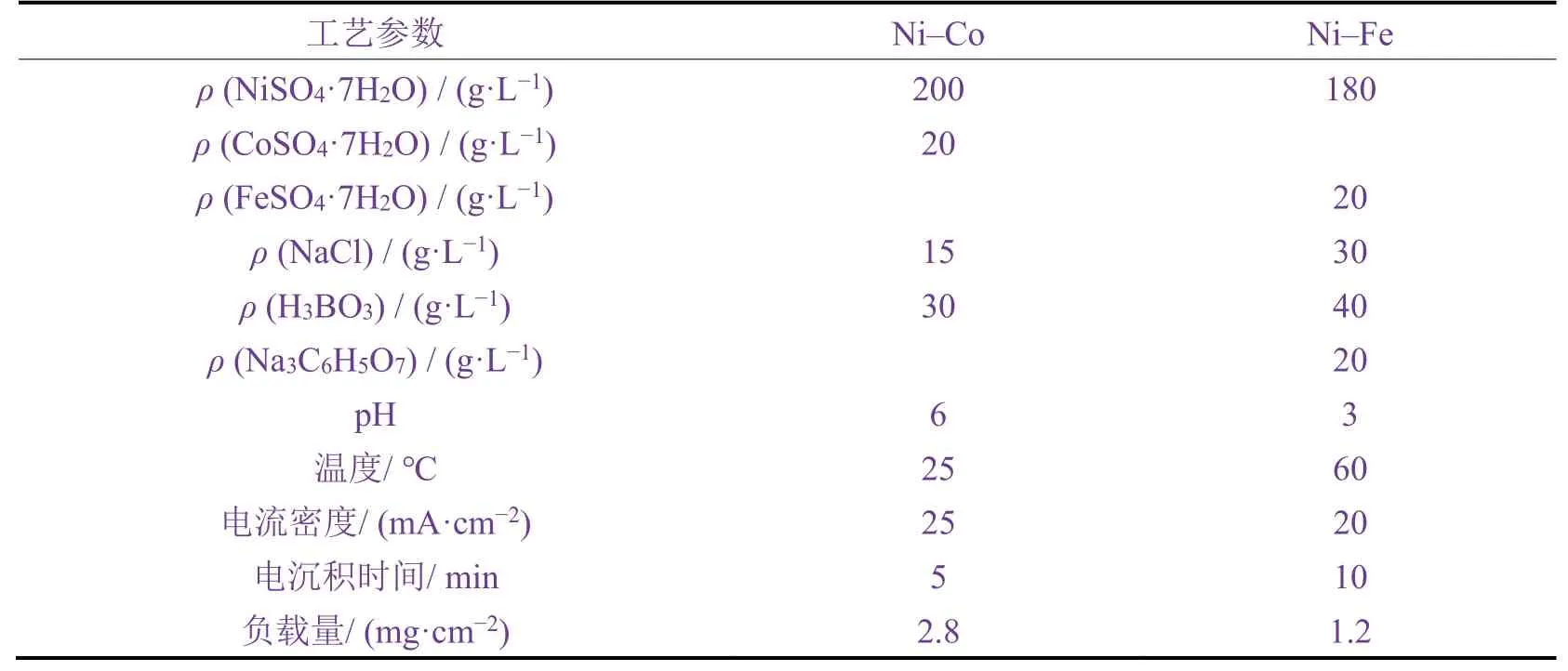
表1 镀液成分和电沉积工艺参数 Table 1 Bath composition and process parameters of electrodeposition
使用三电极电沉积系统制备Ni–Fe和Ni–Co合金薄膜,其中参比电极为Ag|AgCl|3 mol/L KCl,工作电极(泡沫铜)与辅助电极(铂片)距离为0.5 cm。铂电极在酸性镀液中呈惰性[23],不会影响阴极镀层的化学组成和电催化性能。使用CHI660E电化学工作站(上海辰华)控制电流。在一定的沉积温度下,通过PHS-3C型pH计检测镀液的pH,并在搅拌状态下采用移液管往电镀液中缓慢滴入5.0 mol/L NaOH,将pH调节至所需值。电沉积液的体积约为50 mL。沉积温度由HH-501恒温浴设备控制。电流密度是根据泡沫铜几何表面积计算后得到的。通过FA2004B分析天平(精度0.1 mg)测得沉积前后样品的质量变化。
1.2 电催化剂的表征方法
通过配备有Cu-Kα辐射源的Scintag型X射线衍射仪(XRD)测定所选沉积物的晶体结构。采用Zeiss Sigma SUPRA55型扫描电子显微镜(SEM)观察泡沫铜表面催化剂的微观结构和形态。通过X射线能谱分析仪(EDS)测定催化剂的化学组成。
1.3 电催化性能测试
所有电化学测试均在1.0 mol/L KOH溶液中进行,测试仪器为CHI660E电化学工作站。沉积在泡沫铜电极上的电催化剂用作工作电极。石墨棒电极与饱和甘汞电极(SCE)分别作为辅助电极和参比电极。以5 mV/s的扫描速率测试线性扫描伏安曲线(LSV),以10 mV/s的扫描速率测试循环伏安(CV)曲线。在开路电位下测试电化学阻抗谱(EIS),采用增强模式,频率从100 000 Hz至0.01 Hz,交流扰动幅值为5 mV。记录的电位针对欧姆降(iRS)电位进行校正,并将相对于SCE的电位φSCE换算成相对于可逆氢电极(RHE)的电位φRHE[16]:φRHE= φSCE+ 1.055 V。
2 结果与讨论
2.1 电催化剂的结构表征
如图1所示,泡沫铜表面粗糙,呈粉红色,而Ni–Fe/CF和Ni–Co/CF颜色类似,偏灰暗,并且在光照下可见表面分布着一些银白色亮点,表明泡沫铜电极上镀了一层金属。根据电沉积的电位−时间曲线,Ni–Fe和Ni–Co镀层的电沉积电位相对于Ag|AgCl参比电极分别为−0.92 V和−1.0 V,比较接近。从图2a可以看出,泡沫铜呈现多孔结构,其表面有不规则的凸起,晶粒尺寸为5 ~ 10 μm(见图2b)。从图2c可以看出,细小的Ni–Fe催化剂颗粒均匀分布在泡沫铜电极表面(图2c),表面还出现一些孔洞。从图2d所示的高倍SEM照片中可以清晰看到Ni–Fe颗粒连成排状,造成了沟壑形貌,颗粒直径为180 ~ 230 nm。由图2e可见,泡沫铜电极表面的Ni–Co薄膜较薄,且呈现出一定的孔隙结构。如图2h所示,Ni–Co催化剂颗粒排列紧密,尺寸为100 ~ 200 nm。

图1 泡沫铜(a)及其表面分别镀覆Ni–Fe合金(b)与Ni–Co合金(c)后的外观照片 Figure 1 Digital photos of copper foam before (a) and after electrodeposition of Ni–Fe alloy (b) and Ni–Co alloy (c), respectively
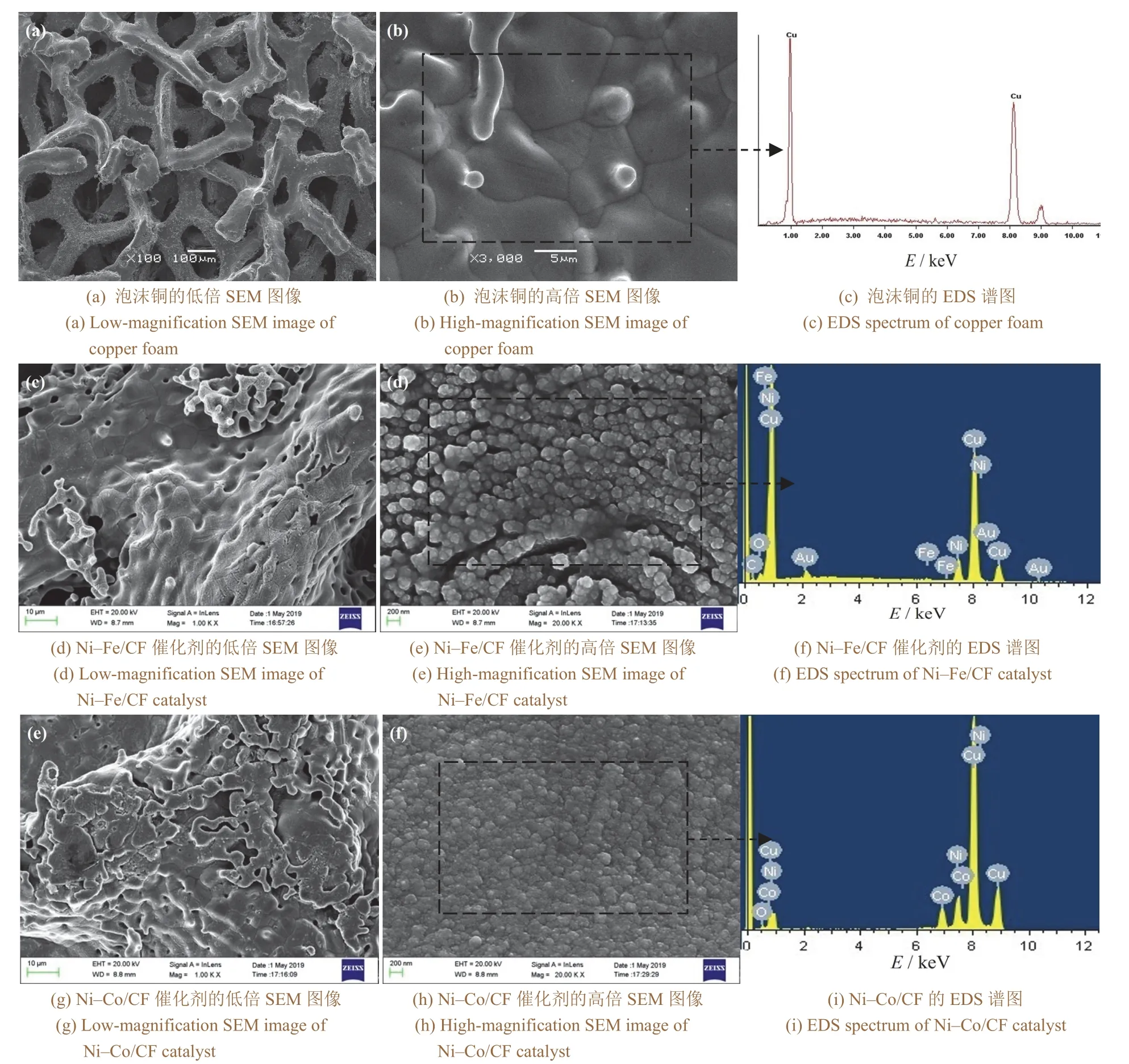
图2 泡沫铜、Ni–Fe/CF催化剂和Ni–Co/CF催化剂的SEM图像和EDS谱图 Figure 2 SEM images and EDS spectra of copper foam, Ni–Fe/CF catalyst, and Ni–Co/CF catalyst
在表2给出的Ni–Co和Ni–Fe薄膜的化学成分中Cu元素占了大部分,这是由于沉积时间较短,薄膜薄。Ni–Fe和Ni–Co合金共沉积属于异常共沉积[33-34]。Ni–Fe/CF中Ni和Fe元素的含量差距较大,只有极少量的Fe。而Ni–Co/CF中Co元素的含量只是略小于Ni元素的含量。

表2 由EDS测得的Ni–Co/CF和Ni–Fe/CF催化剂中的元素组成 Table 2 Elemental compositions of Ni–Co/CF and Ni–Fe/CF catalysts determined by EDS
为了评估Ni–Co/CF和Ni–Fe/CF催化剂的晶体状况,对其进行了XRD测试,结果如图3所示。2种电催化剂仅显示出铜的5个衍射峰,分别位于43.38°、50.42°、74.36°、89.7°和95.02°,没有检测到催化剂材料的衍射峰。泡沫铜的比表面积非常大,导致催化剂负载量非常低,Ni–Co/CF和Ni–Fe/CF催化剂的增重量分别是2.8 mg和1.2 mg,因此难以检测出催化剂的XRD信号。
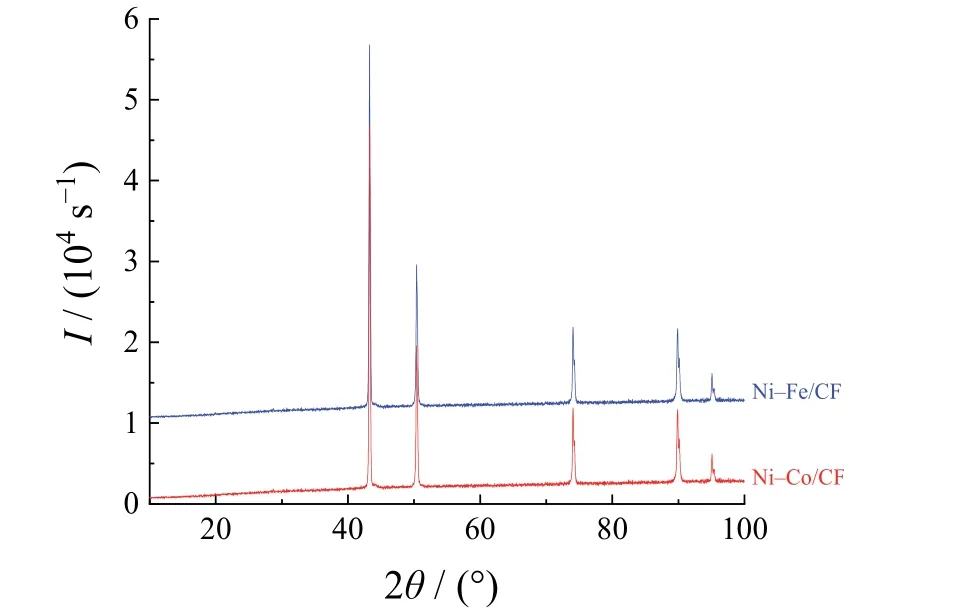
图3 Ni–Fe和Ni–Co合金薄膜沉积在泡沫铜上的XRD图 Figure 3 XRD patterns of Ni–Fe and Ni–Co alloy films deposited on Cu foams
2.2 电催化性能
在1.0 mol/L KOH溶液中研究了电催化剂的析氢活性。图4显示了电催化剂和泡沫铜的线性伏安扫描曲线和Tafel斜率,表3给出了由图4所得出的电化学数据。泡沫铜表现出非常差的电催化活性,而Ni–Co/CF薄膜显示出良好的析氢活性。起始电位是判断催化剂活性的依据之一。由表3可知,Ni–Co/CF薄膜的初始电位 远高于Ni–Fe/CF催化剂和泡沫铜的初始电位。另外,表3显示了为获得5、15和40 mA/cm2的电流密度,催化剂所需的过电位。Ni–Co/CF电催化剂显示出了优良的析氢性能,只需–0.160 V就能获得15 mA/cm2的电流密度,而且交换电流密度( j0)最大。

表3 不同电催化剂在1.0 mol/L KOH溶液中的析氢性能比较 Table 3 Comparison between hydrogen evolution properties of different electrocatalysts in 1.0 mol/L KOH solution
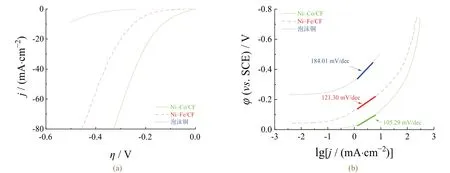
图4 电催化剂在1.0 mol/L KOH溶液中的线性伏安扫描曲线(a)和Tafel曲线(b)(扫速为5 mV/s) Figure 4 Linear sweep voltammograms (a) and Tafel curves (b) of electrocatalysts in 1.0 mol/L KOH solution at a scan rate of 5 mV/s
学者们普遍认为析氢反应在碱性环境中首先由电吸附质子放电引发[即Volmer反应,如式(1)所示],然后通过电解吸步骤[即Heyrovsky反应,如式(2)所示]或化学解吸步骤[即Tafel反应,如式(3)所示][35]。
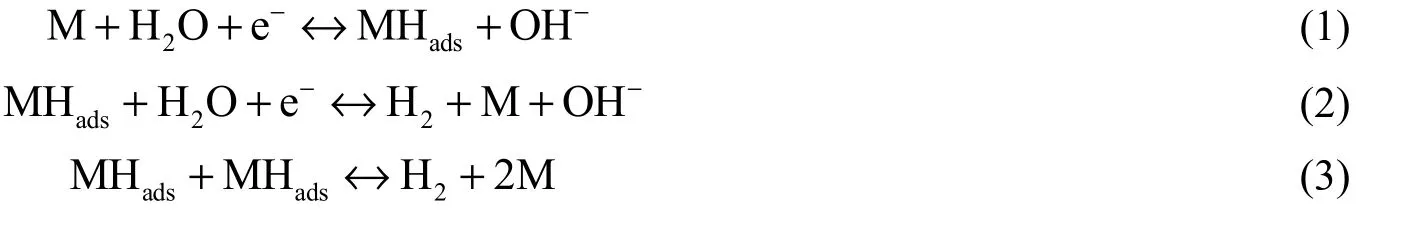
式中M代表催化剂、活化剂类物质。
Tafel斜率被广泛用于确定析氢反应的主要机制,在碱性溶液中可以是Volmer–Heyrovsky或Volmer–Tafel形式。根据经典理论,如果Volmer步骤是整个反应的控制阶段,那么Tafel斜率应为120 mV/dec;如果由Heyrovsky和Tafel反应控制,那么Tafel斜率应分别为40 mV/dec和30 mV/dec[36]。由图4b可知,Ni–Fe/CF和Ni–Co/CF的析氢动力学均由Volmer步骤控制,与理论值的偏差可归因于在电极表面产生了氧化物层。此外,Ni–Co/CF电极具有低的Tafel斜率表明其析氢动力学更好。而Ni–Fe/CF电极由于Fe含量非常少,基本上只显示出Ni的电催化性能,因此其Tafel斜率非常接近于纯Ni电极的Tafel斜率(120 mV/dec)。
从图5给出的泡沫铜和两种电催化剂在1.0 mol/L KOH溶液中的CV曲线可见,Ni–Co/CF的阳极氧化区更大,表现出更好的析氢性能。Ni–Co/CF电催化活性的提高可部分归因于电化学活性表面积的增大。通过计算CV曲线氧化电荷可以粗略估计Ni–Co/CF和Ni–Fe/CF电极的活化表面积。比表面积越大,电荷密度就越大。阳极电荷传递容量Qa由式(4)确定[23]。
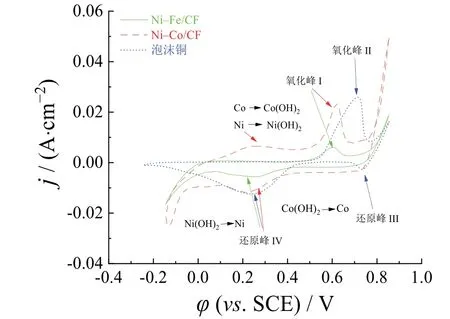
图5 Ni–Co/CF和Ni–Fe/CF薄膜在1.0 mol/L KOH溶液中的CV曲线(扫描速率:10 mV/s) Figure 5 CV curves for Ni–Co/CF and Ni–Fe/CF films in 1.0 mol/L KOH solution at scan rate 10 mV/s

式中φ是电极电位,j是测量电流密度,v是扫描速率,φc和φa分别是阴极和阳极电位限值。
经计算,Ni–Fe/CF和Ni–Co/CF的Qa分别为54 mC/cm2和187 mC/cm2,说明Ni–Co/CF的电化学活性面积大于Ni–Fe/CF。
电催化活性提高的另一部分原因可能是薄膜表面金属态物质的存在。在氧化区,催化剂中的Ni和Co在0 ~ 0.3 V的电位范围内分别被氧化成Ni(OH)2和Co(OH)2。0.70 V附近的氧化峰II来源于基体Cu的氧化,即Cu→Cu2+,0.6 V附近的氧化峰I是Cu→Cu+。位于0.75 V的还原峰III为Cu2+还原成金属Cu+,0.15 ~ 0.4 V的还原峰IV是Cu2+与Cu及Cu+与Cu复合过程的结果。经过氧化还原后,Cu元素对Ni–Fe/CF样品的影响较小。此外,在电位−0.15 V附近电流密度的大小顺序为Ni–Co/CF > Ni–Fe/CF > 泡沫铜。综上所述,Ni–Co/CF催化剂的催化性能较好。
通过电化学阻抗测量进一步研究在实验条件下催化剂析氢过程的反应动力学,结果如图6a所示。根据交流电路理论,给定电化学系统获得的阻抗谱可以与一个或多个等效电路相对应[37]。在图6b给出的等效电路模型中包含了溶液电阻(Rs)、恒相位角元件(CPE1、CPE2)、Warburg阻抗(Zw)和电荷转移电阻(Rct1、Rct2),拟合数据列于表4。
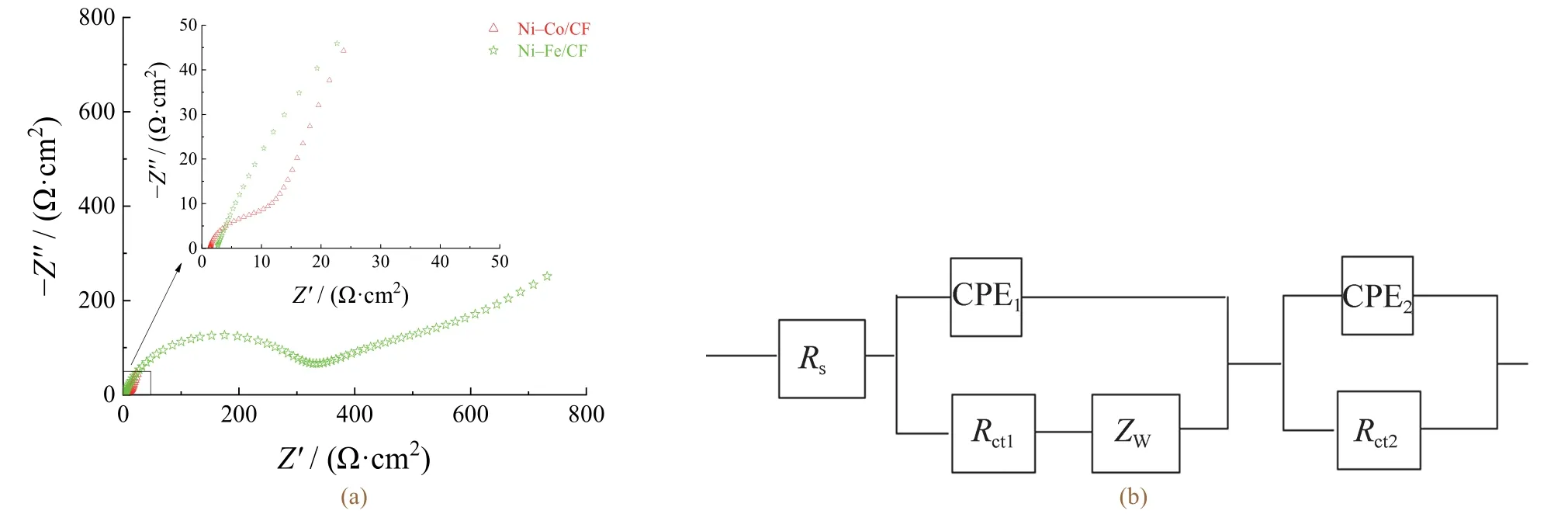
图6 Ni–Co/CF和Ni–Fe/CF催化剂在1.0 mol/L KOH溶液中的奈奎斯特图(a)和等效电路模型(b) Figure 6 Nyquist plots (a) of Ni–Co/CF and Ni–Fe/CF catalysts in 1.0 mol/L KOH solution and corresponding equivalent circuit model (b)
在阴极处,氢还原为H2的过程需要能量以从金属电极移除电子,并将电子连接到质子上,从而产生氢气。但是电子从电极转移到液相中氢离子的过程具有一定的电阻,即电荷转移电阻。电荷转移电阻越小,催化性能越好。由表4可知,Ni–Co/CF电催化剂的电荷转移电阻均低于Ni–Fe/CF薄膜,因此Ni–Co/CF的析氢性能优于Ni–Fe/CF。Ni–Co/CF电极表面的低电阻加速了电催化反应过程中的电子转移。另外,Warburg阻抗表示由扩散引起的浓差极化,而两催化剂间的Zw差别不大,电极动力学主要受电荷转移过程控制。

表4 等效电路元件参数 Table 4 Parameters of equivalent circuit components
在析氢反应中,通常有两种改善电催化活性的机制[38]。第一种机制涉及电子协同效应,这类似于2种或3种金属组分之间的电子平均效应,其中金属键导致氢吸附的第一步具有更好的能量状态并在下一步形成分子氢。第二种机制是在非均相催化过程中呈现出的逸出效应。在该机理中,一种金属组分简化了中间体氢的吸附,然后析氢反应终止于第二部分,从而改善了电催化活性[39]。另一个强烈影响催化性能的重要因素是气泡从催化剂表面分离过程中的行为。催化剂分解水制氢形成的气泡分离速率通常受表面性质的影响。亲水性表面有利于气泡的快速分离。表面改性是通过减少表面和电解质之间的接触面积来促进气泡分离的有效方法之一[40]。通常,用于增加活性表面积的表面是类似于金属泡沫的多孔结构,如本文中使用的泡沫铜基体。阴极表面电解水产生的氢气在分离过程中涉及2个阶段:首先,以优先方式在催化剂的活性表面形成小气泡;随后,小气泡一旦与表面分离,就会聚集在一起形成更大的气泡并与催化剂表面分离。对于多孔结构电极而言,氢气从催化剂表面转移到电解质期间,其形成的气泡会被捕获在多孔腔体结构中(如图7所示),这些大气泡从腔结构内部分离的速率对电催化性能具有显著影响。大气泡在多孔结构中停留的时间越长,电催化性能就越好[41]。

图7 多孔结构上气泡分离行为的示意图 Figure 7 Schematic diagram of bubble separation behavior on a porous structure
电极催化过程中的耐久性和稳定性是电极材料的关键特征。如图8所示,两种电催化剂在1.0 mol/L KOH溶液中以145 mV的恒电位电解8 h的过程中,Ni–Fe/CF的电流密度整体稳定,电流密度从最初的22 mA/cm2衰减至19 mA/cm2左右。相比之下,Ni–Co/CF电催化剂的电流密度衰减较多,在前2 h的衰减率达到22.3%。可见,Ni–Fe/CF电催化剂表现出良好的耐久性,Ni–Co/CF电催化剂则较差。这与Ni–Co/CF电催化剂的电流 密度保持在较高水平有关。如图9所示,在LSV循环400次后,2种电催化剂的析氢性能衰减幅度较大。为获得5 mA/cm2的电流密度,400次LSV循环后Ni–Co/CF电催化剂所需的过电位增加了97.1 mV,Ni–Fe/CF电催化剂的电位则增加了143.6 mV,说明2种电催化剂的析氢稳定性都不高。这与未通过旋转电极将电极表面析出的氢气去除有一定的关系,导致催化剂在氢气的作用下破碎后脱落,出现微孔、微裂纹等缺陷,裸露底铜面积较大,从而影响了催化剂催化水分解制氢的能力。
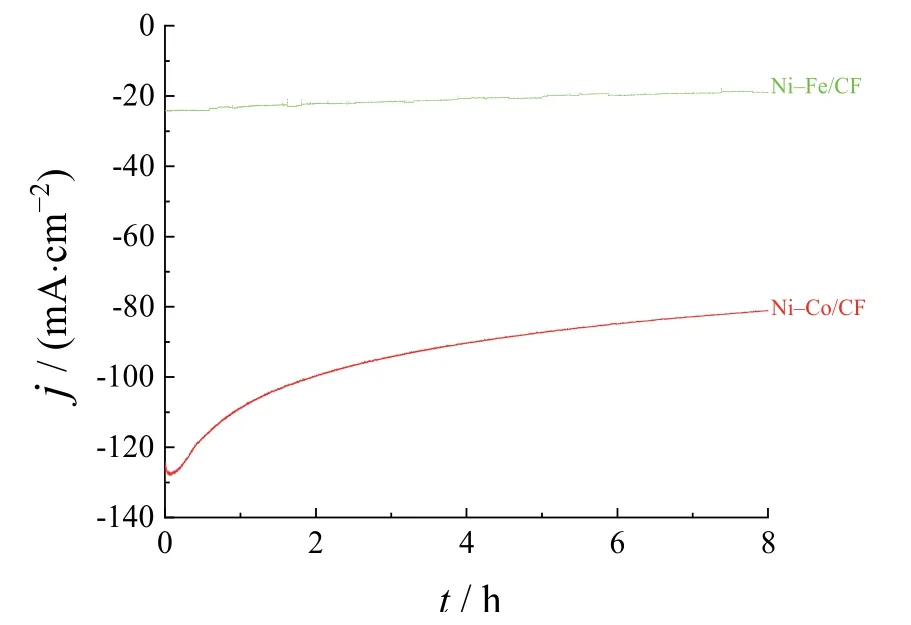
图8 在1.0 mol/L KOH溶液中对Ni–Co/CF和Ni–Fe/CF电催化剂进行−145 mV恒电位电解时的电流密度−时间曲线 Figure 8 Current density vs.time curves for Ni–Co/CF and Ni–Fe/CF electrocatalysts during potentiostatic electrolysis at −145 mV in 1.0 mol/L KOH solution
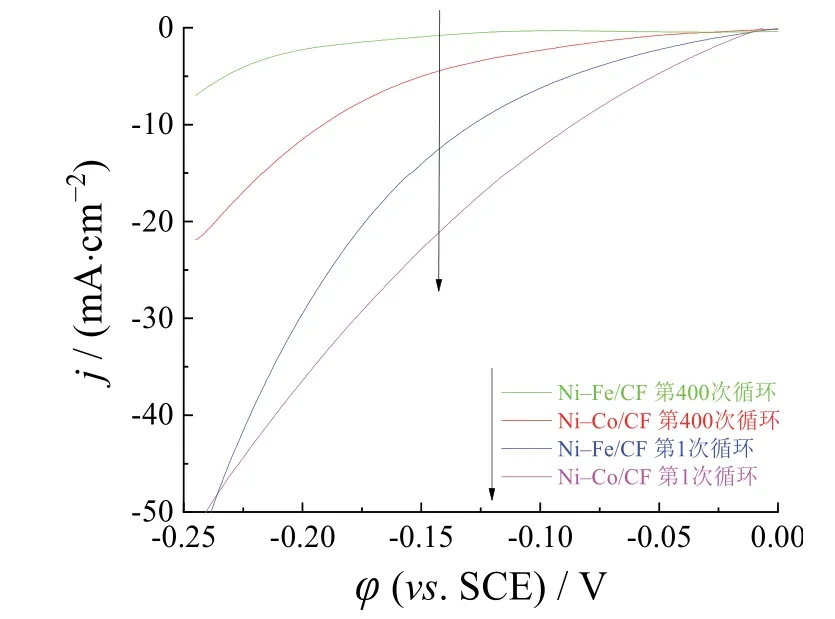
图9 Ni–Co/CF和Ni–Fe/CF电催化剂的初始和400次循环后的线性伏安扫描曲线 Figure 9 Linear sweep voltammograms of Ni–Co/CF and Ni–Fe/CF electrocatalysts initially and after 400 cycles
3 结论
通过电沉积方式在泡沫铜上制备了Ni–Co/CF和Ni–Fe/CF合金薄膜电催化剂,研究了它们的微观组织结构、化学组成和催化析氢性能。其中Ni–Co/CF催化剂具有更大的活性表面积和较好的析氢性能,仅需0.16 V过电位就能维持15 mA/cm2的电流密度。2种合金催化剂的析氢动力学均由Volmer步骤控制。

